吉林省规模化猪场断奶仔猪大肠杆菌分离鉴定与耐药表型及耐药基因检测
2022-01-25冀亚路姜秋杰袭恒豫毕斓婷陈椿桦付殿国孙长江顾敬敏韩文瑜
冀亚路,姜秋杰,袭恒豫,张 昊,毕斓婷,陈椿桦,付殿国,孙长江,冯 新,顾敬敏,3*,韩文瑜,3*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林省动物疫病预防控制中心, 吉林 长春 130062;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州225000)
仔猪腹泻是全球养猪业最具挑战性的疾病之一,每年都会造成巨大的经济损失。我国拥有世界上最大的生猪养殖产业,约占全世界生猪总数的50%,仔猪腹泻年均发病率和死亡率分别高达46.5%和15.0%,直接经济损失高达1.45亿美元[1-2]。引发仔猪腹泻的原因复杂多样,其中细菌性腹泻是主要病因之一,主要病原菌有大肠杆菌、沙门菌、魏氏梭菌等。大肠杆菌病是由致病性大肠埃希菌的某些血清型引起的以新生和幼龄动物为主的肠道感染性疾病。断奶仔猪患病后表现为仔猪黄痢、仔猪白痢及仔猪水肿等特征,发病率和死亡率较高。随着猪养殖业规模不断扩大,加之部分猪场生物安全体系不健全,细菌性大肠杆菌仔猪腹泻的发病率持续升高[3-4]。
抗生素治疗是临床上治疗仔猪细菌性腹泻的主要途径之一。此外,自发现抗生素对饲养动物具有促生长和预防疾病作用以来,抗生素作为饲料添加剂在动物养殖业中得到了长期广泛地应用和不规范使用[5],促进大肠杆菌耐药性的形成,使其表现出多重耐药性,甚至出现“超级细菌”。此外,大肠杆菌是动物肠道的正常菌群,被认为是耐药基因的储存库,耐药基因可以通过大肠杆菌扩散传播到环境中,给人类和养殖业造成潜在的威胁[6-14]。
2006年1月1日起,欧盟开始禁止在动物饲料中使用抗生素作为生长促进剂,荷兰等其他国家相继采取这一措施,以应对日益严重的细菌耐药性和抗生素残留问题。我国于2020年7月在饲料端实行禁抗,在此背景下,细菌解除了抗生素的经常性选择压力,病原菌的感染率与发病规律、耐药性必将发生变化,给细菌性疾病的防控带来新的挑战。
为了解饲料端“禁抗”前吉林省不同地区规模化生猪养殖场内大肠杆菌的耐药现状以及耐药基因存在情况,本研究对吉林省20个市(县)地区共35个规模化生猪养殖场断奶仔猪粪便样本进行大肠杆菌分离鉴定,并对分离菌株进行药物敏感性测定以及耐药基因PCR检测,为临床用药、进一步研究大肠杆菌耐药分子机制以及了解“禁抗”前吉林省大肠杆菌耐药情况奠定基础。
1 材料与方法
1.1 病料采集2020年6—8月,于吉林省20个市(县)35个生猪规模化养殖场采集断奶仔猪粪便样本(1 144份),其中腹泻仔猪(粪便成黄白痢)粪便样本994份,健康仔猪粪便样本150份。
1.2 主要试验材料无菌采样管(HBPT034-2)、无菌接种环、伊红美蓝琼脂培养基、麦康凯培养基、LB肉汤培养基以及琼脂糖购自青岛海博生物科技有限公司;革兰染色试剂盒购自珠海贝索生物科技有限公司;20种抗生素药敏片(青霉素、阿莫西林、氨苄西林、红霉素、四环素、强力霉素、头孢曲松钠、头孢西丁、头孢他啶、多黏菌素、磷霉素、复方新诺明、磺胺异恶唑、链霉素、卡纳霉素、庆大霉素、环丙沙星、诺氟沙星、恩诺沙星、氟苯尼考)购自杭州微生物试剂有限公司;Premix Tap酶(TaKaRa)购自长春海灵科贸有限公司。
1.3 粪便样本处理及细菌分离与纯化将采集的粪便样本在新鲜LB肉汤培养基中扩增培养后,使用无菌接种环蘸取扩增液,划线接种于麦康凯固体培养基,37℃培养 18~24 h。待麦康凯固体培养基上长出单菌落,使用无菌接种环挑取红色单菌落,划线接种至伊红-美蓝琼脂固体平板上,37℃培养18~24 h。最后,挑取疑似单个菌落(黑色带绿色金属光泽)接种至LB营养肉汤中,37℃培养18 h,-20℃保菌备用。另外,取培养物革兰染色镜检观察。
1.4 猪源分离菌株16S rRNA测序鉴定及生化鉴定使用“煮沸裂解法”提取纯化后分离菌株的全基因组DNA,送至上海生工生物工程技术服务有限公司16S rRNA测序,测序结果于NCBI中BLAST比对,鉴定标准按照同源性≥97%判定。同源性<97%的菌株利用微生物鉴定及药敏分析系统进行生化鉴定,结果见表1。

表1 猪源大肠杆菌分离菌株生化鉴定结果
1.5 猪源大肠杆菌分离株药物敏感性测定按照细菌药敏试纸使用说明书及K-B (Kirby-Bauer)法测定分离菌株对20种抗生素药物敏感性。将大肠杆菌分离株在LB肉汤培养基中培养至对数生长期(D600= 0.8),取200 μL菌液滴于LB琼脂平板上,使用无菌玻璃涂布棒均匀涂布菌液,待菌液晾干,将药敏片贴在涂布有菌液的LB琼脂平板上,37℃培养18~24 h,测量各抗生素抑菌圈直径,按照CLSI-2017说明书判定分离菌药物敏感性。
1.6 猪源大肠杆菌分离株耐药基因PCR测定采用PCR方法对大肠杆菌分离株进行耐药基因检测。耐药基因分别为β-内酰胺类blaTEM、blaCTX、blaSHV,喹诺酮类耐药基因qnrA、qnrS、qnrB、aac(6)-Ⅰb,氨基糖苷类耐药基因aph(3)-Ⅱa、aac(3)-Ⅰb、ant(3)-Ⅰa、aac(3)-Ⅱb,氯霉素类耐药基因floR,四环素类耐药基因tetM、tetK以及磺胺类耐药基因sulI。所有耐药基因序列参考文献[7-8],利用表2中引物序列扩增目的基因序列,引物序列由上海生工生物工程有限公司合成。PCR总体系25.0 μL:模板DNA 0.5 μL,上、下游引物各0.5 μL,2×Premix Tap酶12.5 μL,ddH2O 11.0 μL。PCR扩增程序:94℃预变性10 min;94℃变性35 s,57℃退火30 s,72℃延伸1 min,共30个循环;72℃ 终延伸10 min。PCR 产物用1%琼脂糖凝胶电泳检测,阳性PCR产物送上海生工生物工程有限公司测序,将测序结果序列在GenBank中比对,进一步确定耐药基因序列并作统计分析。
2 结果
2.1 猪源大肠杆菌分离与鉴定经16S rRNA测序和生化鉴定(表2),从1 144份粪便样本中共分离鉴定出大肠杆菌892株,总阳性率为77.97%。其中健康粪便样本大肠杆菌分离率为72.67%(109/150),腹泻粪便样本大肠杆菌分离率78.78%(783/994),无论健康粪便还是腹泻粪便样本,均出现很高的大肠杆菌阳性率,各猪场大肠杆菌阳性率见表3。

表2 耐药基因PCR扩增引物序列
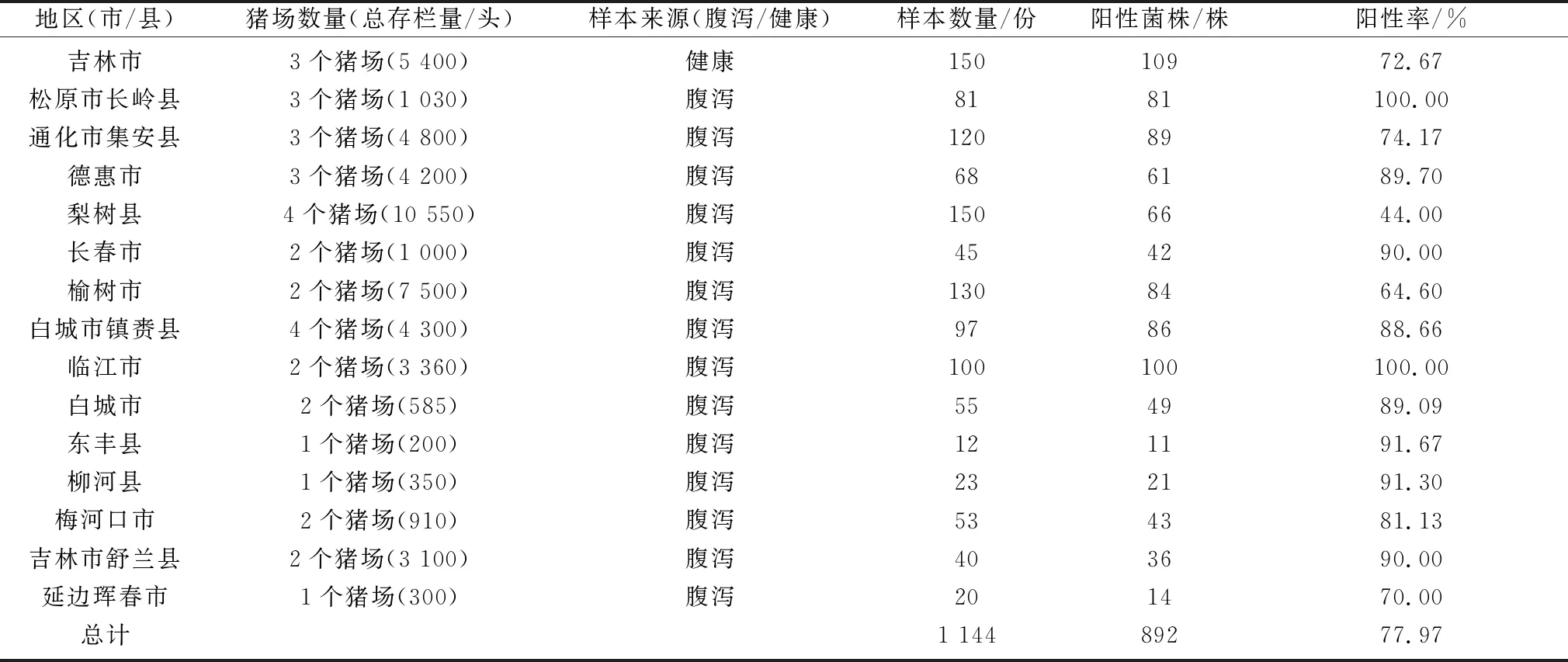
表3 吉林省规模化生猪养殖场大肠杆菌分离情况
2.2 猪源大肠杆菌分离株药物敏感性测定结果对892株大肠杆菌分离株进行20种抗生素药物敏感性测定,结果如表4、图1所示,大肠杆菌分离菌株对β-内酰胺类、大环内酯类、四环素类、磺胺类、氨基糖苷类、喹诺酮类以及氯霉素类抗生素表现出高耐药率。其中对β-内酰胺类抗生素如青霉素、阿莫西林、氨苄西林耐药率分别为99.78%,81.66%,100.00%;红霉素、四环素、强力霉素、复方新诺明、磺胺异恶唑耐药率分别为91.27%,99.56%,95.41%,84.50%,98.69%;对链霉素、卡纳霉素、庆大霉素以及氟苯尼考耐药率分别为90.83%,70.52%,34.28%,71.83%。相比之下,对头孢类和多磷类抗生素耐药率较低,例如对头孢类抗生素头孢曲松钠、头孢西丁、头孢他啶的耐药率分别为38.86%,17.17%,28.17%,对磷霉素耐药率仅为6.99%。此外,未发现多黏菌素耐药菌株。所有大肠杆菌分离株均表现出3种以上抗生素耐药性,近50%菌株对10种抗生素产生耐药性,表明吉林省规模化猪场大肠杆菌具有严重的多重耐药性。
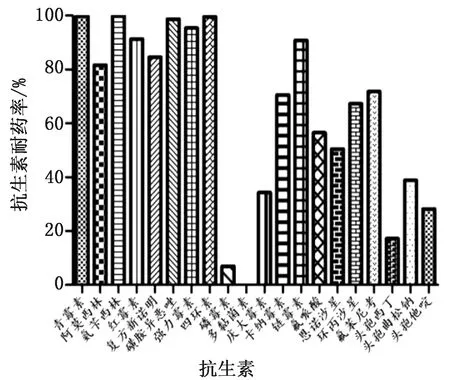
图1 猪源大肠杆菌分离株抗生素耐药率统计

表4 猪源大肠杆菌分离株抗生素耐药率统计 %
2.3 猪源大肠杆菌分离株耐药基因检测随机选择不同猪场来源大肠杆菌分离株(每个猪场来源随机选取5株,共175株)进行常见耐药基因检测;PCR结果表明检测的13种耐药基因均能扩增出特异性目的片段。将对应PCR产物测序序列在NCBI比对后,阳性基因序列与GenBank参考序列同源性在95%以上,表明PCR阳性目的基因与本研究测定的目的基因相符合。耐药基因检测统计结果见表5,β-内酰胺类耐药基因blaTEM和blaCTX的检出率分别为30.85%(54/175)和15.42%(27/175);磺胺类耐药基因sulⅠ和氯霉素类耐药基因floR检出率分别为37.71% (66/175)和57.14%(100/175);氨基糖苷类耐药基因aph(3)-Ⅱa、aac(3)-Ⅰb、ant(3)-Ⅰa和aac(3)-Ⅱb检出率分别为16.00%(28/175),36.57%(64/175),66.28%(116/175),40.57%(71/175);喹诺酮类耐药基因qnrB、qnrS和aac(6)-Ⅰb检出率分别为18.85%(33/175),21.14% (37/175),41.71%(73/175);而四环素类耐药基因tetM和喹诺酮类耐药基因qnrA检出率较低,分别为4.57%(8/175)和1.14%(2/175)。所有大肠杆菌分离株均未检出blaSHV、tetK、mcr-1和mcr-2耐药基因。
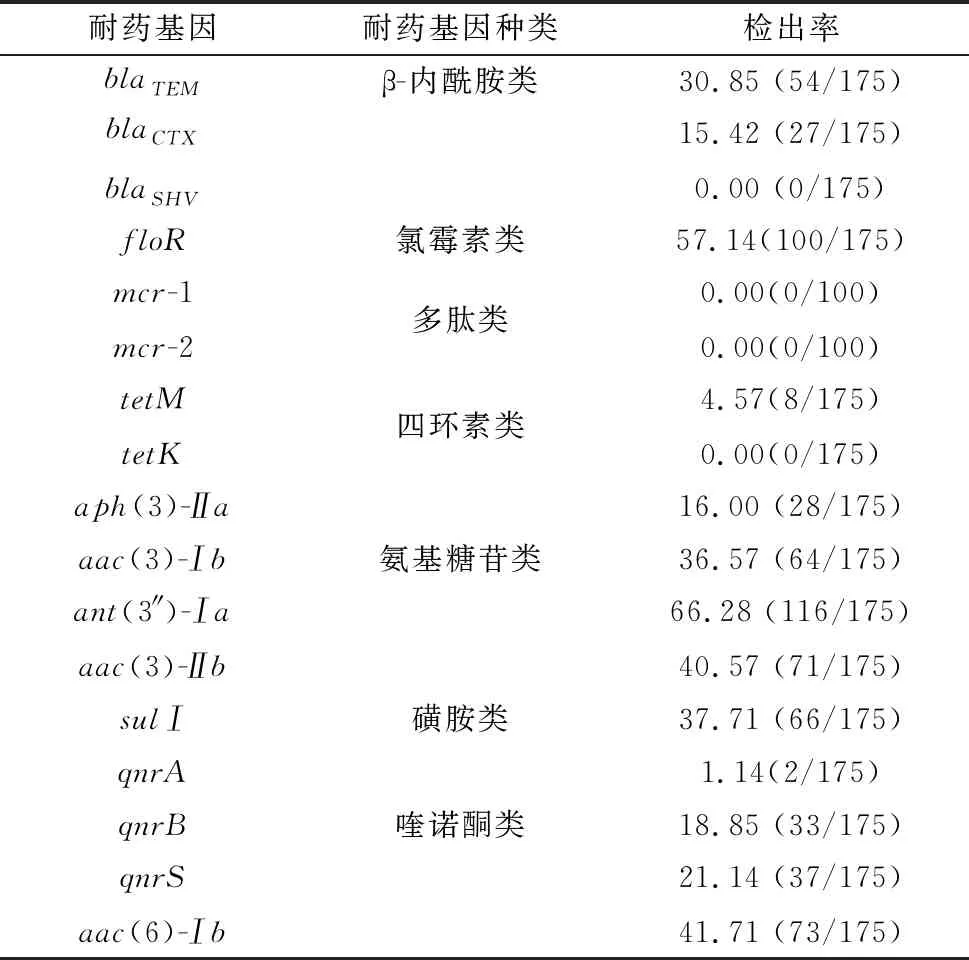
表5 猪源大肠杆菌耐药基因检测统计 %
此外,对大肠杆菌分离株含有的耐药基因数量及耐药基因类别数量进行统计,结果表明84.00%(147/175)的大肠杆菌含有2种以上耐药基因,66.28%(116/175)含有3种以上耐药基因,37.71%(66/175)含有5种以上耐药基因,仅7.42%(13/175)大肠杆菌基因组中未发现被检测耐药基因(图2A)。将阳性耐药基因进行分类后,仅有10.28%(18/175)大肠杆菌含有1类抗生素耐药基因,82.28%(144/175)的大肠杆菌分离株基因组中含有2类以上抗生素耐药基因,其中23.42%大肠杆菌含有2类耐药基因,27.40%(48/175)含有3类耐药基因,22.85%(40/175)含有4类耐药基因,8.57%含有5类耐药基因,未发现同时含有6类耐药基因的菌株(图2B)。
3 讨论
由于大肠杆菌容易获得耐药性,常被用作监测细菌抗生素耐药性指标[14-19]。因此,本研究以大肠杆菌为研究对象,从吉林省规模化生猪养殖场断奶仔猪腹泻粪便和健康粪便样本中分离大肠杆菌,并对其耐药性和耐药基因进行检测。
从大肠杆菌分离率结果可以看出,无论是断奶仔猪腹泻粪便样本源大肠杆菌还是健康粪便样本大肠杆菌,均呈现较高的分离率,两者无统计学差异,这可能由于大肠杆菌属于条件致病菌,而引起断奶仔猪腹泻的原因错综复杂,还可能与环境、饮食、气候以及自身免疫力相关[7]。由于腹泻粪便样本采集于多个市(县)的多个猪场,大肠杆菌分离率呈现地区差异,其中松原市长岭县样本(81份,3个猪场)和临江市样本(100份,2个猪场)大肠杆菌分离率最高,达到100.00%,梨树县样本(150份,5个猪场)大肠杆菌分离率最低,仅为44.00%。其余地区猪场大肠杆菌分离率在64.60%~91.67%,不同地区腹泻粪便样本之间的大肠杆菌分离率差异性可能由于不同猪场用药差异导致。此外,大肠杆菌的污染会加重其他致病菌感染,因此,需要制定合理措施减轻猪场大肠杆菌污染。
本研究对所有大肠杆菌分离株进行药物敏感性测定,多重耐药性菌株达到100.00%,而刘哲等[6]对2016年吉林省猪源大肠杆菌分离株(42株)药敏测定结果显示多重耐药率为93.84%,这表明吉林省生猪养殖场大肠杆菌耐药情况严重,且在不断加重。 在测定的10类抗生素中,大肠杆菌分离株对β-内酰胺类(青霉素、氨苄西林)、大环内酯类(红霉素)、四环素类(四环素、强力霉素)以及氨基糖苷类(链霉素)具有高度耐药性(耐药率>90%),而这几类抗生素均被批准用于生猪养殖业中,普遍用于兽医临床[20],进一步表明大肠杆菌耐药性与抗生素使用时间和广泛性有直接关系。相比之下,大肠杆菌分离株对头孢类(<40.00%)和磷霉素类(6.99%)抗生素耐药率较低,值得注意的是,未发现多黏菌素耐药菌株。这与刘哲等[6]对吉林和河南以及戴秀美等[21]对伊通和哈尔滨地区猪源大肠杆菌耐药性研究结果相似,大肠杆菌对不常用的抗生素耐药率低,基于此可考虑用药方向。此外,不同研究结果存在部分差异,可能与研究样本采集量及采集地点差异有关。
菌株耐药基因与药物敏感性存在一定的相关性,对大肠杆菌耐药基因进行检测有助于了解流行株耐药基因存在的种类、数量及流行规律,能够更好地指导临床用药。本研究结果显示氨基糖苷类、氯霉素类、磺胺类以及喹诺酮类耐药基因均被检出,但检出率均低于相应抗生素耐药率,这可能与抗生素存在多种耐药机制有关。氯霉素类耐药基因floR和氨基糖苷类耐药基因ant(3)-Ⅰa检出率较高,这可能是该类抗生素的主要耐药机制。产超广谱β-内酰胺酶大肠杆菌因其均可在临床患者及健康人群检出而受到关注[22],猪源大肠杆菌被认为可能是人类传染源之一。本研究检测到blaTEM和blaCTX2种基因,未检测出blaSHV基因,这与之前研究结果相似,但blaTEM基因检出率低于之前研究结果[7,23]。此外,四环素耐药基因tetM检出率较低,仅为4.75%,且未检测到tetK基因,而四环素对大肠杆菌分离株表现出极高耐药率,具体耐药机制有待进一步研究。
综上,本研究展示了吉林省生猪养殖场猪源大肠杆菌的耐药性和耐药基因携带情况,为临床用药提供指导意见,为进一步研究大肠杆菌耐药分子机制奠定了基础。
