油茶炭疽病病原菌的分离与鉴定
2022-01-25陈美霞王泽榕阮俊峰郑世仲
陈美霞, 王泽榕, 石 玲, 阮俊峰, 郑世仲, 刘 伟
(1.宁德师范学院生命科学学院,福建 宁德 352100; 2.福建省科技厅产学研合作示范基地,福建 宁德 352100; 3.福建农林大学农学院,福建 福州 350002; 4.宁德市林业局,福建 宁德 352100)
油茶(Camelliaoleifera)是我国木本类油料的主栽物种,也是世界四大木本食用油料植物之一。油茶含有较高的不饱和脂肪酸,可降低血脂、肝脂,预防血栓、冠心病和动脉粥样硬化[1]。炭疽属(Colletotrichum)真菌可侵染油茶,造成落叶、落花、落果,阻碍油茶产业的健康发展[1]。当温度为25~30 ℃、湿度88%时,油茶炭疽病发病率达到高峰,病斑沿叶片中间、边缘发生,多呈现半圆形或者不规则形状,颜色为黑褐色或褐色,内轮生小黑点[2]。
目前对引起油茶炭疽病的主要病原菌尚无定论。李河等[3]首次报道引起油茶炭疽病的病原菌为果生刺盘孢菌(Colletotrichumfructicola)。朱英芝等[4]通过形态学和多基因系统分析,鉴定了广西油茶炭疽病的病原菌为胶孢炭疽菌(ColletotrichumgloeosporioidesPenz.);李杨等[5]从湖南、江西、海南的油茶炭疽病叶中分离到5株病原菌,经鉴定为山茶刺盘孢(Colletotrichumcamelliae),该病原菌首次在油茶上报道。帅小春等[6]认为贵州油茶炭疽病的病原菌为果生炭疽菌(Colletotrichumfructicola)、山茶炭疽菌(Colletotrichumcamelliae)和卡哈瓦炭疽菌(Colletotrichumkahawae),其中卡哈瓦炭疽菌是首次报道引起油茶炭疽病的病原菌。也有研究者认为暹逻刺盘孢菌(Colletotrichumsiamense)[7]、博宁炭疽菌(Colletotrichumboninense)[8]是油茶炭疽病的主要致病菌。可见,不同地区油茶炭疽病致病菌不同,明确其病原菌是今后针对性防治病害的基础。因此,本研究以福建省宁德市洋中镇油茶炭疽病病叶为材料,依照科赫氏法则进行病原菌分离,结合传统的形态学和多基因序列分析对病原菌进行鉴定,以明确当地油茶炭疽病的主要病原菌,为科学防治病害提供依据。
1 材料与方法
1.1 供试材料
油茶炭疽病病叶采自福建省宁德市蕉城区洋中镇万恒绿园农业发展有限公司基地。
1.2 试验方法
1.2.1 病原菌的分离纯化 采用常规组织分离法进行病原菌的分离纯化。利用菌丝尖端切割分离法,挑取少许病原菌边缘菌丝,接入PDA培养基中央。将培养皿倒置于26 ℃恒温培养箱中培养4 d,观察菌落形态、反面颜色特征。分离纯化5代后,即得到病原菌菌株。
1.2.2 病原菌形态鉴定及孢子观察 用内径5 mm的打孔器将病原菌菌株打孔制成菌饼,接种到PDA培养基上。培养10 d后挑取菌丝和孢子,并用显微镜观察病原菌菌丝及分生孢子的形态。
1.2.3 病原菌致病性测试 用无菌水冲洗油茶叶片30 min,置于铺有无菌水润湿滤纸的培养皿中。用无菌接种针轻轻刮伤叶片表皮形成造伤叶片,采用直径5 mm打孔器将纯化后的菌饼接种至伤口处,置于26 ℃恒温培养箱培养,以空白培养基为对照(CK)。每天观察叶片发病症状并拍照记录,待产生病斑后再次分离病原菌。
1.2.4 PCR扩增 将分离纯化后的病原菌接种到培养基上,倒置于26 ℃恒温培养箱培养7 d后,按照植物基因组DNA试剂盒(天根生化科技有限公司,北京)提取基因组DNA。采用1%(质量比)琼脂糖凝胶电泳检测DNA纯度,超微量紫外可见分光光度计Nano Drop 2000c(Thermo Scientific)检测DNA样本浓度。检测合格的样本参照Weir et al[9]进行ITS通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′)、ACT通用引物(ACT-F:5′-ATGTGCAAGGCCGGTTTCGC-3′,ACT-R:5′-TCCTCCGCTTATTGATATGC-3′)、CAL通用引物(CAL-F:5′-GAATTCAAGGAGGCCTTCTC-3′,CAL-R:5′-CTTCTGCATCATGAGCTGGAC-3′)PCR扩增。扩增体系为:DNA模板 1 μL;上下游引物各1 μL;dNTP(10 mmol·L-1) 0.5 μL;Taq DNA聚合酶0.2 μL;Buffer缓冲液2 μL;ddH2O补齐至20 μL。扩增程序为:94 ℃预变性10 min; 94 ℃变性30 s,退火45 s;72 ℃延伸1 min,30个循环;72 ℃延伸10 min。其中,ITS、ACT、CAL基因扩增退火温度分别为55、55、59 ℃。取5 μL PCR扩增产物于1%琼脂糖凝胶电泳(120 V, 15 min),检测PCR产物片段大小,符合预期大小的PCR产物委托福州铂尚生物技术有限公司测序。
1.2.5 系统发育分析 测序后的基因序列经过Clustal W软件处理后,按照ITS-ACT-CAL的顺序依次首尾相连拼接。在GenBank数据库中进行BLASTN比对,下载同时含有3个基因序列的炭疽菌株,参照文献[9],选取模式菌株序列作为参考序列进行聚类分析。使用MEGA 7.0软件构建系统发育树,采用邻接(neighbor-joining, NJ)聚类分析,经1 000次重复计算检验值[10]。
2 结果与分析
2.1 病原菌分离及形态学鉴定
油茶病害叶片分离纯化出5株单菌株,命名为DH1、DH2、DH3、DH4和DH5。5株菌株在PDA培养基上边缘规则完整,中央颜色稍浅,灰褐色;菌落背面灰白色,中央微黄色后期呈黑褐色,边缘米白色。显微镜下观察表明,菌丝致密呈棉花状,不易挑起,分枝,具隔膜,表面干燥。DH1、DH2、DH4、DH5分生孢子呈长椭圆形,无色无隔膜,大小为(14.5~16.2)×(4.8~5.7) μm,初步确认为果生炭疽菌。DH3分生孢子光滑,单孢,长椭圆形或圆柱形,两端圆或一端略粗,大小为(14.8~17.4)×(4.8~6.1) μm,初步确认为山茶炭疽菌。菌落及孢子形态分别如图1、图2所示。
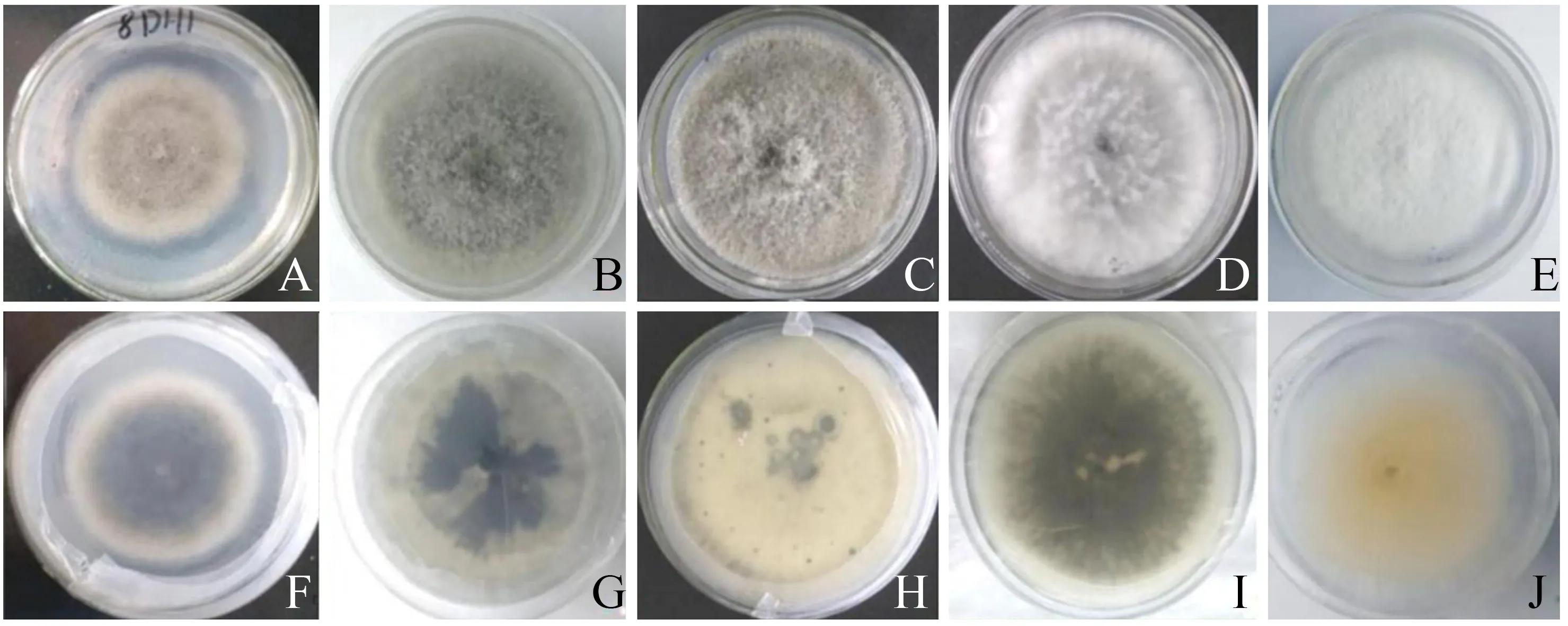
A~E分别表示DH1~DH5菌落的正面;F~J分别表示DH1~DH5菌落的背面。图1 油茶炭疽病病原菌菌落形态Figure 1 Morphology of the anthracnose pathogen colony of Camellia oleifera

A~E分别表示DH1~DH5的分生孢子;标尺为10 μm。图2 油茶炭疽病病原菌分生孢子与菌丝形态Figure 2 Morphology of the conidia and mycelium in anthracnose pathogen of Camellia oleifera
2.2 病原菌致病性测定
取5株单菌株的菌丝块接种至健康油茶成叶,3 d后叶片开始发病,病斑呈黑褐色或褐色,随后病斑扩展形成不规则状,5 d时叶缘呈紫红色,与田间病叶症状一致,对照组叶片不发病(图3)。从病斑处再次分离病原菌,显微镜下观察菌丝和孢子的形态与接种菌株一致,表明DH1、DH2、DH3、DH4、DH5菌株是油茶炭疽病的主要病原菌,并且是从伤口处侵染。
2.3 PCR克隆及测序
提取5株菌株基因组DNA,电泳检测发现,点样孔附近干净无杂带,条带单一。超微量紫外可见分光光度仪测定DNA浓度分别为50、50、45.2、50、42.5 ng·μL-1,D260 nm/280 nm分别为1.82、1.89、1.89、1.86、1.81,均在1.8~2.0之间,说明提取的核酸DNA效果良好,可用于下一步试验。
ITS、ACT、CAL基因PCR扩增结果如图4。扩增条带单一、清晰明亮,片段集中在500、250、1 000 bp左右,片段大小与预期一致,可送至生物公司测序。

A、G为对照组叶片正反面;B~F分别为DH1~DH5叶片正面发病症状;H~L分别为DH1~DH5叶片反面发病症状。图3 炭疽病病原菌对油茶叶片的侵染Figure 3 Leaves of Camellia oleifera infected by anthracnose artificially
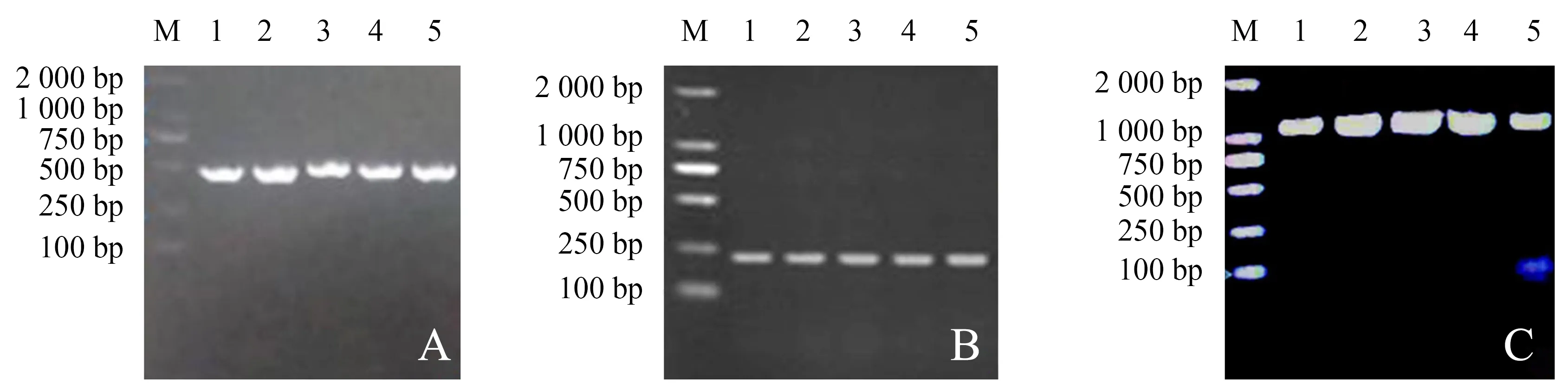
A~C分别表示ITS、ACT、CAL基因PCR扩增;M为2 000 bp marker;1~5分别表示DH1~DH5菌株。图4 PCR扩增电泳图Figure 4 The amplification results of PCR
2.4 多基因序列聚类分析
PCR产物序列通过NCBI Blast同源性比对,按照ITS-CAL-ACT的顺序依次首尾相连拼接,下载同源性较高的炭疽属相似种对应的18个基因序列构建系统发育树。由图5可知,分离的DH1、DH2、DH4、DH5菌株与ZJJH、ICMP18613和ICMP18581的果生炭疽菌聚在一起,DH3与GDBL-8的山茶炭疽菌聚在一起,与形态学鉴定结果相一致。
3 讨论
随着分子技术普及以及测序成本的下降,核苷酸序列早已成为病原菌鉴定和检测的重要依据。对于炭疽菌属复合种而言,培养基形态、孢子大小、菌株培养特性差异不大,但同属不同种炭疽菌培养性质不稳定,易受外界环境影响[11]。随着寄主与病原菌之间的相互协同进化,仅依靠形态学差异进行鉴定不够准确,而借助单一引物序列PCR扩增,片段太小不足以反映菌株差异,导致准确性较低。Taylor et al[12]采用多基因谱系识别生物学种。随着多基因分析方法的引入,通过不同基因片段扩增位点不同,可以准确鉴定之前混淆的多种病原菌。
本研究从福建省宁德市蕉城区洋中镇采集的油茶病叶中分离到5株病原菌,采用ITS、ACT、CAL基因序列联合分析进行分子鉴定,5个菌株聚类成2个组,即果生炭疽菌和山茶炭疽菌聚类组,进一步佐证了形态学鉴定结果。其中4株为果生炭疽菌(占比80%),为优势种群,1株为山茶炭疽菌(占比20%),为弱势种群。Li et al[13]研究表明,油茶炭疽病病原菌有果生炭疽菌、暹逻炭疽菌、胶孢炭疽菌、山茶炭疽菌,其中果生炭疽菌为优势种群,占比83.9%。本研究分离得到的4株果生炭疽菌菌落、孢子形态相似,但经NCBI数据库比对,其测序后的序列差异较大,说明同地区分离到的病原菌虽为同一属,但不是同一生理小种。因此,对病原菌的鉴定应结合形态学、分子生物学,以确保结果的准确性。李河等[3]从湖南、江西、湖北、重庆、海南、福建6个省(市)分离得到23株病原菌,鉴定为果生炭疽菌,说明该菌分布广泛;系统进化树显示,同一地区分离的菌株并未全部聚在一起,说明地理特异性不明显。该团队随后又分离到5株山茶刺盘孢[6]。从湖南省油茶炭疽病病叶中分离到的病原菌包含果生炭疽菌、暹罗炭疽菌、胶孢炭疽菌、山茶炭疽菌和哈锐炭疽菌5种[14]。Wang et al[15]从8个省(自治区)20个油茶发病果实和叶片中分离获得232个菌株,鉴定为山茶炭疽菌、果生炭疽菌、暹罗炭疽菌、隐秘炭疽菌和胶孢炭疽菌,说明同一地区油茶炭疽病并非仅一种病原菌,而是由多种病原菌共同侵染导致病害爆发。目前,有关油茶炭疽病的有效防治措施未见报道。王建伟等[16]认为,使用专用有机肥可促进油茶根系和叶片的生长,提高产量,并改善油茶林地土壤氮库,但需注意合理配施。
本研究明确了引起洋中油茶炭疽病的主要病原菌为果生炭疽菌和山茶炭疽菌,今后将开展孢子萌发条件、致病机理、病原菌与宿主之间关系的研究,为有针对性地防治病害提供依据。
