巨峰葡萄籽原花青素的纯化与抗氧化活性分析
2022-01-24伍勇邹蝶卢倩程驰夏珊冯媛媛邱成书薛飞龙张晓娟刘红玲
伍勇,邹蝶,卢倩,程驰,夏珊,冯媛媛,邱成书,薛飞龙,张晓娟,刘红玲
(成都师范学院化学与生命科学学院,特色园艺生物资源开发与利用四川省高校重点实验室,四川 成都 611130)
原花青素是一类具有特殊生物活性的黄酮类化合物[1],由不同数量的儿茶素和表儿茶素单体聚合而成,其中低聚原花青素具有较强的清除自由基能力[2]。多种动物实验和系统研究论证了原花青素的安全性,也发现原花青素能抑制红细胞膜过氧化、预防心脑血管等疾病[3],还具有抗衰老、抗癌、保护肝肾等功能[4]。因此原花青素被广泛用于食品、药品以及化妆品等领域。大量的研究表明[5-6],葡萄加工副产物葡萄籽可作为原花青素的来源,葡萄籽原花青素具有抗氧化、清除自由基的作用,具有广阔的应用前景。赤霞珠作为最受欢迎的酿酒葡萄品种,巨峰作为新兴的广受欢迎的葡萄品种,在四川拥有90%以上的种植面积,两种葡萄籽原花青素都具有潜在研究价值。
对原花青素复杂的生物学活性深入研究发现,原花青素的生理活性差异除了受单体组成的差异影响,也因原花青素聚合度高低而改变,因此,原花青素的提取、纯化工艺对其功能发挥和工业利用显得尤为重要。李彩霞等[7]在赤霞珠原花青素的研究中确定了最佳提取工艺为料液比1∶40(g/mL),硫酸铵质量分数10%,超声时间50 min。毛建利等[8]优化原花青素提取工艺,优化工艺为提取温度 81 ℃、料液比 1∶40(g/mL)、乙醇浓度56%、提取时间20 h,提取率为5.61%。而有关巨峰葡萄籽原花青素的提取工艺还未见报道。葡萄籽中原花青素的分离纯化方法有溶剂萃取分离法、大孔吸附树脂法、静态膜过滤法等。溶剂萃取法的工艺路线较为复杂,有机溶剂回收难,且产品纯度不高。静态膜过滤法由于过滤技术的局限,难以有效去除产品中的大分子杂质[9]。大孔树脂吸附洗脱法具有选择性好、吸附容量大、机械强度高等优点,在天然产物工业化的提取分离中得到广泛应用[10]。马小琴等[11]通过大孔树脂对原花青素的吸附率、解吸附率等的影响研究,发现HPD-400型大孔树脂对原花青素的分离纯化具有较高效率。范明霞等[12]比较了7种大孔树脂对原花青素的分离纯化效果,表明HPD-400大孔树脂具有较好效果。有关葡萄籽原花青素的提取工艺已开展大量研究,但有关巨峰葡萄籽原花青素提取与纯化工艺的研究薄弱,影响其应用开发。根据早期研究中原花青素的聚合物分子特点与HPD-400树脂的吸附特征相似,上样流速、洗脱剂浓度、洗脱剂pH值等[13]都影响最终原花青素纯化效果,因此选择HPD-400树脂作为纯化吸附材料,并探究相关因素对提取纯度的影响。
巨峰葡萄是近年来四川地区新兴种植品种,大量加工副产物葡萄籽有待开发利用。因此,本研究考察吸附时间、提取液pH值、上样流速、乙醇浓度、洗脱液pH值对原花青素分离纯化效果的影响,采用正交试验进行优化与验证,优化巨峰葡萄籽原花青素纯化工艺,并以赤霞珠葡萄籽作为参照,对其抗氧化活性进行分析,为其抗氧化产品开发和利用提供依据。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
巨峰葡萄籽:市售;赤霞珠葡萄籽:上海海瑞生物试剂有限公司。
HPD-400大孔吸附树脂:山东东鸿化工有限公司;果胶酶(>50 000 U/g):上海瑞永生物科技有限公司;纤维素酶(>40 000 U/g):新疆沃德生物科技有限公司;香兰素(分析纯):上海笛柏生物科技有限公司;原花青素B1(色谱纯):上海源叶生物科技有限公司;没食子酸(分析纯)、福林酚(分析纯):北京索莱宝科技有限公司。
1.1.2 主要设备
标口砂芯层析柱(外径30mm×300mm)、RE-52AA旋转蒸发器:上海亚荣生化仪器厂;HH数显三用恒温水箱:江苏金坛市金城国胜实验仪器厂;HC-2064离心机:上海浦东天本离心机械有限公司;KYNS-100C恒温培养摇床:上海苏坤实业有限公司;UV754紫外可见分光光度计:上海菁华科技仪器有限公司。
1.2 方法
1.2.1 提取工艺
将葡萄籽洗净后放入恒温干燥箱50℃烘干至恒重,粉碎机粉碎后过40目筛备用。称取100 g巨峰葡萄籽样品,用500 mL石油醚浸泡12 h,抽滤、干燥制得脱脂葡萄籽。以1∶25(g/mL)的料液比加入80%乙醇,调节溶液的pH 5.0,加入0.8 mg/g的复合酶[果胶酶∶纤维素酶=1∶3(质量比)],酶解温度 40℃条件下酶解 30min,再在35℃下超声35min,取出后放入离心机3500r/min离心10 min,取其上清液,即为原花青素的提取液,用于后续试验。
1.2.2 单因素试验
HPD-400大孔树脂用95%乙醇浸泡24 h充分溶胀,纯水冲洗至无白色浑浊液,再用5%HCl溶液浸泡3 h后用蒸馏水洗至pH值为中性,5%NaOH溶液浸泡3 h后用蒸馏水洗至中性后备用[12]。
影响最终原花青素纯度的因素共5个,包括影响HPD-400大孔树脂对提取液中原花青素吸附因素:吸附时间、提取液pH值、上样流速;影响原花青素洗脱的因素:乙醇浓度、洗脱液pH值。具体操作如下。
1)准确称取5份预处理大孔树脂各2.000 g,放入5个100 mL锥形瓶中,分别加入20 mL原花青素提取液,并用保鲜膜封住瓶口,pH 7.0下,在25℃,100 r/min转速条件下振荡 10 h,在吸附时间 2、4、6、8、10 h 条件下,参照原花青素检测方法在500 nm波长下检测吸附后溶液吸光值,计算原花青素浓度和吸附率。
2)按照1)中步骤和条件,一定吸附时间下,改变提取液 pH 值分别为 4.0、4.5、5.0、5.5、6.0 进行树脂吸附,检测吸附后溶液吸光值,计算原花青素浓度和吸附率。
3)按照2)中最优的提取液pH值,上样总量为20 mL,并以 1.0、2.0、3.0、4.0、5.0 mL/min 的流速上样,按照一定的吸附时间收集溶液,计算原花青素浓度和吸附率。
4)按照上述最优吸附时间、提取液pH值、上样流速,分别称取2.000 g葡萄籽于5个100 mL锥形瓶中,加入20 mL浓度分别为20%、30%、40%、50%、60%乙醇洗脱液,于25℃,100 r/min转速振荡8 h后,参照原花青素检测方法在500 nm波长下检测洗脱后溶液吸光值,计算原花青素浓度和洗脱率。
5)按照4)步骤和条件,选择最适乙醇浓度,调节其 pH 值分别为 5.0、6.0、7.0、8.0、9.0 进行原花青素洗脱,计算原花青素浓度和洗脱率。
1.2.3 正交试验
单因素试验中选择了吸附时间、提取液pH值、上样流速、乙醇浓度、洗脱液pH值5个因素,综合试验结果与纯化的时间效率,确定L9(34)正交试验因素与水平,并利用软件DX-8设计,开展正交试验,根据试验结果的数学模型预测,确定最优纯化工艺条件。正交因素水平设计见表1。

表1 正交因素水平设计Table 1 Orthogonal factor horizontal design
1.2.4 指标测定
1.2.4.1 原花青素浓度及含量的测定
参考草醛法进行测定[14],将1%的香草醛溶液和8%的盐酸溶液按照1∶1(体积比)配为显色剂,制备0.1、0.3、0.5 、0.7、0.9 mg/mL 的原花青素标准液,分别取标准液2 mL,加入10 mL的显色剂,摇匀,30℃下避光保温30 min,在500 nm波长下检测吸光值并制作标准曲线,结果如图1所示。
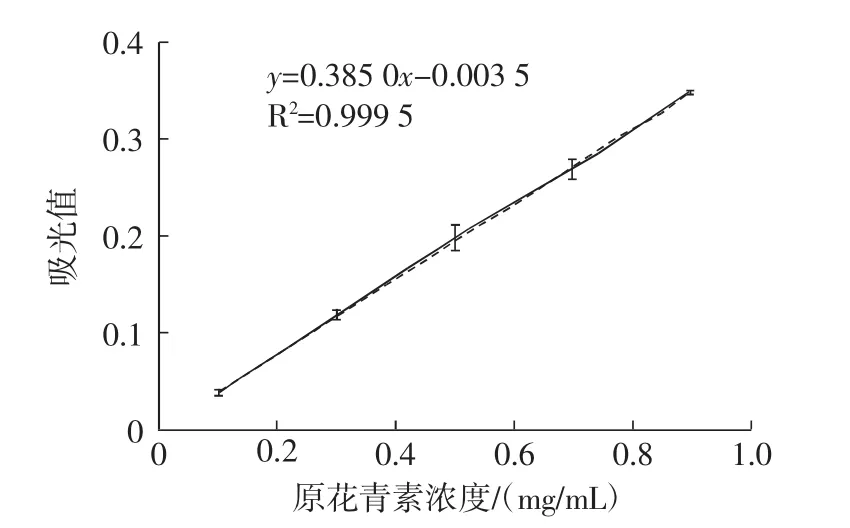
图1 原花青素测定标准曲线Fig.1 The standard curve of the original anthocyanins
取2 mL待测溶液,按照上述方法进行检测,根据标准曲线计算出样品原花青素浓度,样品的原花青素含量计算公式如下。

式中:W1为原花青素含量,%;C1为原花青素浓度,mg/mL;V1为提取液体积,mL;m1为粗提物冻干后质量,mg。
1.2.4.2 多酚浓度及含量的测定
参照文献[15]的方法,配制0.1 mg/mL没食子酸溶液,稀释成 0、0.02、0.04、0.06、0.08、0.10 mg/mL 不同梯度,从中分别取0.5 mL没食子酸依次加入0.2 mg/mL福林酚试剂1 mL、20%Na2CO3溶液1.5 mL,40℃水浴30 min,在波长760 nm下测定吸光值,建立标准曲线。所得线性回归方程为 Y=7.74X-0.004 3(0<X<0.10),R2=0.9965。
取0.5 mL待测样,按照上述测定方法检测计算多酚浓度,多酚含量计算公式如下。

式中:W2为多酚含量,%;C2为多酚浓度,mg/mL;V2为提取液体积,mL;m1为粗提物冻干后质量,mg。
1.2.4.3 DPPH自由基清除率测定
配制 DPPH 标准液浓度为 2、4、6、8、10、12 mg/L,各称取样液0.1 mL,加入上述DPPH标准液3.9 mL,立即摇匀,在波长517 nm处测定吸光值,记为Ai,空白对照组以甲醇代替样品测定吸光值,记为A0,并以抗坏血酸(VC)作为对照组。DPPH自由基清除率计算公式如下。
DPPH自由基清除率/%=[(A0-Ai)/A0]×100
1.2.4.4 还原力测定
称量纯化后的提取物,以水作为溶剂配制成浓度为 20、40、60、80、100、150 mg/L 的溶液,取 1 mL 依次加入1%铁氰化钾溶液2.5mL和pH6.6、浓度为0.2mol/L磷酸盐缓冲溶液2.5mL,立即混匀,置于50℃恒温水浴保温20 min后,加入10%三氯乙酸2.5 mL,混匀后3 000 r/min下离心10 min,吸取2.5 mL上清液,依次加入0.1%三氯化铁0.5 mL,蒸馏水2.5 mL,在700 nm下检测吸光值,并以抗坏血酸作为对照组。
1.2.4.5 超氧阴离子自由基清除率测定
根据参考文献[16]的方法稍作改变,提前配制浓度 10、20、30、40、50、60 mg/L 待测液,取 50 mmol/L Tris-HCl缓冲溶液(pH 8.2)4.5 mL,加入 2 mL 蒸馏水,混匀后置于37℃水浴20 min,加入0.5 mL待测溶液,随后立即加入0.5 mL已预热至37℃的25 mmol/L邻苯三酚溶液,37℃水浴反应6 min,最后加入1.0 mL 10 mmol/L的HCl缓冲溶液终止反应。取反应液用蒸馏水稀释后在波长325 nm处测定吸光值,超氧阴离子自由基清除率计算公式如下。
超氧阴离子自由基清除率/%=[1-(Ai-Ai0)/A0]×100
式中:Ai为待测样吸光值;A0为蒸馏水空白对照的吸光值;Ai0为蒸馏水替代邻苯三酚参与反应体系的吸光值。
1.2.4.6 原花青素纯度测定
将HPD-400大孔树脂吸附纯化后的提取物,浓缩、冷冻干燥至恒重,用分析天平称量样品质量,并根据下面公式计算所得原花青素的纯度[17-19]。
原花青素纯度/%=C1×V1/M
式中:C1为原花青素提取液浓度,mg/mL;V1为所配制待测液体积,mL,M为纯化后产物质量,mg。
1.2.5 吸附率与洗脱率计算
吸附率与洗脱率计算公式如下。
吸附率/%=[(C1-C2)/C1]×100
式中:C1为吸附前溶液中原花青素浓度,mg/mL;C2为吸附后溶液中原花青素浓度,mg/mL。
洗脱率/%=[Cd×Vd/(C0-Cr)×VA]×100
式中:C0为原花青素提取液的初始浓度,mg/mL;Cr为吸附后锥形瓶中原花青素的浓度,mg/mL;Cd为解吸液中的原花青素的浓度,mg/mL;Vd为解吸时所用的溶剂体积,mL;VA为初始加入的样液体积,mL。
1.3 数据处理
利用软件DX-8对正交试验进行设计和结果分析,利用EXCEL进行数据统计,利用SPSS 20进行多酚、原花青素含量One-way单因素方差显著性分析,利用GraphPad Prism 8进行图形制作。
2 结果与分析
2.1 单因素试验
2.1.1 吸附时间对原花青素浓度和吸附率的影响
吸附时间对原花青素浓度和吸附率的影响见图2。

图2 吸附时间对原花青素浓度和吸附率的影响Fig.2 Influence of adsorption time on the concentration and adsorption rate of procyanidins
由图2可知,随着吸附时间的延长,原花青素吸附率逐渐上升,8 h以后趋于平缓。而吸附后溶液的原花青素浓度随时间延长而下降,同样在8 h趋于平缓,原花青素的吸附率和吸附后溶液浓度变化表现出相关性。在吸附时间为8 h时,原花青素的吸附率较大,考虑时间成本,选取最佳吸附时间为8 h。
2.1.2 提取液pH值对原花青素浓度和吸附率的影响
提取液pH值对原花青素浓度和吸附率的影响见图3。
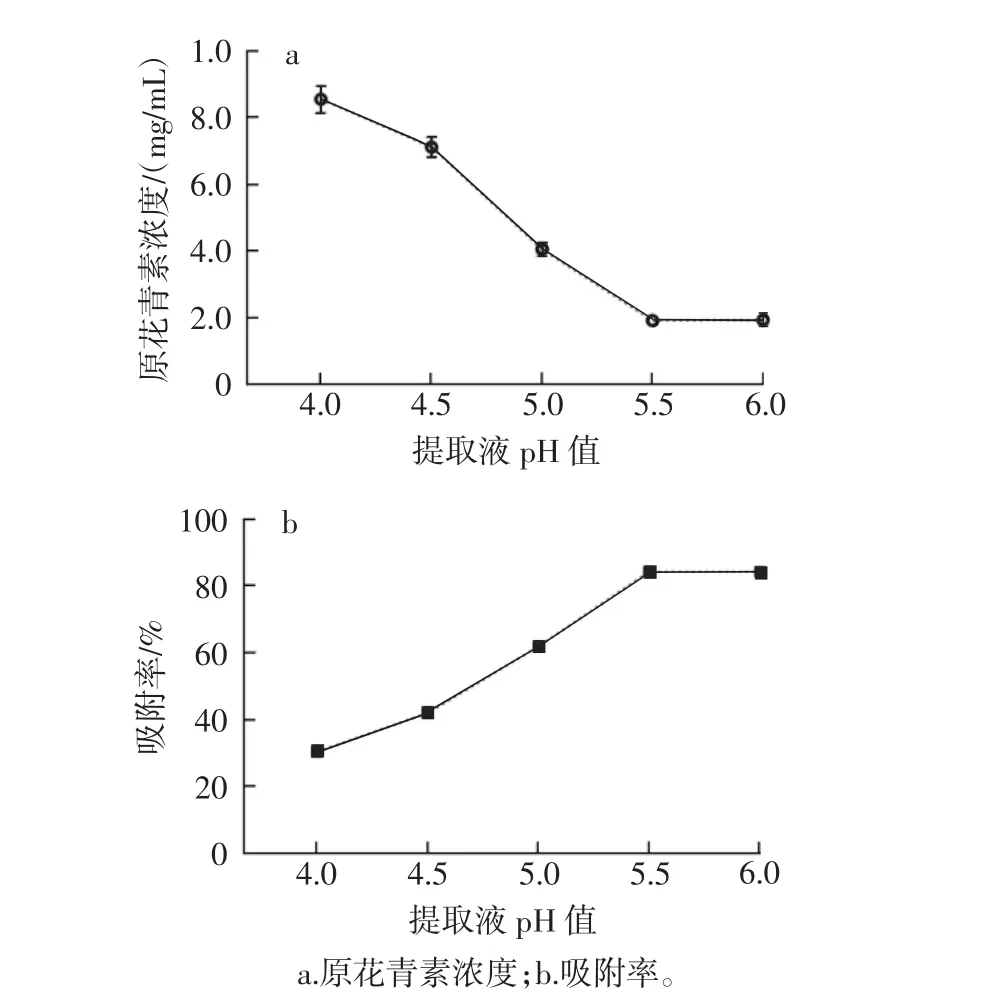
图3 提取液pH值对原花青素浓度和吸附率的影响Fig.3 Influence of pH value of extraction solution on concentration and adsorption rate of procyanidins
由图3可知,提取液pH值在4.0~5.5时,原花青素浓度呈现下降趋势,pH值为5.5~6.0时,其浓度呈现稳定的趋势;结合原花青素吸附率,在提取液pH值为5.5时,其吸附率最高为84.26%。因此,最佳提取液pH值为5.5。
HPD-400大孔树脂具有中极性,对离子态的物质几乎不吸附,只对分子态物质吸附[20],溶液中pH值往往影响化合物的溶液形态,进而影响树脂的吸附率。在试验中,在选取的pH值范围内,吸附率的变动范围为30.26%~84.26%,其波动之大,表明原花青素的吸附受提取液pH值影响较大;在原花青素提取液pH值为5.5时,吸附率最高达到84.26%。分析其可能原因为在pH 5.5的弱酸性条件下,原花青素溶解度低,并以分子的形式存在,满足形成氢键的条件而易被大孔树脂吸附。
2.1.3 上样流速对原花青素浓度和吸附率的影响
上样流速对原花青素浓度和吸附率的影响见图4。

图4 上样流速对原花青素浓度和吸附率的影响Fig.4 Effect of loading flow rate on procyanidins concentration and adsorption rate
由图4可知,随着上样流速的增加,原花青素浓度出现先上升然后下降的波动趋势,树脂对原花青素的吸附率随流速增加而呈现总体下降的趋势,仅在流速大于3.0 mL/min后略有回升。上样流速1.0 mL/min时,吸附率最高。因此选择最佳的上样流速为1.0 mL/min。
2.1.4 乙醇浓度对原花青素浓度和洗脱率的影响
乙醇浓度对原花青素浓度和洗脱率的影响见图5。

图5 乙醇浓度对原花青素浓度和洗脱率的影响Fig.5 Effects of ethanol concentration on concentration and elution rate of procyanidins
由图5可知,乙醇浓度在20%~40%时,原花青素浓度呈现上升趋势,而乙醇浓度在40%~60%时,原花青素的浓度呈现下降趋势。洗脱率的趋势与原花青素浓度的变化趋势一致。综合分析,乙醇浓度为40%时,原花青素浓度最大,洗脱率最高为81.41%。因此选择乙醇浓度为40%。
2.1.5 洗脱液pH值对原花青素浓度和洗脱率的影响
洗脱液pH值对原花青素浓度和洗脱率的影响见图6。

图6 洗脱液pH值对原花青素浓度和洗脱率的影响Fig.6 Influence of pH value of eluent on concentration and elution rate of procyanidins
由图6可知,在洗脱液pH值为5.0~7.0时,原花青素浓度呈现快速上升的趋势;pH值为7.0~9.0时,原花青素的浓度呈现缓慢的下降趋势。即pH 7.0时,原花青素的浓度达到最高,结合洗脱率的结果,选择洗脱液pH值为7.0。
2.2 正交试验与验证
单因素试验中选择了吸附时间、提取液pH值、上样流速、乙醇浓度、洗脱液pH值5个因素,综合试验结果,确定选择A上样流速、B乙醇浓度、C提取液pH值、D洗脱液pH值进行正交试验,正交试验设计及结果见表2。
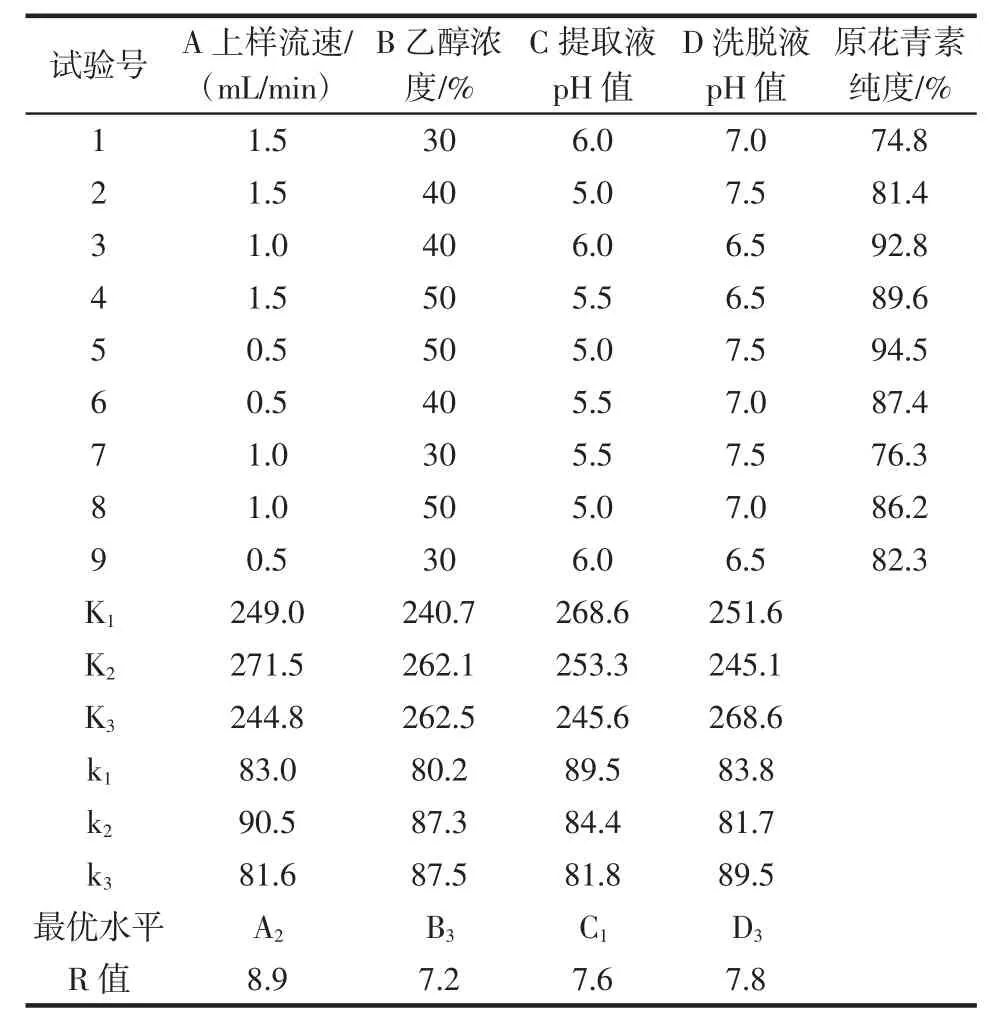
表2 正交试验设计及结果Table 2 Orthogonal experimental design and results
各因素对原花青素纯度的影响主次顺序为A>D>C>B,其最佳纯化工艺为A2B3C1D3,即上样流速1.0mL/min,乙醇浓度50%,提取液pH5.0,洗脱液pH7.5,在此条件下进行3次平行测试验证,原花青素平均纯度94.17%,因为模型预测的方案和正交列表的中最优组94.5%非常接近,但上样流速较小,可导致最终原花青素浓度下降,综合考虑原花青素的提取浓度与纯度,所以选择上样流速1.0 mL/min。
2.3 抗氧化活性分析
2.3.1 两种葡萄籽中生物活性物质分析
两种葡萄籽中生物活性物质分析结果见表3。

表3 两种葡萄籽中生物活性物质分析Table 3 Analysis of bioactive substances in two grape seeds
赤霞珠葡萄籽中多酚含量22.72%显著高于巨峰(P<0.05),但其中原花青素含量差异不显著。经过纯化后,巨峰的纯度略高于赤霞珠,但两者差异未达到显著水平。
2.3.2 不同样品抗氧化活性分析
以VC作为对照,两种葡萄籽原花青素纯化物的抗氧化活性分析结果见图7。

图7 样品浓度与DPPH自由基清除率、还原性、超氧阴离子自由基清除率的关系Fig.7 Relationship between DPPH radical,superoxide anion scavenging and reducibility of sample concentration
由图7可知,在样品浓度为2 mg/L~12 mg/L内,DPPH自由基清除率随样品浓度升高逐渐增强。在样品浓度在20 mg/L~150 mg/L内,样品浓度与样品还原性呈现出良好的线性关系,随着浓度增高还原性增强,两种葡萄籽产物的还原性高于VC对照。样品浓度在10 mg/L~50 mg/L,3种样品对超氧阴离子自由基的清除率也随浓度增加而上升,在50 mg/L~60 mg/L时趋于平缓。本试验中两种葡萄籽原花青素均具有较强的抗氧化活性。
3种样品自由基半数清除浓度(IC50)与半数还原性效应浓度(EC50)见表 4。

表4 样品对自由基半数清除浓度(IC50)与半数还原性效应浓度(EC50)Table 4 Sample 50% scavenging concentration of free radical(IC50)and 50% reducing effect concentration(EC50)
由表4可知,DPPH自由基清除能力依次为赤霞珠>巨峰>VC,VC的半数还原性效应浓度最高。还原性大小顺序为赤霞珠>巨峰>VC。超氧阴离子自由基清除能力的大小关系为VC>赤霞珠>巨峰。
相较于VC的结构,原花青素具有较多的酚羟基,因此能更好地阻止自由基链式反应,达到清除自由基目的[21],本试验中两种葡萄籽原花青素的DPPH自由基的清除能力优于VC,这与毛雪等[22]对原花青素抗氧化活性的研究结果一致。影响还原作用的因素有相对分子质量和空间阻位[23],赤霞珠的还原性高于巨峰,可推测巨峰与赤霞珠所分离的原花青素分子量存在差异,赤霞珠相较巨峰分子空间相对阻位小,表现更高还原性。两种原花青素纯化样品的半数效应浓度均低于VC的84.734 mg/L,表现较强的生物活性。综合来看,两种葡萄籽原花青素具有较强的清除自由基能力,因此具有开发应用的潜力。
3 结论
通过对影响大孔树脂HPD-400吸附、洗脱的因素进行正交优化与验证,优化巨峰葡萄籽原花青素纯化工艺,并以赤霞珠葡萄籽作为参照,对其原花青素纯化与抗氧化活性分析。结果表明,最优工艺为提取液pH 5.0,上样流速1.0 mL/min,乙醇浓度50%,洗脱液pH 7.5,获得原花青素纯度为94.17%。纯化后的原花青素具有较强的清除自由基的能力,表现出良好的抗氧化性,具有开发应用的潜力。
