原发性血小板增多症及真性红细胞增多症患者炎性指标与血栓事件的相关性研究
2022-01-23高冠论魏婷许娜周璇张星李庆山
高冠论,魏婷,许娜,周璇,张星,李庆山△
原发性血小板增多症(essential thrombocytopemia,ET)和真性红细胞增多症(polycythemia vera,PV)是费城染色体阴性的骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN),血栓栓塞是导致MPN患者预后不良的重要事件及治疗的重点和难点,且血栓事件发生率随病程延长而增高,严重影响患者的生活质量及预后[1-2]。炎性生物标志物超敏C反应蛋白(hs-CRP)及正五聚蛋白3(PTX3)在动脉粥样硬化形成、缺血性脑卒中和急性心肌梗死血栓形成中发挥重要作用,是影响血栓形成的重要因素[3-4]。中性粒细胞与淋巴细胞比值(NLR)是近年来研究较多的炎症-免疫指标,可反映MPN慢性炎症状态,与肿瘤进展和血栓形成关系密切[5]。上述3个指标检测方案简单易行,便于在临床工作中推广。有研究报道JAK2基因突变等多种因素均可影响MPN患者血栓形成[6],但目前hs-CRP、PTX3及NLR与MPN患者血栓形成相关研究报道较少。本研究对ET及PV患者的临床资料进行回顾性分析,探讨NLR、hs-CRP、PTX3与ET、PV患者血栓形成的相关性,为ET、PV患者血栓形成的评估及治疗提供依据。
1 对象与方法
1.1研究对象 选取2017年1月1日—2020年12月31日广州市红十字会医院及南方医科大学南方医院血液科收治的PV及ET患者。纳入标准:(1)符合2016年修订版世界卫生组织髓系肿瘤和急性白血病分类中ET和PV诊断标准[7]。(2)年龄≥18岁。排除标准:(1)合并免疫系统疾病、感染性疾病和其他恶性肿瘤等疾病。(2)服用影响免疫功能的药物。(3)其他可影响血常规结果的情况。最终纳入97例患者,其中ET患者(ET组)54例,PV患者(PV组)43例,男48例,女49例,年龄27~94岁,平均(66.63±13.10)岁。根据患者是否发生血栓事件分为血栓组(52例)和非血栓组(45例)。本研究已通过医院伦理委员会审批。
1.2资料收集 收集患者确诊当次住院的一般资料及实验室检查,包括性别、个人史、既往史、年龄及血常规,其中血常规包括白细胞计数(WBC)、血红蛋白(HGB)、红细胞计数(RBC)、血小板计数(PLT)、中性粒细胞计数及淋巴细胞计数等,NLR=中性粒细胞计数∕淋巴细胞计数;hs-CRP、PTX3、乳酸脱氢酶(LDH)、脾超声、骨髓活检检测突变基因JAK2结果。
1.3相关定义 血栓事件定义为动脉或者静脉血栓形成,包括大血管血栓和微血管血栓形成[2]。随访血栓事件定义为既往有或无血栓病史,随访过程中新发血栓形成,或者在既往血栓基础上同部位血栓进展加重,或者不同部位形成新的血栓。总血栓事件定义为患者诊断前已有血栓病史及随访中发生血栓事件的总和。发病时心血管危险因素定义为患者有吸烟史、糖尿病、高血压及高脂血症其中一项或多项[1]。患者明确诊断为ET或PV即开始随访至2020年12月31日或患者死亡。
1.4统计学方法 应用SPSS 25.0软件进行数据分析,计数资料用例(%)表示,组间比较采用χ2检验;符合正态分布的计量资料采用±s表示,组间比较采用独立样本t检验,非正态分布的计量资料用中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。绘制受试者工作特征(ROC)曲线,分析最佳截断值和曲线下面积(AUC)以评估预测效能。多因素Logistic回归分析患者血栓形成的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般特征 52例(53.61%)发生血栓事件的患者中,ET组、PV组分别为28例(51.85%)和24例(55.81%)。脑血管血栓24例,心血管血栓11例,其他部位血栓6例,多器官血栓形成11例。97例患者中发生出血并发症10例(10.31%):消化道出血6例,脑出血3例,眼球结膜下出血1例。17例(17.50%)发生随访血栓事件,ET组、PV组分别有11例(20.37%)和6例(13.95%)。
2.2 NLR、hs-CRP、PTX3的最佳截断值 ROC曲线显示,NLR的最佳截断值为3.14,敏感度84.6%,特异度46.7%,AUC为0.676(95%CI:0.566~0.786);hs-CRP的最佳截断值为1.75 mg∕L,敏感度76.9%,特异度37.8%,AUC为0.726(95%CI:0.624~0.828);PTX3的最佳截断值为0.915μg∕L,敏感度78.8%,特异度35.6%,AUC为0.740(95%CI:0.639~0.841),见图1。
2.3 血栓事件与炎症指标相关分析 根据NLR最佳截断值将患者分为低NLR组(NLR<3.14,n=32)及高NLR组(NLR≥3.14,n=65),高NLR组血栓事件发生率明显高于低NLR组[44(67.69%)vs.8(25.00%),χ2=15.715,P<0.01]。根据hs-CRP最佳截断值将患者分为低hs-CRP组(hs-CRP<1.75 mg∕L,n=40)及高hs-CRP组(hs-CRP≥1.75 mg∕L,n=57),高hs-CRP组血栓事件发生率明显高于低hs-CRP组[40(70.18%)vs.12(30.00%),χ2=15.255,P<0.01]。根据PTX3佳截断值将患者分为低PTX3组(PTX3<0.915μg∕L,n=40)及高PTX3组(PTX3≥0.915μg∕L,n=57),高PTX3组血栓事件发生率明显高于低PTX3组[41(71.93%)vs.11(27.50%),χ2=18.657,P<0.01]。
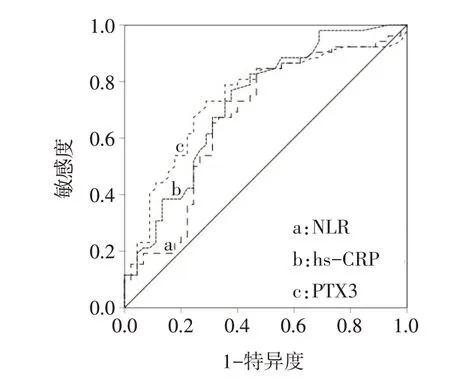
Fig.1 The ROC curve of NLR,hs-CRP and PTX3图1 NLR、hs-CRP和PTX3的ROC曲线
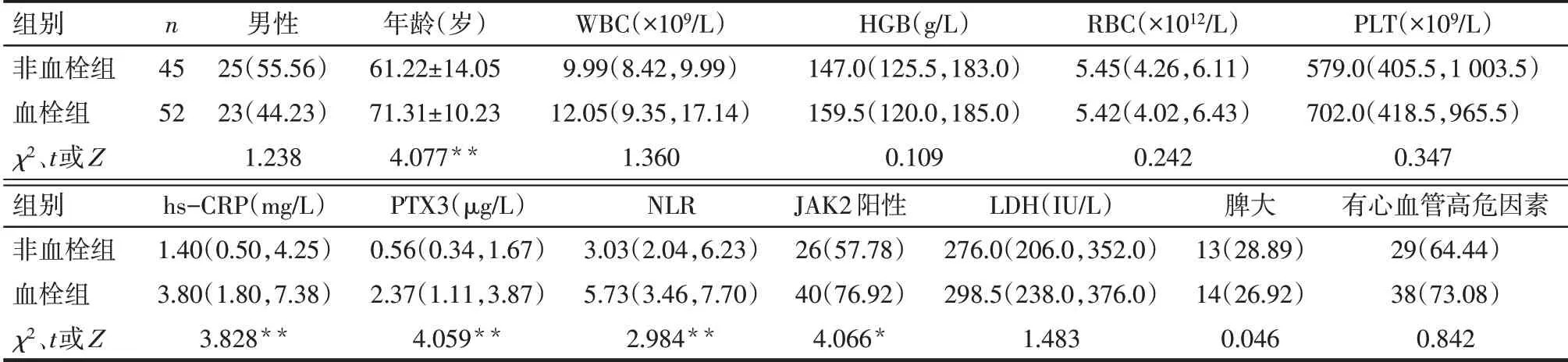
Tab.1 Comparison of clinical baseline date between the two groups of patients表1 全部患者血栓组与非血栓组临床基线资料比较
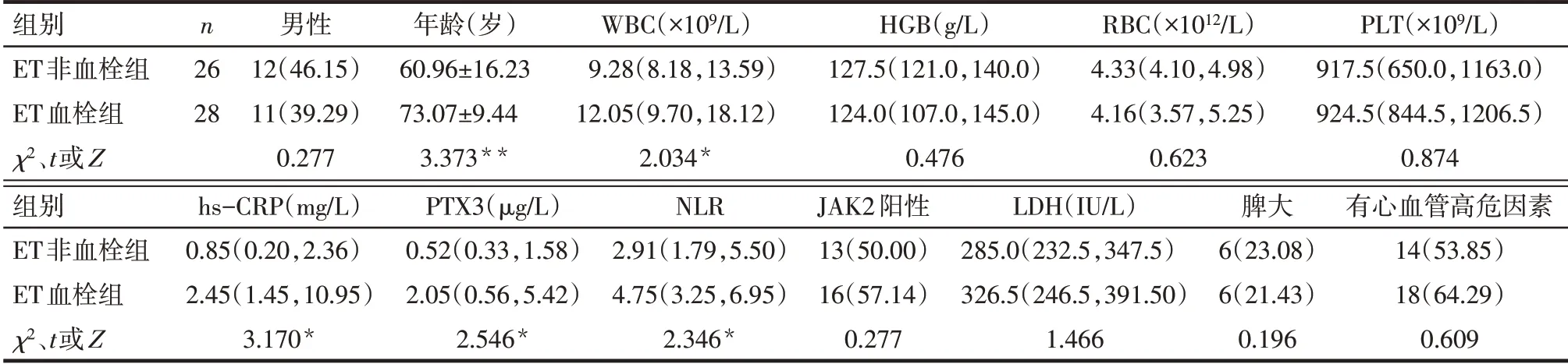
Tab.2 Comparison of clinical baseline date between the two groups of ET patients表2 ET患者血栓组与非血栓组临床基线资料比较
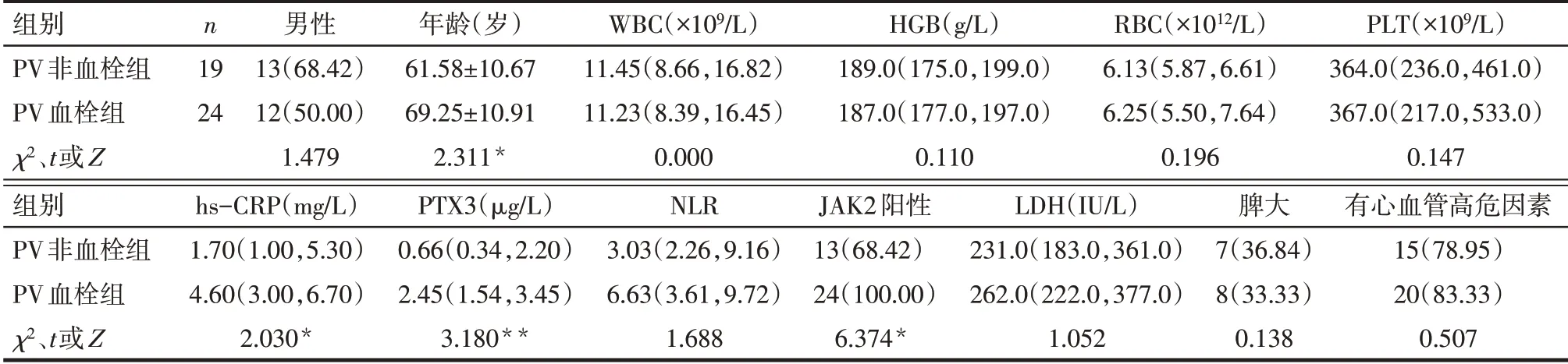
Tab.3 Comparison of clinical baseline date between the two groups of PV patients表3 PV患者血栓组与非血栓组临床基线资料比较
2.4 血栓组与非血栓组临床基线资料比较 血栓组年龄、hs-CRP、PTX3、NLR和JAK2基因阳性率明显高于非血栓组(P<0.05),见表1。ET血栓组年龄、WBC、hs-CRP、PTX3、NLR明显高于ET非血栓组(P<0.05),见表2。PV血栓组年龄、hs-CRP、PTX3、JAK2基因阳性率明显高于PV非血栓组(P<0.05),见表3。
2.5 血栓事件危险因素分析 所有患者以是否发生血栓事件为因变量(未发生=0,发生=1),以年龄、NLR、hs-CRP、PTX3和JAK2基因(阴性=0,阳性=1)为自变量,行多因素Logistic回归分析。结果显示,高龄和高PTX3水平是患者发生血栓事件的独立危险因素(P<0.05),见表4。分别在ET和PV患者中以是否发生血栓事件为因变量,年龄、PTX3为自变量,多因素Logistic回归分析显示,高龄是ET或PV患者发生血栓事件的独立危险因素(P<0.05),见表5。

Tab.4 Multivariate Logistic regression analysis of risk factors for thrombus events occurred in all patients表4 总患者发生血栓事件危险因素多因素Logistic回归分析
3 讨论
ET和PV是MPN常见的疾病类型,血栓是患者预后不良的重要事件,是患者死亡的主要原因[1]。MPN患者血栓形成的发生率为20%~40%[2,8]。本研究中的血栓事件发生率略高于相关报道,随访血栓事件发生率较其他报道低,但高于普通人群[9-10],可能与随访时间较短及患者规律服药有关。既往研究报道,血栓事件发生的危险因素有年龄>60岁、JAK2突变、既往有血栓病史、血小板计数>1 000×109∕L、高脂血症、高血压、糖尿病和吸烟等,这些特异性因素和炎性因子共同作用影响血栓的形成[2]。JAK2基因突变在PV和ET中极为常见。研究发现,JAK2基因突变可通过炎性因子作用增加血液黏度及细胞黏附功能,并在炎症微环境中通过转录因子NF-E2的过度表达促进骨髓增殖,从而影响血栓形成[11-12]。本研究全部患者中血栓组JAK2阳性率高于非血栓组,提示JAK2基因突变可能影响血栓的形成。目前已证实炎性因子hs-CRP、PTX3在心血管血栓形成中发挥重要作用[13]。Gangaraju等[14]研究证实PV和ET中血栓炎症微环境及炎性因子均在血栓形成中发挥重要作用,与疾病进展和预后相关[15-16]。但是,关于MPN患者中的hs-CRP、PTX3及NLR与其血栓形成相关性的临床报道较少,本研究综合分析了3种炎性因子与ET及PV患者血栓形成的关系。
hs-CRP和PTX3反映炎症过程的不同方面,hs-CRP是一种急性期反应蛋白,也是心血管疾病的独立危险因素,在动脉粥样硬化炎症反应中起重要作用[13]。研究表明hs-CRP水平越高,动脉内膜粥样斑块发生率越高,动脉粥样硬化越严重,血栓事件形成风险明显增加[3,17]。Lussana等[18]研究发现在ET及PV患者中,与低hs-CRP水平组相比,高hs-CRP水平组患者血栓发生和死亡的风险分别增加了约3倍和4倍。Barbui等[19]研究发现在ET及PV患者中高水平的hs-CRP(>3 mg∕L)与血栓形成明显相关。另外一项针对ET及PV骨髓纤维化患者的研究显示hs-CRP水平升高与疾病进展密切相关[15]。本研究结果提示hs-CRP高水平组血栓事件发生率明显高于低水平组,提示hs-CRP可能成为ET及PV患者血栓形成的生物标志物。
PTX3是炎症反应、血管生成和重塑的调节分子,也是机体免疫调节系统中的重要成员,在急性缺血性卒中、急性心肌梗死和多发性硬化中参与动脉粥样硬化的病理过程[13,20-21]。Casula等[4]发现PTX3在急性心肌梗死及动脉粥样硬化进展期表达水平增高。另有研究表明高水平PTX3对急性轻度缺血性卒中有预测价值[4,22]。本研究中不论在全部患者还是分别在ET及PV患者中,血栓组PTX3水平均明显高于非血栓组。对全部患者发生血栓事件多因素分析显示高PTX3水平是患者发生血栓事件的独立危险因素,进一步表明PTX3对ET及PV患者血栓形成有预测作用。分别对ET和PV患者行多因素Logistic回归分析显示,仅高龄为患者发生血栓事件的危险因素,考虑与样本量较小有关。但Lussana等[18-19]研究发现,高PTX3水平的ET及PV患者血栓形成的发生率往往较低。Casula等[4]研究总结发现PTX3水平与血栓形成是个复杂的病理生理过程,部分作用机制涉及高PTX3浓度可通过限制p-选择素依赖性的炎症反应,并减弱炎症位点的中性粒细胞招募,影响血栓形成。目前PTX3的生物学特性以及与血栓形成的关系仍有待进一步探讨,本研究中检测的PTX3水平也仅为外周血浓度,需扩大样本量针对血栓类型及血栓形成过程进一步亚组分析PTX3水平与血栓事件的关系。本研究中高龄是ET和(或)PV患者发生血栓事件的独立危险因素,与既往研究一致[1],高龄患者体内血流减慢、黏度增加、血管硬化,并可能伴有氧化应激反应及炎症因子分泌增多,促进血栓形成[11]。
NLR是一个系统性炎症指标,其增高表明机体炎性反应的增加,而淋巴细胞介导的免疫保护作用减低,导致炎症-免疫失衡[5]。Akyel等[23]研究发现,NLR水平与冠状动脉粥样硬化及血栓形成密切相关,NLR水平增高提示冠状动脉血流动力学紊乱,冠脉狭窄加重,心肌梗死进展加快。Zhou等[24]研究发现,NLR水平越高,ET患者形成新发血栓或者原有血栓进一步发展可能性越大;血栓事件无进展生存期越短,患者预后越差。本研究显示,高NLR组血栓事件发生率明显高于低NLR组,且血栓组NLR明显高于非血栓组,表明NLR水平对于ET及PV患者血栓形成的评估有指导性作用。
综上所述,本研究发现高水平的hs-CRP、PTX3及NLR的ET和PV患者血栓事件的发生率较高,高PTX3水平是ET和PV患者发生血栓事件的独立危险因素,可以作为评估患者血栓形成的重要指标。由于本研究样本量偏小,随访时间有限,存在一定的局限性,hs-CRP、PTX3及NLR对ET及PV患者血栓形成的预测价值需扩大样本量进一步研究证实。
