泡核桃叶水浸提液对草珊瑚种子萌发和幼苗生长的化感效应
2022-01-21蒲旭斌李在留谢伟东
蒲旭斌,郭 松,2,李在留,谢伟东
(1.广西大学 林学院,广西南宁 530004;2.广西艺术学院 建筑艺术学院,广西南宁 530007)
化感作用是植物在生长过程中向周围释放化学物质,促进或抑制环境中其他植物生长的一种自然现象[1]。这种现象广泛存在自然界中,大多数时候表现为抑制周围植物生长[2-3]。研究发现,化感作用通过干扰受体植物的光合作用[4-5]、呼吸作用[6-7]、生物膜渗透性、抗氧化保护酶活性、矿物质吸收、植物内源激素含量[8]和细胞分裂[9-11]等途径发挥作用,阻碍受体植物的正常发育。20世纪90年代开始,在农业上陆续出现水稻(Oryza sativa)、小麦(Triticum aestivum)等粮食作物的化感作用研究报道[12],林业方面主要集中于杉木(Cunninghamia lanceolata)、桉树(Eucalyptus)和杨树(Populus stremu-loides)等用材树种的研究[13-15]。随着生态农业的发展,化感作用被越来越多的学者重视,已成为化学生态学研究的热点之一。
泡核桃(Juglans sigillata)是胡桃科(Juglandace⁃ae)胡桃属乔木,在我国主要分布于云南、贵州、四川、湖南、广西和西藏等地[16-17]。泡核桃是我国山区重要的经济林树种,其果实营养价值高,是世界上著名的干果之一,木材坚实可作为硬木材料使用,具有保持水土、防风固沙等生态功能。广西地处华南核桃(J.regia)分布区,有很多适宜土地可规划种植,核桃产业具有很大的发展潜力。单一泡核桃林的生态功能不完整,易受病虫危害、空产期长等不安定因素导致农民种植积极性不高,未能在广西大面积发展[18]。林药套种有利于改善林分的生态条件,提高效益产出,最大化利用土地资源,是降低泡核桃种植风险的有效手段。胡桃属植物具有较强的化感作用[19],不同植物在面对化感作用时会产生不同的反应。张琴等[20]通过棉花(Fdarium oxypo⁃rum)种子发芽试验发现,低浓度的核桃叶水浸提液可以增加幼苗根系的活力指数,促进胚根生长、增加胚根干重,高浓度会对根部生长产生抑制;彭晓邦等[21]发现用20 mg∕mL 核桃叶水浸提液处理黄芩(Scutellaria baicalensis)种子,种子质膜不会受到破坏,还可以促进种子萌发、增加可溶性蛋白含量;薛金辉等[22]的研究结果表明,黑豆(Glycine max)幼苗的最大根长随核桃叶水浸液的浓度增加而变长。选择合适的套种植物十分重要,是泡核桃林能稳定发展的关键。
草珊瑚(Sarcandra glaba)又名肿节风、接骨莲等,为金粟兰科(Chloranthaceae)草珊瑚属多年生常绿草本或亚灌木,具有很高的药用价值[23]。草珊瑚属于广西山区常见灌木,已在桉树林和杉木林下套种[24-25]。目前尚无关于泡核桃林下套种草珊瑚的案例及两者间化感作用的研究报道。本研究测定泡核桃叶水浸提液对草珊瑚种子萌发及幼苗生长的影响,探索不同浓度泡核桃叶水浸提液对草珊瑚的化感作用,分析泡核桃和草珊瑚搭配的可行性,为广西山区泡核桃林的发展提供理论依据。
1 材料与方法
1.1 试验材料
泡核桃叶采集于广西壮族自治区乐业县(106°56'E,24°78'N)。将泡核桃叶先用自来水洗净,再用蒸馏水润洗一遍,自然晾干后放入超低温冰箱中备用。
草珊瑚种子于2020年11月购于广西壮族自治区融安县,带果皮一起放入4 ℃冰箱中冷藏。试验前选取籽粒饱满、质地均匀的果实,自来水浸泡5~6 h后搓洗,去除外面的果肉,分离出种子,于通风阴凉处晾干。
1.2 试验方法
1.2.1 泡核桃叶水浸提液制备
将泡核桃叶剪成1 cm2的小片,置于烧杯中,按10 g 泡核桃叶配100 mL 蒸馏水的比例,在室温下浸泡48 h,期间每12 h手动搅拌1次。浸泡后用3层纱布过滤两次,再用滤纸过滤,得到浓度为100 mg∕mL泡核桃叶水浸提液母液。使用时,将母液用蒸馏水稀释至5、25、50、75 和100 mg∕mL,用蒸馏水作对照(CK)。
1.2.2 发芽试验
2021年3月,晾干种子用高锰酸钾溶液浸泡30 min消毒,用蒸馏水冲洗5次后备用。在培养皿中放入两层滤纸,用牛皮纸封住,高压湿热灭菌(121 ℃、30 min),然后放入烘箱干燥。随机选取50 粒种子整齐放入培养皿中,每个浓度重复3次,每天加入等量泡核桃叶水浸提液或蒸馏水保持滤纸湿润。培养皿置于人工培养箱中培养,培养箱温度设置为25 ℃、光照时间12 h、光照强度2 000 lx。
2021年3月13日— 4月10日,统计每日发芽数,计算种子发芽率、发芽势和发芽指数[26]。

种子发芽后,继续在培养皿中培育30天,获取幼苗。每天加入等量泡核桃叶水或蒸馏水。试验结束后选取长势较一致的幼苗测定苗高及根长,采用氮蓝四唑法测定植株超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用钼酸铵法测定过氧化氢酶(CAT)活性,采用蒽酮比色法测定可溶性糖含量,采用考马斯亮蓝法测定可溶性蛋白含量,采用酸性茚三酮法测定脯氨酸含量,采用硫代巴比妥酸法测定丙二醛(MDA)含量[27-28]。
1.3 数据处理
采用Excel 2019 软件整理数据,采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA)、LSD多重比较法分析和主成分分析,表中数据均为平均值±标准误。采用Excel 2019软件绘图。
主成分综合得分计算公式[29]如下:

式中,Ui为主成分载荷矩阵值;Ai为因子载荷矩阵对应值;λi为对应主成分的特征根值;ZXi为变量经标准化处理后的值;Y为主成分综合得分值;Yi为主成分分析模型。
2 结果与分析
2.1 泡核桃叶水浸提液对草珊瑚种子萌发及幼苗生长的影响
泡核桃叶水浸提液对种子发芽率、发芽势、发芽指数及幼苗苗高和根长影响显著(P<0.05)(表1)。浓度为5~75 mg∕mL 时,各处理间的发芽率、发芽势和发芽指数均与CK 差异不显著;当浓度为100 mg∕mL 时,发芽率、发芽势和发芽指数均显著低于CK(P<0.05),分别为CK 的85.60%、69.44%和79.94%。浓度为25 ~ 100 mg∕mL 时,各处理的苗高均与CK 相比差异不显著;浓度为5 mg∕mL 时,苗高显著高于CK(P<0.05),比CK 高出17.58%。除浓度25 mg∕mL 外,其他处理的根长均与CK 差异显著(P<0.05);浓度为5 mg∕mL 时,根长最长(4.77 cm);其次为浓度25 mg∕mL(4.33 cm);浓度为100 mg∕mL时,根长最短(2.57 cm),比CK短60.76%。

表1 泡核桃叶水浸提液对草珊瑚种子萌发的影响Tab.1 Effects of aqueous extract from J.sigillata leaves on germination of S.glabra seeds
2.2 泡核桃叶水浸提液对草珊瑚幼苗抗氧化保护酶活性的影响
泡核桃叶水浸提液对抗氧化保护酶活性均有显著影响(P<0.05)(图1)。SOD活性随浓度升高表现为先升高后下降;浓度为5 mg∕mL 时,SOD 活性显著高于CK(P<0.05);浓度为25~50 mg∕mL时,SOD活性与CK差异不显著;浓度为75~100 mg∕mL时,SOD活性显著低于CK(P<0.05)。POD 活性随浓度升高表现为先升高后下降;浓度为25~50 mg∕mL时,POD活性显著高于CK(P<0.05);浓度为100 mg∕mL 时,POD 活性显著低于CK(P<0.05)。CAT 活性随浓度升高而下降;与CK 相比,浓度为5、25、50、75 和100 mg∕mL 时,CAT 活性分别下降12.97%、27.46%、29.56%、43.48%和46.45%;浓度为50 ~ 100 mg∕mL时,CAT活性显著低于CK(P<0.05)。

图1 泡核桃叶水浸提液对草珊瑚幼苗抗氧化保护酶活性的影响Fig.1 Effects of aqueous extract from J.sigillata leaves on antioxidant enzyme activities of S.glabra seedling
2.3 泡核桃叶水浸提液对草珊瑚幼苗脯氨酸、MDA、可溶性蛋白和可溶性糖含量的影响
泡核桃叶水浸提液对脯氨酸、MDA、可溶性蛋白和可溶性糖含量均有显著影响(P<0.05)(图2)。脯氨酸和MDA 含量随浓度升高而增加;浓度为5~100 mg∕mL 时,脯氨酸和MDA 含量均显著高于CK(P<0.05);浓度为100 mg∕mL 时,脯氨酸与MDA 含量分别比CK 高出334.62%和127.68%。可溶性蛋白含量较稳定,各浓度与CK 均差异不显著;浓度为25 mg∕mL时,可溶性蛋白含量最大。可溶性糖含量随浓度升高表现为先增加后减少;浓度为5~75 mg∕mL时,可溶性糖含量显著高于CK(P<0.05);浓度为100 mg∕mL 时,可溶性糖含量急剧下降,比CK 低30.92%,差异显著(P<0.05)。

图2 泡核桃叶水浸提液对草珊瑚幼苗脯氨酸、丙二醛、可溶性蛋白和可溶性糖含量的影响Fig.2 Effects of aqueous extract from J.sigillata leaves on proline,contents of MDA,soluble protein and soluble sugar of S.glabra seedling
2.4 草珊瑚种子萌发、幼苗生长和生理指标主成分分析
主成分PC1、PC2 的特征值分别为6.56 和2.13,方差贡献率分别为54.66%和17.73%,两个主成分累积方差贡献率为72.39%(表2)。主成分PC1对应的特征向量中,根长、SOD 活性和发芽率的系数最大,分别为0.92、0.90 和0.86,代表萌发指标和抗氧化酶活性指标。主成分PC2 对应的特征向量中,POD 活性、可溶性糖和可溶性蛋白含量的系数最大,分别为0.73、0.71 和0.60,代表生理指标中的渗透调节物质。

表2 草珊瑚种子萌发、幼苗生长和生理指标主成分分析Tab.2 Principal component analysis on seed germination,seedling growth and physiological indexes of S.glabra
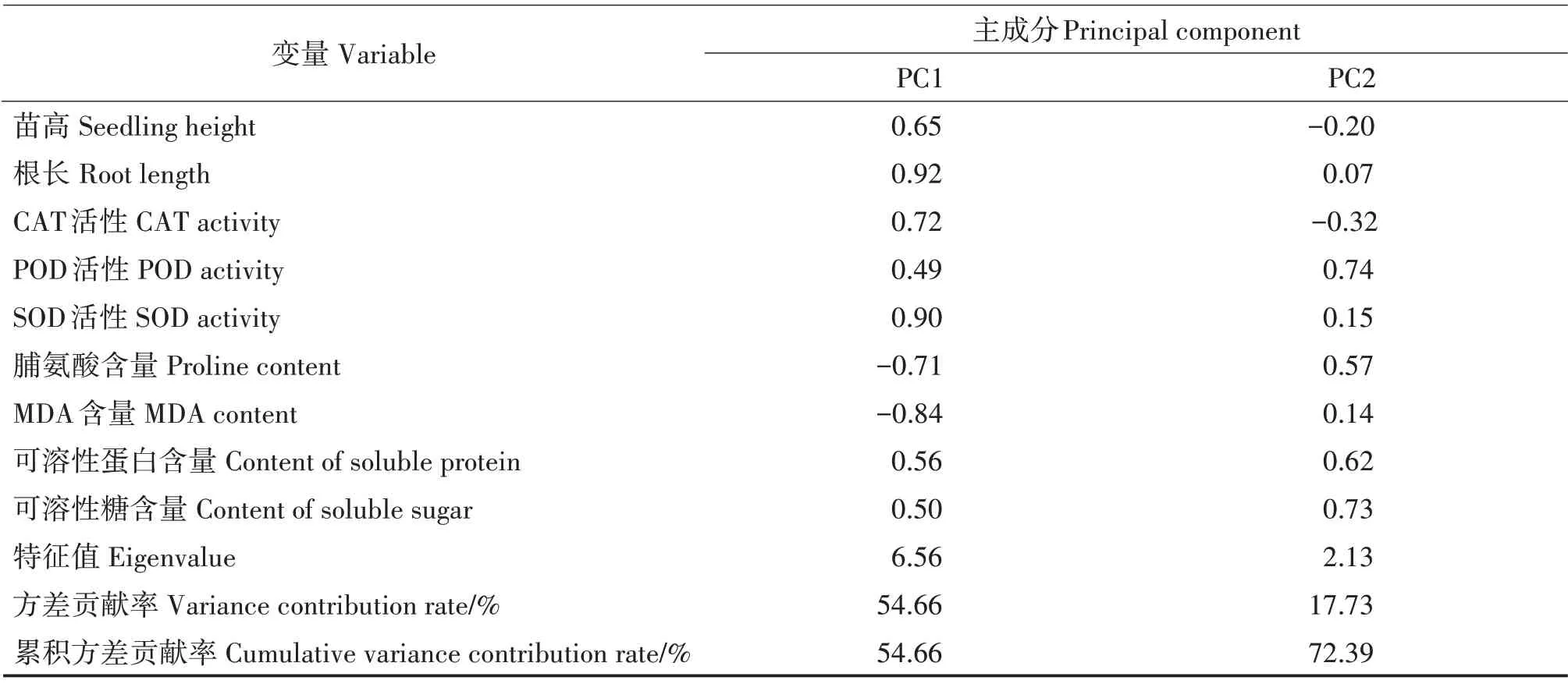
续表2 Continued
2.5 泡核桃叶水浸提液对草珊瑚种子萌发与幼苗生长的综合评价
综合得分越高表明该组的泡核桃叶水浸提液对草珊瑚种子萌发和幼苗生长的促进作用越强。泡核桃叶片水浸提液对草珊瑚种子萌发与幼苗生长影响的综合表现为5 mg∕mL >25 mg∕mL >CK >50 mg∕mL >75 mg∕mL >100 mg∕mL。当浓度为5 mg∕mL时,综合得分最高(1.69);浓度高于25 mg∕mL 时,综合得分低于CK;浓度为100 mg∕mL 时,综合得分最低(-3.74)。
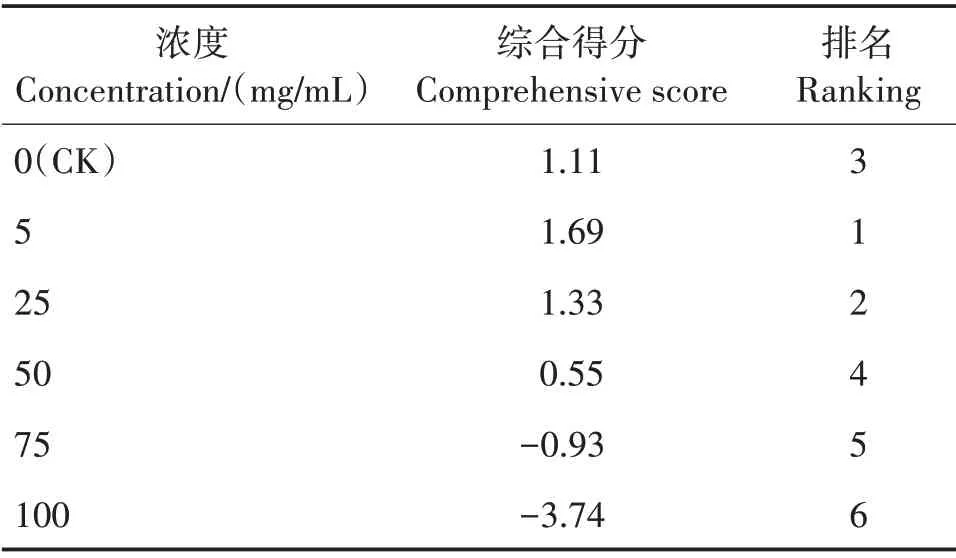
表3 不同浓度泡核桃叶片水浸提液作用的综合得分和排名Tab.3 Comprehensive score and ranking of different concentrations of aqueous extracts from of J.sigillata leaves
3 讨论与结论
植物种子萌发与植物种群更新和繁衍存活能力息息相关,其中发芽率表示发芽种子与参试种子的比例,是判断种子质量的重要指标之一。本试验中,泡核桃叶水浸提液浓度为5~75 mg∕mL 时,草珊瑚种子发芽率与CK 差异不显著,浓度为100 mg∕mL时抑制作用显著。发芽势衡量种子的发芽速度和整齐度,发芽指数衡量种子的活力,均为重要的种子质量测试指标。不同浓度泡核桃叶水浸提液均抑制种子的发芽势和发芽指数,表现为随浓度升高,种子的平均发芽天数越长,发芽整齐度越低,发芽活力越低。与其他植物相比,泡核桃叶水浸提液对草珊瑚种子的发芽率影响较小,水浸提液浓度为100 mg∕mL 时,发芽率只降低了15%;李茜等[30]和刘序等[31]的研究中,50 mg∕mL 浓度核桃叶水浸提液处理的丹参(Salvia miltiorrhiza)、萝卜(Raphanus sati⁃vus)种子的发芽率均降低50%左右。
当植物处于逆境胁迫或衰老时会产生膜脂过氧化,MDA 是膜脂过氧化的最终产物,通过对MDA含量的测定可以了解细胞膜的损伤程度。随着泡核桃叶水浸提液浓度升高,草珊瑚幼苗的MDA 含量逐渐升高,细胞膜的受损程度逐渐加深,浓度为100 mg∕mL 时,MDA含量比对照高出127.68%。CAT、POD和SOD为植物的抗氧化保护酶,当受到胁迫时,可以共同作用阻止活性氧(ROS)对植物细胞膜的伤害。泡核桃叶水浸提液对草珊瑚幼苗3种保护酶活性的影响程度各不相同,CAT 活性随浸提液浓度升高而下降,POD、SOD活性随浸提液浓度升高表现为先升高后下降。这种现象表明,草珊瑚幼苗受到低浓度水浸提液影响时,首先会激活细胞内的SOD、POD 清除多余的ROS,来抵御外界化感物质的影响;当泡核桃叶水浸提液浓度升高,细胞的抗氧化酶系统不能清除多余的ROS,最后导致细胞受到损伤,酶活性也逐渐降低,与张如义等[32]结论相似,说明高浓度的泡核桃叶水浸提液对草珊瑚代谢和生理功能有显著的抑制作用。
植物在逆境条件下时,会通过积累渗透调节物质应对外界造成的内外渗透压失衡,脯氨酸、可溶性糖和可溶性蛋白均为主要的渗透调节物质。随泡核桃叶水浸提液浓度升高,脯氨酸含量不断增加,与马世荣等[33]研究结果类似,表明草珊瑚所受的化感作用越来越强,需要生产更多脯氨酸来调节细胞间渗透压。可溶性糖与可溶性蛋白含量表现为中、低浓度增加,高浓度下降的趋势。这可能是低浓度的泡核桃叶水浸提液刺激后,使幼苗主动防御,调控可溶性糖和可溶性蛋白浓度,增加幼苗保水能力,以抵抗化感物质对幼苗生长发育的影响;当浓度升高,幼苗的自我调节能力不足以抵御化感物质的影响,100 mg∕mL 浓度下的幼苗渗透压失衡,可溶性蛋白和可溶性糖浓度降低,使草珊瑚幼苗的正常发育受阻。
核桃叶水浸提液对棉花、黄岑和萝卜等作物生长发育的影响虽各不相同,但浓度依旧是决定化感作用强度的关键因素[19-20,26]。主成分分析综合得分显示,随水浸提液浓度上升,草珊瑚种子和幼苗的综合得分不断下降。当泡核桃叶水浸提液浓度为5 mg∕mL时,综合得分最高,此浓度最有利于促进草珊瑚种子的萌发和幼苗生长;浓度为100 mg∕mL时,水浸提液对草珊瑚种子萌发和幼苗生长有显著的抑制作用。
泡核桃叶水浸提液对草珊瑚种子萌发和幼苗生长的影响为双重效应,当浓度低于75 mg∕mL 时,水浸提液对种子的发芽率、发芽势和发芽指数影响较小;当浓度为100 mg∕mL 时,发芽率、发芽势和发芽指数均显著低于对照组。当浓度低于25 mg∕mL时,水浸提液可提高可溶性物质含量,促进幼苗生长;当浓度为100 mg∕mL 时,水浸提液会破坏幼苗细胞的渗透压及抗氧化保护酶活性,引起细胞膜损伤,使幼苗生长受到抑制。因此,在实际生产过程中,可通过清理林下落叶、以较低密度种植泡核桃来减轻对草珊瑚种子萌发和幼苗生长的抑制作用。植物处于不同生长阶段对化感作用的敏感程度也不同,还需对不同生长期的草珊瑚进行研究才能更详细地了解泡核桃对草珊瑚化感作用的机制,更好地促进泡核桃林下经济发展。
