邯郸市妇女空气污染暴露对妊娠期高血压的影响
2022-01-21王丽君刁瑞萍于丽敬崔小丽毛洪钧
曹 蕾,王 婷,王丽君,刁瑞萍,于丽敬,崔小丽,毛洪钧*
邯郸市妇女空气污染暴露对妊娠期高血压的影响
曹 蕾1,2,王 婷1,2,王丽君1,2,刁瑞萍3,于丽敬3,崔小丽3,毛洪钧1,2*
(1.南开大学环境科学与工程学院,天津市城市交通污染防治研究中心重点实验室,天津 300071;2.国家环境保护城市空气颗粒物污染防治重点实验室,天津 300350;3.邯郸市妇幼保健院,河北 邯郸 056001)
选择河北省邯郸市某医院孕妇数据,探讨了6项空气污染物暴露对孕妇患妊娠期高血压(GH)的影响和不同人群的效应差异,采用传统Logistic回归模型评估了各项污染物的效应,采用主成分改进的Logistic回归模型评估了各项污染物在额外调整其它污染物后的效应.结果显示,单污染物模型中,妊娠期前26周每20μg/m3增量的O3暴露与患病风险呈显著正相关关系(OR=1.211,95%CI:1.094~1.340),且在妊娠前期的效应大于在妊娠中期的效应.多污染物模型中,孕前3个月每20μg/m3增量的PM2.5和PM10暴露显著增加了患病的风险,OR值分别为1.021(95%CI:1.004~1.038)和1.016(95%CI:1.002~1.031);妊娠期前26周每20μg/m3增量的O3暴露也对患病风险有显著效应(OR=1.026,95%CI:1.002~1.050).亚组分析结果显示,25~30岁或初次妊娠的孕妇孕前3个月对PM2.5、PM10、NO2和CO的暴露较为敏感,>35岁或学历为大学以下的孕妇妊娠期前26周受O3暴露的影响更易患病.总的来说,邯郸市空气污染对孕妇患GH存在显著的影响,孕妇应在孕前和妊娠期间做好防护,降低空气污染暴露造成的不利影响.
妊娠期高血压;空气污染;怀孕;队列研究
空气污染是造成全球疾病负担的一个重要环境风险因素,暴露于空气污染与多种疾病相关[1-3].作为人口中脆弱的一个亚群体,孕妇及其胎儿因空气污染而承受更大的疾病负担[4-7].妊娠期高血压(GH)是一种妊娠并发症,对母婴健康有着极大的危害[6].有研究表明,暴露于空气污染与全身炎症和氧化应激有关,这可能与妊娠期间血管重塑和全身功能改变发生相互作用[6].部分流行病学研究发现空气污染会增加孕妇患GH的风险[8-10],但也有一部分研究并没有发现二者之间显著的联系[7,11],关于空气污染暴露与GH的关系尚缺乏确凿的流行病学证据.以往关于孕妇空气污染暴露与GH关系的研究主要关注妊娠期间的单污染物暴露,往往忽略了孕前暴露的效应.最新的证据表明,孕前3个月可能也是一个关键的时间窗口,孕前暴露可能会增加母体的系统性氧化应激或炎症[12-13].
目前,国内开展的相关研究仅限于深圳、武汉、呼和浩特和兰州这些大城市或城市群[14-17],然而中小型城市的大气污染形势不容忽视[18],其居民健康也值得被关注.邯郸市是中国北方典型的煤炭重工业城市,除了特殊地形与区域大气环流的叠加影响外,以煤炭、钢铁为主的产业结构导致其空气质量污染严重,秋冬季重污染天气频发[19-21].为此,本研究选择邯郸市某医院孕妇数据,利用Logistic回归模型来分别评估包括可吸入颗粒物(PM10)、可入肺颗粒物(PM2.5)、二氧化硫(SO2)、二氧化氮(NO2)、一氧化碳(CO)和臭氧(O3)在内的各项空气污染物的孕前暴露和妊娠期暴露对孕妇患GH的影响.由于实际空气环境中多污染物共存,且污染物之间存在相互作用,本研究进一步将6种污染物同时纳入模型,利用主成分改进的Logistic回归评估了各项空气污染物在调整其余5项污染物后的效应,旨在探究共暴露环境下单个污染物的效应.此外,对孕妇进行亚组分析以探究空气污染对不同特征人群的效应差异,为有针对性地保障公众健康提供参考.
1 资料与方法
1.1 研究区域
本研究队列人群所在区域为河北省邯郸市.邯郸市位于河北省南部,西部为太行山区,东部为华北平原,属暖温带大陆性季风气候,四季分明,辖6区、11县和1个县级市,总面积1.2万km2,户籍总人口1057万,常住人口955万,人口出生率为11.80%[22].
1.2 研究对象
本研究为一项回顾性队列研究,研究对象为2018年2月~2020年7月在河北省邯郸市妇幼保健院住院分娩的妇女.邯郸市妇幼保健院每年接收邯郸市超过一半的孕妇分娩,病例数据覆盖全市范围,医院的记录详细介绍了产妇和胎儿的特征以及怀孕和分娩的临床数据.
1.3 疾病诊断标准
GH:收缩压/舒张压³140/90mmHg (间隔6h,至少2次),无蛋白尿,妊娠20周后首次出现,血压于产后12周恢复正常.如伴有其他表现,如头痛、视物不清、上腹不适或血小板减少等应高度怀疑子痫前期.
1.4 空气污染物暴露评估
从邯郸市生态环境局获取44个监测站点(包括国控站点和省控站点)2017~2020年的6项污染物浓度数据.孕妇和监测站点的分布情况如图1所示.由于监测站点数量足够多,且空间覆盖率较好,因此本研究采用目前公共卫生领域常用的近邻模型来评估个体暴露水平.近邻模型是根据空气污染源与研究对象之间距离的远近估算研究对象的暴露水平,直接将个体住宅最近监测站点的暴露水平赋值给个体[23].该方法不仅简单易行,且提供了较高的时间分辨率.根据每位孕妇的孕周和分娩日期计算了以下几个窗口的平均暴露情况:(1)孕前3个月(孕前13周,Pre_T);(2)妊娠早期(第1~13孕周,T1);(3)妊娠中期(第14~26孕周,T2);(4)妊娠期前26周(T).为了确保暴露在结果之前,没有考虑妊娠26周之后的暴露.
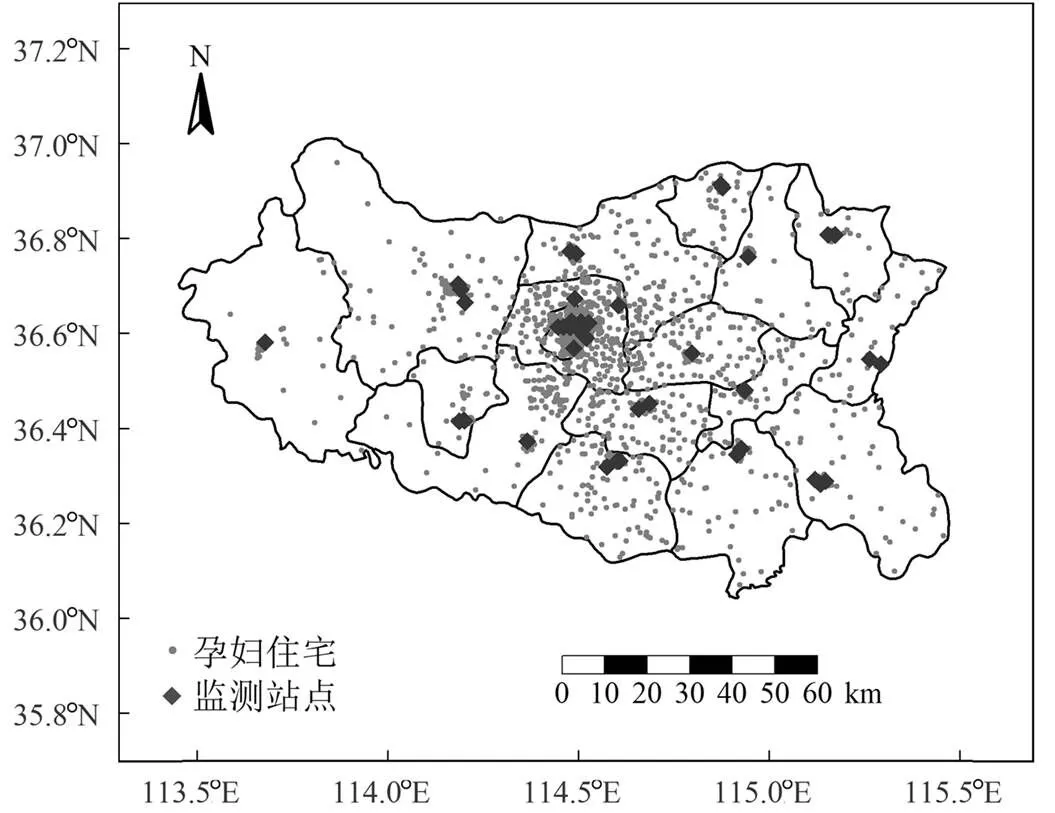
图1 孕妇的住宅和监测站点分布
1.5 统计学分析
由于所选受试人群的特征皆为分类变量,用2检验比较了患GH的孕妇和不患GH的孕妇在所选特征上的差异.另外,不同暴露窗口的污染物平均暴露浓度之间的相关性通过Spearman相关系数展示.
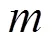

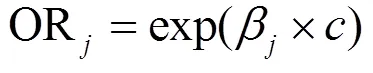

为了便于结果讨论及与其他文献数据作对比,将污染物浓度作为连续变量来表示研究结果,分别计算了各暴露窗口PM和O3每20μg/m3、SO2和NO2每10μg/m3、CO每0.5mg/m3的增量与患GH风险的OR和95%CI.研究结果分为调整和未调整混杂变量的效应,混杂变量包括年龄(<25,25~30,30~35,>35岁)、教育程度(大学以下、大学及以上)、医保类型(自费、职工医保、城乡医保)、孕次(初次、非初次)、怀孕年份(2017,2018,2019年)、怀孕季节(春、夏、秋、冬)和不良孕产史(有、无).未调整混杂变量的单污染物模型的自变量仅包含一种污染物,调整混杂变量的单污染物模型的自变量包括一种污染物和所有混杂变量.

研究结果分为调整和未调整混杂变量的效应,未调整混杂变量的多污染物模型的自变量包含6种污染物的主成分变量,调整混杂变量的多污染物模型的自变量包括6种污染物和所有混杂变量的主成分变量.
此外,根据孕妇的年龄、孕次、不良孕产史和教育程度划分人群,分别用单污染物模型和多污染物模型进行亚组分析,亚组分析调整了除分组因素外所有的混杂因素.以上所有的统计学分析采用R软件(版本3.5.3)完成,采用双侧检验,检验水准=0.05.
2 结果与分析
2.1 邯郸市空气污染情况
2017~2020年邯郸市空气污染物的年均浓度如表1所示.污染物的年均浓度是全年365d (2020年366d)日均浓度的平均值,污染物的日均浓度是当日所有监测站点数据的算术平均值,监测点收集数据完整性和一致性均符合国家环境空气质量监测规范要求,其中O3浓度为日最大8h均值,其他项均为24h均值.研究期间,邯郸市PM2.5和PM10的年均污染水平远高于《环境空气质量标准》(GB 3095-2012)的二级浓度限值[27],SO2的年均污染水平远低于二级标准.邯郸市2017年NO2的年均污染水平略高于二级标准,2019~2020年NO2的年均污染水平均低于二级标准.2017~2020年CO和O3的年均污染水平远未达到二级标准中的日24h均值或日最大8h均值标准.

表1 2017~2020年邯郸市空气污染物的年均浓度
2.2 孕妇信息描述性分析
2018年2月~2020年7月在河北省邯郸市妇幼保健院住院分娩的孕妇信息的统计学描述如表2所示.本研究在排除了多胎分娩、胎龄<20周、妊娠前患慢性高血压和信息缺失的孕妇后,最终将9820位孕妇纳入研究.其中患GH的孕妇占比7.89%;孕妇年龄主要集中在25~35岁之间,约占总人群的74.24%;超过一半的孕妇学历在大学及以上;约21.22%的孕妇无医保;一半多的孕妇有妊娠经历;约30.48%的孕妇有不良孕产史.

表2 孕妇信息的统计学描述

表3 不同暴露窗口的污染物平均浓度的相关性分析
2检验的结果显示,除怀孕年份和怀孕季节外,患病与未患病的孕妇在其余特征上有着显著的差异.与未患GH的孕妇相比,患GH的孕妇普遍年龄偏大(>30岁)、教育程度偏高(学历为大学及以上),而且,初次怀孕和有不良孕产史的孕妇患GH的几率较大.
2.3 孕妇空气污染暴露情况
表3为孕妇不同暴露窗口的污染物平均浓度的Spearman相关性分析.根据Spearman相关系数,各窗口污染物之间的相关性较强,因此无法将任意两种污染物直接同时纳入Logistic回归模型.
2.4 空气污染物与GH发病率之间的关系
2.4.1 单污染物模型 表4显示了单污染物Logistic回归模型中各污染物未调整和调整混杂变量的OR和95%CI.在未调整混杂变量的单因素回归模型中,Pre_T时期的CO暴露每增加0.5mg/m3,GH的患病风险就会增加8.4% (OR=1.084, 95% CI: 1.006~1.169).在调整了混杂变量的模型中,T时期每20μg/m3增量的O3暴露与GH风险呈显著正相关关系(OR=1.211, 95% CI: 1.094~1.340),且O3暴露在T1时期的效应要高于在T2时期的效应,OR值分别为1.128 (95% CI: 1.046~1.218)和1.093 (95% CI: 1.015~1.177).
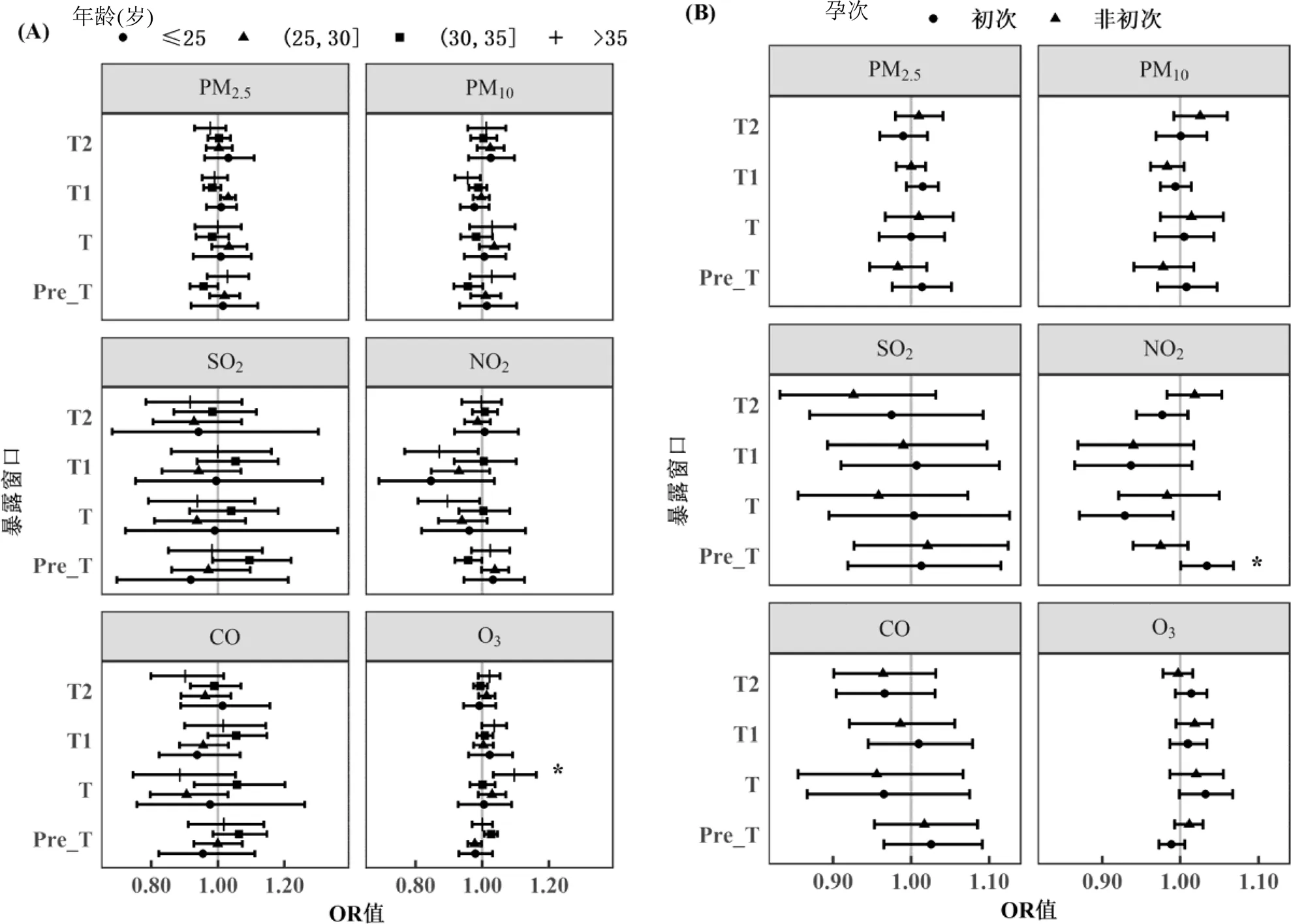
图2A展示了单污染物模型调整混杂变量后空气污染对不同年龄段孕妇的效应.对于25~30岁的孕妇,Pre_T时期的PM2.5、PM10、NO2和CO暴露显著增加了其患GH的风险,OR值分别为1.316 (95% CI: 1.094~1.583)、1.189 (95% CI: 1.060~1.334)、1.249 (95% CI: 1.056~1.479)和1.261 (95% CI: 1.056~1.506);T时期尤其T2时期的O3暴露也对其患GH有显著效应(OR=1.223, 95% CI: 1.074~1.393).对于>35岁的孕妇,T时期尤其T1时期的O3暴露每增加20μg/m3,其患GH的风险就会增加39% (OR=1.390, 95% CI: 1.158~1.670).
图2B展示了单污染物模型调整混杂变量后空气污染对不同孕次孕妇的效应.对于初次妊娠的孕妇, Pre_T时期的PM2.5、PM10和CO暴露显著增加了其患GH的风险,OR值分别为1.219 (95% CI: 1.051~1.414)、1.122 (95% CI: 1.022~1.231)和1.195 (95% CI: 1.033~1.382).T时期每20μg/m3增量的O3暴露对初次妊娠和非初次妊娠的孕妇患GH的风险都有显著效应,但初次妊娠孕妇的效应值更大(OR=1.241, 95% CI: 1.074~1.433).
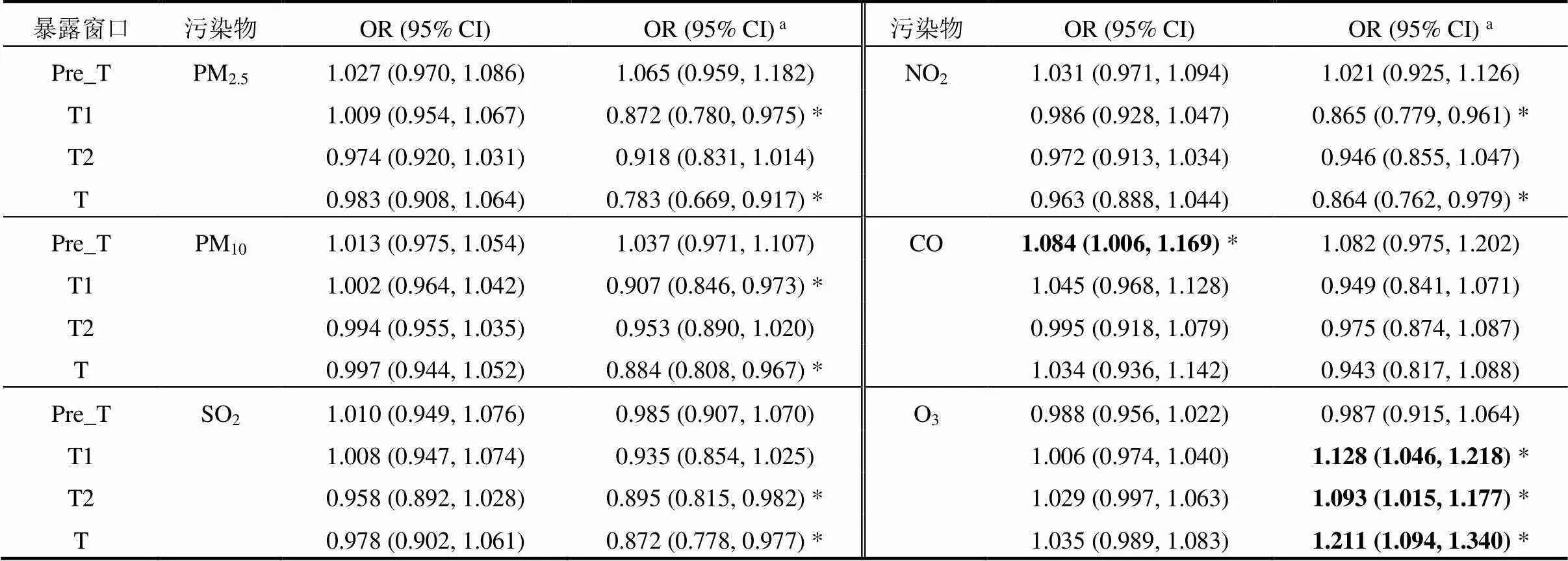
表4 单污染物模型中各污染物的效应
注:a表示模型还调整了年龄、教育程度、医保类型、孕次、怀孕年份、怀孕季节和不良孕产史,*表示<0.05,加粗表示污染物为危险因素.
图2C展示了单污染物模型调整混杂变量后空气污染对是否有不良孕产史孕妇的效应.对于无不良孕产史的孕妇,T时期尤其T1时期的O3暴露每增加20μg/m3,其患GH的风险就会增加15.3% (OR= 1.153, 95% CI: 1.054~1.262).
图2D展示了单污染物模型调整混杂变量后空气污染对不同教育程度孕妇的效应.与大学及以上学历的孕妇相比,大学以下学历的孕妇在T时期受O3暴露的影响更大,每20μg/m3增量的O3暴露增加其26.6%患GH的风险(OR=1.266, 95% CI: 1.092~1.467).

*表示<0.05
2.4.2 多污染物模型 表5展示了多污染物Logistic回归模型中各污染物未调整和调整混杂变量的OR和95% CI.在未调整其余混杂变量的模型中,污染物暴露对孕妇患GH风险无显著效应.当模型调整了混杂变量后,Pre_T时期每20μg/m3增量的PM2.5、PM10和每10μg/m3增量的NO2暴露对孕妇患GH风险有显著效应,OR值分别为1.021 (95% CI: 1.004~1.038)、1.016 (95% CI: 1.002~1.031)和1.018 (95% CI: 1.000~1.037);T1时期的PM2.5暴露也显著增加了孕妇患GH的风险(OR=1.011, 95% CI: 1.000~1.024);T时期的O3暴露每增加10μg/m3,孕妇患GH的风险增加2.6% (OR=1.026, 95% CI: 1.002~ 1.050).
图3A~D分别展示了多污染物模型调整混杂变量后空气污染对不同年龄段、不同孕次、是否有不良孕产史和不同教育程度的孕妇的效应.对于>35岁的的孕妇,T时期的O3每增加20μg/m3,孕妇患GH的风险增加9.5% (OR=1.095, 95% CI: 1.033~1.162).对于初次妊娠的孕妇,Pre_T时期每10μg/m3的NO2增量会增加其患GH的风险,OR值为1.034 (95% CI: 1.001~1.068).多污染物模型中,各污染物对不同教育水平的孕妇患GH无显著效应.对于有不良孕产史的孕妇,T时期每20μg/m3增量的PM2.5、PM10和Pre_T时期每10μg/m3增量的NO2对其患GH有显著效应,OR值分别为1.059 (95% CI: 1.011~1.109)、1.038 (95% CI: 1.010~1.066)和1.047 (95% CI: 1.004~1.092).对于无不良孕产史的孕妇,T1时期的O3每增加20μg/m3,孕妇患GH的风险增加2.3% (OR=1.023, 95% CI: 1.004~1.042).各污染物对不同教育程度的孕妇患GH的效应无显著差异.
3 讨论
作为一个污染严重、人口众多的城市,邯郸的数据具有一定的代表性和普遍性.本研究用Logistic回归模型评估了邯郸市各项空气污染物对某医院孕妇患GH的效应.研究结果包括调整和未调整混杂变量的效应,实际上这些混杂因素是影响孕妇患GH的主要原因[28-30],因此在探究空气污染物对孕妇患GH的影响时,调整混杂变量的模型结果更接近实际效应.调整混杂变量的单污染物模型结果显示,T时期除O3外其余污染物对孕妇患GH风险增加均无显著的统计学意义.先前的研究已经证明GH和暴露于空气污染物可能有很强的关联[8-10],例如,两项美国的研究得出妊娠期PM2.5和NO2暴露与GH风险呈正相关关系[9,31],另一项荷兰的研究发现暴露于PM10和CO与GH风险增加有关[32].由于研究人群、研究环境、研究设计方案和暴露评估方法等因素的不同,研究结果在各个研究中并不一致,未来需要更多的研究来支持这一发现.另外,结果显示O3暴露在T1时期的效应要高于在T2时期的效应.因此,妊娠早期可能是发生GH的关键易感窗口,这可能是因为这一时期的空气污染会干扰母体血管重塑过程[10,33].一项来自美国的研究也发现与妊娠中期相比,妊娠早期的O3暴露对孕妇患GH的影响更大(ORT1=1.04, 95% CI: 1.03~1.06; ORT2=1.03, 95% CI: 1.02~1.04)[34].

表5 多污染物模型中各污染物的效应
注:a表示模型还调整了年龄、教育程度、医保类型、孕次、怀孕年份、怀孕季节和不良孕产史,*表示<0.05,加粗表示污染物为危险因素.
*表示<0.05
调整混杂变量的多污染物模型结果显示,Pre_T时期的PM2.5和PM10暴露对孕妇患GH风险有显著效应,这说明孕前暴露也是一个关键的暴露窗口.之前有研究调查了孕前空气污染暴露与孕妇患子痫前期和妊娠期糖尿病的关系[12-13,35-37],结果显示出显著的正相关关系,本研究结果也佐证了孕前暴露于空气污染对孕妇患产科并发症的不良影响.另外,与单污染物模型相比,多污染物模型中T时期的O3暴露对孕妇患GH的效应偏低,这说明T时期其余污染物的共暴露也是影响孕妇患GH的危险因素,在未调整其余污染物的单污染物模型高估了O3暴露的效应.几项国外的研究显示,单污染物模型中的污染物效应要高于双污染物模型中的污染物效应[9,13,38-40],一项北京的研究也发现在多污染物模型中,分别引入SO2或(和)NO2后,PM10与全人群系统疾病门诊人数的关联减弱[41].由于污染物彼此间较强的相关性,以往研究为了避免模型中出现多重共线性问题,只调整了与被研究污染物相关性相对较弱的污染物.实际环境种各空气污染物共存,各污染物对孕妇患GH可能存在协同/拮抗效应,因此需要调整目标污染物外的其余污染物的影响,使用包含多个污染物的多污染物模型,更能反映共暴露环境下单污染物的效应.
在依据孕妇年龄进行的亚组分析中,Pre_T时期的PM2.5、PM10、NO2和CO暴露显著增加了25~30岁的孕妇患GH的风险.一方面,邯郸市PM2.5、PM10、NO2和CO主要来源于交通源和工业源排放[19], 25~30岁的孕妇大部分为上班族,通常由于工作、生活等原因每天有固定的时间接受交通和环境中空气污染的暴露.另一方面,从暴露窗口来看,备孕阶段防护意识薄弱可能也是25~30岁的孕妇成为敏感人群的一个重要原因.另外,结果还表明>35岁的孕妇为T时期O3暴露的敏感人群,这与Choe等[39]的研究结果一致,其发现与25~29岁的孕妇相比,30岁以上的孕妇在妊娠期间受空气污染影响患妊娠期糖尿病的风险随着年龄增加而增大.这可能是因为高龄孕妇的脂代谢能力较差,受空气污染影响更易诱发或加重动脉粥样硬化等疾病的发生[42].
就孕次分层结果而言,Pre_T时期的PM2.5、PM10、NO2和CO暴露显著增加了初次妊娠的孕妇患GH的风险.一项武汉的研究结果也显示初产孕妇为空气污染的敏感人群,每10μg/m3增量的NO2对初产孕妇患妊娠期糖尿病的OR值为1.40 (95% CI: 1.14~1.72)[43].有研究认为初次妊娠本身是孕妇患GH的一个高危因素,胎儿来源的绒毛初次暴露,母体对其免疫应答异常导致GH发生[44-45],而母体暴露于空气污染可能会加重这种免疫反应.另外,初次妊娠的孕妇由于缺乏经验和备孕意识,更容易发生意外怀孕,缺失孕前的准备和防护,成为孕前空气污染暴露的敏感人群.
本研究还发现不良孕产史在空气污染与孕妇患GH之间的中介作用,但亚组人群对于空气污染暴露的敏感程度因污染物而异.王伟业[43]的研究表明无流产史的孕妇和有糖尿病史的孕妇受NO2污染暴露更易患妊娠期糖尿病.不良孕产史病因复杂,主要归因于遗传因素、解剖因素、内分泌因素、免疫因素和感染因素[46].由于本文的原始信息缺少不良孕产史孕妇的详细病因,譬如是否先前患妊娠期高血压类疾病导致了不良孕产结局,或者是否先前妊娠期空气污染暴露是不良孕产结局的原因之一,因此无法得出结论,有/无不良孕产史的孕妇是空气污染的敏感人群,需要进一步的研究来确定这一结果.
在单污染物模型调整混杂变量后依据孕妇教育程度进行的亚组分析中,大学以下学历的孕妇对于妊娠期间的空气污染暴露更加敏感.这与之前的研究结果一致,张晓彤[47]在武汉的研究和Choe等[39]在纽约的研究都显示受教育年限小于9a的孕妇受空气污染影响更易发生早产或患妊娠期糖尿病.这可能是因为未受高等教育年的孕妇大部分社会经济地位较低,妊娠期接受室外空气污染暴露的总时长较长,或由于围产期保健知识和防护意识的匮乏导致忽略了对空气污染的防护[48].另外,是否受高等教育的孕妇在基础健康状态也可能存在差异.
综上所述,孕前和妊娠期间的空气污染物高暴露浓度对孕妇患GH的风险存在不良效应,且这种效应在不同人群中存在一定差异.2017~2020年邯郸市CO和O3的年均污染水平远未达到环境空气质量二级标准中8h均值标准,NO2的年均污染水平除2017年外也基本未超标(表1).由于发展水平和对环境质量重视程度存在一定差距,各个国家制定的环境空气质量标准有所不同.与其他国家相比,我国NO2二级标准(40μg/m3)已处于国际领先水平,但略低于韩国和澳大利亚(30μg/m3),O3二级标准(160μg/m3)还有很大的修订空间,CO浓度限值在国际上已经比较严格[49-51].本研究中,单污染物模型结果显示CO是一个显著的危险因素,这可能是因为其余污染物的共暴露也是影响孕妇患GH的危险因素,在未调整其余污染物的单污染物模型高估了CO暴露的效应;排除其余污染物影响的多污染物模型结果显示,NO2与O3为孕妇患GH的危险因素,在污染水平相近的其他地区,如美国、丹麦和日本,研究人员也发现NO2[7,23,38]和O3[12,33-34]会增加孕妇患GH的风险,因此可能需要评估和反思我国现行NO2与O3限值标准的科学性,今后的标准既要参考发达国家,也要依据国民自身情况进行进一步的严格控制.
本研究是首个评估常规空气污染物在调整了其余污染物之后的效应的研究,巧妙地利用主成分改进的Logistic回归模型解决了纳入模型的污染物之间的共线性问题,使得结果更接近实际暴露情况.另一个优点是,本研究将孕前3个月作为一个可能的暴露窗口,探究了其间空气污染暴露对孕妇患GH的效应.同时,本研究也存在一些不足之处,由于原始数据中信息的缺失,没能调整一些可能重要的混杂变量,包括孕妇体重指数、孕妇饮酒、孕妇压力和噪音暴露等.其次,由于所获得数据的局限性,没有关于怀孕期间孕妇流动性的信息,单纯将住宅地址的暴露赋值给孕妇,无法细致地评估孕妇在工作地点的暴露情况,这在未来有待进一步研究.
4 结论
4.1 单污染物模型中,妊娠期前26周每20μg/m3增量的O3暴露与GH风险呈显著正相关关系,且在妊娠早期的效应要高于在妊娠中期的效应,妊娠早期可能是发生GH的关键易感窗口.
4.2 多污染物模型中,孕前每20μg/m3增量的PM2.5和PM10暴露与孕妇患GH呈显著正相关关系,孕前3个月也是一个关键的暴露窗口;妊娠期前26周的O3暴露对孕妇患GH风险也有显著效应,且与单污染物模型的结果相比效应偏低,空气污染物共暴露对孕妇患GH的风险可能存在协同效应.
4.3 亚组分析结果显示,25~30岁或初次妊娠的孕妇为孕前3个月PM2.5、PM10、NO2和CO暴露的易感人群;>35岁或大学以下学历的孕妇受妊娠期前26周O3暴露的影响更易患GH.
[1] Fan S J, Heinrich J, Bloom M S, et al. Ambient air pollution and depression: A systematic review with meta-analysis up to 2019 [J]. Science of the Total Environment, 2020,701:134721.
[2] Nardone A, Neophytou A M, Balmes J, et al. Ambient air pollution and asthma-related outcomes in children of color of the USA: A scoping review of literature published between 2013 and 2017 [J]. Current Allergy and Asthma Reports, 2018,18(5):29.
[3] Rajagopalan S, Al-Kindi S G, Brook R D. Air pollution and cardiovascular disease JACC state-of-the-art review [J]. Journal of the American College of Cardiology, 2018,72(17):2054-2070.
[4] Murray C J L, Aravkin A Y, Zheng P, et al. Global burden of 87 risk factors in 204 countries and territories, 1990~2019: A systematic analysis for the global burden of disease study 2019 [J]. The Lancet, 2020,396(10258):1223-1249.
[5] Jacobs M, Zhang G C, Chen S, et al. The association between ambient air pollution and selected adverse pregnancy outcomes in China: A systematic review [J]. Science of the Total Environment, 2017,579: 1179-1192.
[6] Madsen C, Haberg S E, Aamodt G, et al. Preeclampsia and hypertension during pregnancy in areas with relatively low levels of traffic air pollution [J]. Maternal and Child Health Journal, 2018, 22(4):512-519.
[7] Pedersen M, Halldorsson T I, Olsen S F, et al. Impact of road traffic pollution on pre-eclampsia and pregnancy-induced hypertensive disorders [J]. Epidemiology, 2017,28(1):99-106.
[8] Zhu Y, Zhang C, Liu D, et al. Ambient air pollution and risk of gestational hypertension [J]. American Journal of Epidemiology, 2017,186(3):334-343.
[9] Savitz D A, Elston B, Bobb J F, et al. Ambient fine particulate matter, nitrogen dioxide, and hypertensive disorders of pregnancy in New York City [J]. Epidemiology, 2015,26(5):748-757.
[10] Lee P C, Roberts J M, Catov J M, et al. First trimester exposure to ambient air pollution, pregnancy complications and adverse birth outcomes in Allegheny County, PA [J]. Maternal and Child Health Journal, 2013,17(3):545-555.
[11] Choe S A, Kauderer S, Eliot M N, et al. Air pollution, land use, and complications of pregnancy [J]. Science of the Total Environment, 2018,645:1057-1064.
[12] Mendola P, Wallace M, Liu D, et al. Air pollution exposure and preeclampsia among US women with and without asthma [J]. Environmental Research, 2016,148:248-255.
[13] Jo H, Eckel S P, Chen J C, et al. Associations of gestational diabetes mellitus with residential air pollution exposure in a large Southern California pregnancy cohort [J]. Environment International, 2019, 130:104933.
[14] Wang Q, Zhang H, Liang Q, et al. Effects of prenatal exposure to air pollution on preeclampsia in Shenzhen, China [J]. Environmental Pollution, 2018,237:18-27.
[15] 杨明翰.大气细颗粒物暴露与孕妇妊娠期血压变化的关联 [D]. 武汉:华中科技大学, 2019.
Yang M H. Association between atmospheric fine particle exposure and blood pressure changes in pregnant women during pregnancy [D]. Wuhan: Huazhong University of Science and Technology, 2019.
[16] 赵伯毅.呼和浩特市空气污染与妊娠疾病及不良出生结局关系研究 [D]. 呼和浩特:内蒙古大学, 2020.
Zhao B Y. The association between air pollution exposure and pregnancy diseases and adverse birth outcomes in Hohhot [D]. Hohhot: Inner Mongolia University, 2020.
[17] Huang X, Qiu J, Zhang Y, et al. Ambient air pollutant PM10and risk of pregnancy-induced hypertension in urban China [J]. Environmental Research Letters, 2015,10(8):084025.
[18] 许亚宣,李小敏,于华通,等.邯郸市大气复合污染特征的监测研究 [J]. 环境科学学报, 2015,35(9):2710-2722.
Xu Y X, Li X M, Yu H T, et al. Characteristics of air pollution complex in Handan [J]. Acta Scientiae Circumstantiae, 2015,35(9): 2710-2722.
[19] 李福燕,李许明,付 冲,等.邯郸市区空气污染现状及其防治措施 [J]. 环境卫生学杂志, 2015,5(4):357-360.
Li F Y, Li X M, Fu C, et al. Air pollution and prevention measures in Handan [J]. Journal of Environmental Hygiene, 2015,5(4):357-360.
[20] 彭 玏,赵媛媛,赵吉麟,等.京津冀大气污染传输通道区大气污染时空格局研究 [J]. 中国环境科学, 2019,39(2):449-458.
Peng L, Zhao Y Y, Zhao J L, et al. Spatiotemporal patterns of air pollution in air pollution transmission channel of Beijing-Tianjin- Hebei from 2000 to 2015 [J]. China Environmental Science, 2019, 39(2):449-458.
[21] 伯 鑫,徐 峻,杜晓惠,等.京津冀地区钢铁企业大气污染影响评估 [J]. 中国环境科学, 2017,37(5):1684-1692.
Bo X, Xu J, Du X H, et al. Impacts assessment of steel plants on air quality over Beijing-Tianjin-Hebei area [J]. China Environmental Science, 2017,37(5):1684-1692.
[22] 邯郸市人民政府.邯郸市综合概况[EB/OL]. http://www.hd.gov.cn/ zjhd/hdgk/zhgk/202103/t20210324_1435054.html, 2021-04-27.
Handan Municipal People's Government. Comprehensive overview of Handan City [EB/OL]. http://www.hd.gov.cn/zjhd/hdgk/zhgk/202103/ t20210324_1435054.html, 2021-04-27.
[23] Xu X, Hu H, Ha S, et al. Ambient air pollution and hypertensive disorder of pregnancy [J]. Journal of Epidemiology and Community Health, 2014,68(1):13-20.
[24] 行岳真,祁 瑞,李金梅,等.主成分Logistic回归在筛选冠心病危险因素中的应用 [J]. 实用预防医学, 2012,19(8):1138-1140.
Xing Y Z, Qi R, Li J M, et al. Application of logistic regression based on principal component analysis in the screening of risk factors of coronary heart disease [J]. Practical Preventive Medicine, 2012,19(8): 1138-1140.
[25] 裘炯良,郑剑宁,张 扬.主成分改进的Logistic回归模型方法在流行病学分析中的应用 [J]. 中国热带医学, 2005,5(2):207-209.
Qiu J L, Zheng J N, Zhang Y. Application of modified logistic regression model in the analysis of epidemiology [J]. China Tropical Medicine, 2005,5(2):207-209.
[26] 王 丹,潘晓平.主成分logistic回归在筛选妊娠期糖尿病危险因素中的应用 [J]. 现代预防医学, 2008,35(5):826-827,830.
Wang D, Pan X P. Application of logistic regression based on principal component analysis on risk factors of women with gestational diabetes mellitus [J]. Modern Preventive Medicine, 2008,35(5):826-827,830.
[27] GB 3095-2012 环境空气质量标准 [S].
GB 3095-2012 Ambient air quality standards [S].
[28] 顾 颖,冯亚玲,许 倩.妊娠期高血压疾病的相关危险因素分析 [J]. 中国卫生统计, 2017,34(4):618-619,624.
Gu Y, Feng Y L, Xu Q. Risk factors of hypertension in pregnancy [J]. Chinese Journal of Health Statistics, 2017,34(4):618-619,624.
[29] 林 彤,陈丽红,胡继芬,等.妊娠期高血压的危险因素 [J]. 中华高血压杂志, 2015,23(1):83-85.
Lin T, Chen L H, Hu J F, et al. Risk factors for hypertension during pregnancy [J]. Chinese Journal of Hypertension, 2015,23(1):83-85.
[30] 张秀兰,袁碧波,李增彦.妊娠期高血压疾病发生的危险因素及预防措施分析[J]. 中国妇幼保健, 2017,32(17):4052-4054.
Zhang X L, Yuan B B, Li Z Y. Analysis of risk factors and preventive measures of hypertensive diseases during pregnancy [J]. Maternal and Child Health Care of China, 2017,32(17):4052-4054.
[31] Nobles C J, Williams A, Ouidir M, et al. Differential effect of ambient air pollution exposure on risk of gestational hypertension and preeclampsia [J]. Hypertension, 2019,74(2):384-390.
[32] van den Hooven E H, de Kluizenaar Y, Pierik F H, et al. Air pollution, blood pressure, and the risk of hypertensive complications during pregnancy: The generation R study [J]. Hypertension, 2011,57(3): 406-412.
[33] Mobasher Z, Salam M T, Goodwin T M, et al. Associations between ambient air pollution and Hypertensive Disorders of Pregnancy [J]. Environmental Research, 2013,123:9-16.
[34] Hu H, Ha S, Xu X. Ozone and hypertensive disorders of pregnancy in Florida: Identifying critical windows of exposure [J]. Environmental Research, 2017,153:120-125.
[35] Rudra C B, Williams M A, Sheppard L, et al. Ambient carbon monoxide and fine particulate matter in relation to preeclampsia and preterm delivery in western Washington State [J]. Environmental Health Perspectives, 2011,119(6):886-892.
[36] Najafi M L, Zarei M, Gohari A, et al. Preconception air pollution exposure and glucose tolerance in healthy pregnant women in a middle-income country [J]. Environmental Health, 2020,19(1):131.
[37] Robledo C A, Mendola P, Yeung E, et al. Preconception and early pregnancy air pollution exposures and risk of gestational diabetes mellitus [J]. Environmental Research, 2015,137:316-322.
[38] Michikawa T, Morokuma S, Fukushima K, et al. A register-based study of the association between air pollutants and hypertensive disorders in pregnancy among the Japanese population [J]. Environmental Research, 2015,142:644-650.
[39] Choe S A, Eliot M N, Savitz D A, et al. Ambient air pollution during pregnancy and risk of gestational diabetes in New York City [J]. Environmental Research, 2019,175:414-420.
[40] Pan S C, Huang C C, Lin S J, et al. Gestational diabetes mellitus was related to ambient air pollutant nitric oxide during early gestation [J]. Environmental Research, 2017,158:318-323.
[41] 张 莹,邵 毅,王式功,等.北京市空气污染物对呼吸系统疾病门诊人数的影响 [J]. 中国环境科学, 2014,34(9):2401-2407.
Zhang Y, Shao Y, Wang S G, et al. Relationship between air pollutant and respiratory diseases hospital outpatient visits in Beijing [J]. China Environmental Science, 2014,34(9):2401-2407.
[42] 刘 情,王笑笑,张英奎,等.河北省2016年妇女妊娠期高血压疾病与年龄的相关性分析 [J]. 中华流行病学杂志, 2018,39(9):1270-1273.
Liu Q, Wang X X, Zhang Y K, et al. Correlation analysis of hypertensive disease during pregnancy and age in Hebei Province in 2016 [J]. Chinese Journal of Epidemiology, 2018,39(9):1270-1273.
[43] 王伟业.武汉市孕妇孕期NO2暴露与胎儿生长及妊娠期糖尿病关系研究 [D]. 武汉:华中科技大学, 2017.
Wang W Y. Gestational diabetes mellitus and fetal growth in association with maternal NO2exposure during pregnancy in Wuhan city [D]. Wuhan: Huazhong University of Science and Technology, 2017.
[44] Shiozaki A, Matsuda Y, Satoh S, et al. Comparison of risk factors for gestational hypertension and preeclampsia in Japanese singleton pregnancies [J]. Journal of Obstetrics and Gynaecology Research, 2013,39(2):492-499.
[45] Li X, Tan H Z, Huang X, et al. Similarities and differences between the risk factors for gestational hypertension and preeclampsia: A population based cohort study in south China [J]. Pregnancy Hypertension-an International Journal of Womens Cardiovascular Health, 2016,6(1):66-71.
[46] Lao T T, Hui A S Y, Law L W, et al. Prior abortion history and pregnancy hypertensive disorders in primiparous gravidae [J]. Pregnancy Hypertens, 2018,14:168-173.
[47] 张晓彤.武汉市孕妇孕期空气细颗粒物暴露与早产的关联性研究 [D]. 武汉:武汉大学, 2020.
Zhang X T. The association between maternal PM2.5exposure and preterm birth in Wuhan [D]. Wuhan: Wuhan University, 2020.
[48] Ng C, Malig B, Hasheminassab S, et al. Source apportionment of fine particulate matter and risk of term low birth weight in California: Exploring modification by region and maternal characteristics [J]. Science of the Total Environment, 2017,605-606:647-654.
[49] 董 洁,李梦茹,孙若丹,等.我国空气质量标准执行现状及与国外标准比较研究 [J]. 环境与可持续发展, 2015,40(5):87-92.
Dong J, Li M R, Sun R D, et al. Study on the air quality standards of china and comparative with foreign standards [J]. Environment and Sustainable Development, 2015,40(5):87-92.
[50] 郭 超,郜 志.关于国内外臭氧限值浓度标准的探究 [J]. 建筑科学, 2020,36(2):163-170,199.
Guo C, Gao Z. Research on ozone limit concentration standards at home and abroad [J]. Building Science, 2020,36(2):163-170,199.
[51] 王宗爽,武 婷,车 飞,等.中外环境空气质量标准比较 [J]. 环境科学研究, 2010,23(3):253-260.
Wang Z S, Wu T, Che F, et al. Comparison between domestic and international ambient air quality standards [J]. Research of Environmental Sciences, 2010,23(3):253-260.
Maternal exposure to ambient air pollution and gestational hypertension in Handan.
CAO Lei1,2, WANG Ting1,2, WANG Li-jun1,2, DIAO Rui-ping3, YU Li-jing3, CUI Xiao-li3, MAO Hong-jun1,2*
(1.Tianjin Key Laboratory of Urban Transport Emission Research, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China;2.State Environmental Protection Key Laboratory of Urban Ambient Air Particulate Matter Pollution Prevention and Control, Tianjin 300350, China;3.Handan Maternal and Child Health Hospital, Hebei 056001, China)., 2022,42(1):444~455
The traditional logistic regression model was used to evaluate the effects of exposure to various pollutants on GH, and the logistic regression model based on principal component analysis was used to evaluate the effects on GH by additionally adjusting parameters of other pollutants. Results of single-pollutant model showed that each 20μg/m3increment of O3was significantly positively correlated with the increased risk of GH (OR=1.211, 95%CI: 1.094~1.340) during the first 26 weeks of gestation, and the effect in the first trimester was greater than that in the second trimester. In multi-pollutant model, each 20μg/m3increment of PM2.5and PM10exposure significantly increased the GH risk of pregnant women in the three months before pregnancy, with OR values of 1.021 (95%CI: 1.004~1.038) for PM2.5and 1.016 (95%CI: 1.002~1.031) for PM10. Consistent with the results of single-pollutant model, each 20μg/m3increment of O3exposure also had a significant effect on the risk of GH (OR=1.026, 95%CI: 1.002~1.050) during the first 26 weeks of gestation in multi-pollutant model. The results of subgroup analysis showed that pregnant women aged 25~30 years or those in the first pregnancy were susceptible to PM2.5, PM10, NO2and CO exposure before pregnancy, while pregnant women over 35 years old or without college degrees were more likely to develop GH due to O3exposure during pregnancy. In summary, air pollution in Handan has significant impacts on pregnant women inducing suffering from GH. To mitigate the negative impacts of exposure to air pollution, more attention should be paid to the enhancement of air pollution protection awareness for pregnant women before and during pregnancy.
gestational hypertension;air pollution;pregnancy;cohort study
X703.5
A
1000-6923(2022)01-0444-12
曹 蕾(1997-),女,山西长治人,南开大学硕士研究生,主要从事大气污染与人体健康研究.
2021-06-05
中央高校基本科研业务费(63211075)
* 责任作者, 教授, hongjun_mao@hotmail.com
