硫酸铜和马度米星铵联合暴露对鲫鱼的毒性和效应标记物研究
2022-01-20高修歌杨丹宋昕昊彭麟季辉郭大伟江善祥
高修歌,杨丹,宋昕昊,彭麟,季辉,郭大伟,江善祥
南京农业大学动物医学院,南京 210095
目前环境中抗生素与重金属的复合污染现象日益严重,复合污染产生的环境效应与单一污染不同[1],对生态环境和人体健康构成潜在威胁[2]。铜是水体污染中最常见的重金属之一[3],也是生命体必需的微量元素。水中的铜污染源有许多,如渔业生产中使用的CuSO4、从空气中沉降进入水体的悬浮物、农业灌溉和工业生产排放的含铜废液等。当水中Cu2+浓度超出限度,会对水生动物造成严重危害甚至导致死亡[4]。在生产实践中,由于未合理使用铜制剂导致水生动物铜中毒的事件屡有发生。姚志峰等[5]研究发现,中华鲟体内抗氧化酶的活性随着Cu2+浓度的升高而降低,体内氧化物质不断积累,对细胞膜结构造成损伤,从而导致死亡。有学者指出,贝类可通过进食等多种途径吸收水环境中的碘化铜,对Cu2+有较强的富集能力[6]。当Cu2+在体内蓄积到一定量时,可通过食物链进入人体,对人类健康构成潜在威胁[7]。研究发现,Cu2+对斑马鱼胚胎96 h的半数致死浓度(50% lethal concentration, LC50)是2.5 μg·L-1,Cu2+可诱导斑马鱼心脏细胞凋亡[8],且抑制胚胎的生长发育和孵化[9]。鱼鳃是吸收Cu2+的主要部位,进入机体的Cu2+首先在肠道富集,随后通过生化反应和血液运输至机体其他部位[10],最终主要在肝脏中富集,造成肝组织损伤[11]。因此,Cu2+的生态毒性效应仍是亟待解决的重要环境问题之一。
马度米星铵(maduramicin)是一种聚醚类离子载体抗生素,广泛用于肉鸡球虫病的防治[12]。其在鸡体内代谢较快且大部分以药物原型通过鸡粪进入土壤中,进一步污染水体等环境[13]。美国食品药品监督管理局(Food and Drug Administration, FDA)新兽药申报材料显示,马度米星铵经水体染毒引起虹鳟鱼死亡的96 h-LC50为5.0 mg·L-1,引起蓝鳃太阳鱼死亡的96 h-LC50为1.4 mg·L-1,对蓝鳃太阳鱼的毒性为高毒,马度米星铵对大型溞48 h半数有效浓度(median effective concentration, EC50)为7.5 mg·L-1。马度米星铵对克氏原螯虾的96 h-LC50为67.03 mg·L-1[14],说明克氏原螯虾对马度米星铵的耐受力较高[15]。马度米星铵对斑马鱼的96 h-LC50为13.33 mg·L-1[16]。然而马度米星铵对不同水生生物的毒性效应仍不可知,有待进一步探究。
鲫鱼是我国最常见的淡水鱼类之一,在我国广泛养殖。鲫鱼作为实验用动物,可应用于毒理学、比较病理学及环境科学等科研领域。鲫鱼对农药、重金属等化学品较为敏感,是研究水生态毒理学的理想模型之一[17-18]。王晓峰等[19]通过检测鲫鱼体内多氯联苯的含量,评价电子垃圾拆解地区的环境污染状况。王宗保等[20]成功建立鲫鱼肝脏肿瘤模型,为肿瘤学研究提供了新的可能。鲫鱼在药物安全性及疗效评价方面也占有重要地位,已有学者研究了四环素、奥比沙星及甲苯达唑等药物在鲫鱼体内的药物动力学、毒性及残留[21-23],为药物合理使用提供了科学依据。
目前,环境中抗生素与重金属的复合污染现象日益严重,抗生素与重金属结合后可能扮演一种未知的环境角色,产生的环境效应与单一污染的作用不同,对生态环境和人类健康构成潜在威胁[24]。马度米星铵和Cu2+在水环境中可能共存,对水生物造成潜在危害。为明确Cu2+和马度米星铵复合污染对水生生物的毒性效应,本研究拟以鲫鱼为试验动物,从不同角度探讨硫酸铜和马度米星铵对鲫鱼的单一及联合毒性作用,以期为重金属和抗生素的合理使用及水生态环境保护提供理论依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
增氧气泵(S-50BX型,塞尔科技,中国),溶解氧测定仪(AR8010型,希玛仪表集团有限公司,中国),水质硬度检测仪(TDS型,力晨科技,中国),pH计(SX-610型,上海三信仪表厂,中国),体视显微镜(SZ51型,奥林巴斯公司,日本),微型电动匀浆器(1658050型,伯乐公司,美国),切片机(RM型,上海徕卡仪器,中国),微量紫外分光光度计(NanoDrop 2000型,赛默飞世尔公司,美国),PCR仪(T100型,伯乐公司,美国),荧光定量PCR仪(CFX96型,伯乐公司,美国),电泳仪(DYY-6C型,北京六一生物科技有限公司,中国),荧光显微镜(DP73型,奥林巴斯公司,日本)。
马度米星铵(含量91.9%,浙江汇能生物股份有限公司),CuSO4·5H2O(纯度99.0%,国药集团化学试剂有限公司),异丙醇(纯度99.5%,上海申博化工有限公司),DNase/RNase-Free Water、Tris-HCl、吉姆萨浓缩染液、乙二胺四乙酸二钠、胰蛋白酶消化液购自北京索莱宝科技有限公司,三氯甲烷、丙酮、盐酸和氢氧化钠购自上海凌峰化学试剂公司,均为分析纯,PrimeScript RT reagent Kit With gDNA Eraser(RR420A)、RNAiso Plus(9108)和TB Green Premix Ex Taq Ⅱ)(RR047A)购自宝日医生物技术(北京)有限公司,总蛋白定量测定试剂盒(A045-4-2)、总超氧化物歧化酶(SOD)测定试剂盒(A001-3-2)、过氧化氢酶(CAT)测定试剂盒(A007-1-1)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(A005-1-2)、丙二醛(MDA)测定试剂盒(A003-1-2)、脱氧核糖核酸(DNA)损伤试剂盒(G010-1-1)购自南京建成生物工程研究所。
1.2 实验用动物
体质量(146±15) g的鲫鱼购于南京特给力种植专业合作社,置于帆布鱼池中(1 m×1 m×0.8 m)。实验用水为充分曝气除氯的自来水(pH值约为7,温度(20±2) ℃,溶氧量始终>6 mg·L-1,总硬度为80 mg·L-1)。鲫鱼在上述水环境中适应性驯养一周,保证12 h∶12 h的光照/黑暗周期,增氧泵24 h持续泵氧。驯养期间每天换水1次,定时按体质量1%投喂不含抗生素的全价鱼饲料并清理池底粪便及剩余饲料,一周内自然死亡率低于5%才可用于后续试验。
1.3 方法
1.3.1 硫酸铜对鲫鱼的急性毒性
急性毒性实验采用半静态染毒法[25],依据预试验得到的100%致死浓度和最大耐受浓度,等比设计7个浓度组(2.5、3.4、4.6、6.2、8.4、11.4和15.5 mg·L-1CuSO4)和空白对照组,每组设置3个平行,每个平行10尾鲫鱼。鲫鱼在试验前一天禁食直至试验结束,试验期间,每隔24 h更换一半染毒溶液并补充至初始浓度,在试验开始的第2~8小时内观察鲫鱼的临床表现,每隔24 h记录鲫鱼的中毒表现及死亡尾数,连续观察96 h。试验过程中及时清出死鱼,判断标准为鳃盖停止活动,用玻璃棒轻触鱼尾部,5 min内鱼无反应。采用寇氏法计算硫酸铜对鲫鱼的96 h-LC50和安全浓度。
1.3.2 硫酸铜和马度米星铵联合暴露对鲫鱼的急性毒性
本实验室前期研究表明马度米星铵对鲫鱼的96 h-LC50为11.22 mg·L-1(数据尚未发表),以硫酸铜和马度米星铵对鲫鱼96 h-LC50值为一个毒性单位,按毒性1∶1的混合比例[8],设置0.1、0.2、0.4、0.8和1.6毒性单位混合染毒液进行联合毒性试验,并设对照组,每组设3个平行,每个平行10尾鲫鱼,试验方法与单一染毒试验相同。采用Marking相加指数法[9]评价其联合毒性大小,公式如下:
式中:S表示混合物毒性之和;A和B分别为单一染毒的LC50;Am和Bm分别为联合染毒的LC50。运用S值计算相加指数(additive index, AI)值,用AI判断联合毒性,当S≤1时,AI=1/S-1;当S>1时,AI=-S+1。AI>0时为协同作用,AI=0时为加和作用,AI<0时为拮抗作用。
1.3.3 硫酸铜和马度米星铵联合暴露对鲫鱼的亚急性毒性
根据急性毒性试验结果,依据《渔业水质标准》(GB 11607—89)对养殖水体中铜离子的浓度要求及亚急性毒性试验设计基本原则,分别以硫酸铜和马度米星铵联合染毒时96 h-LC50的1/140和1/10作为低、高2个剂量组,并按毒性1∶1进行联合染毒,具体分组如表1所示。每组设3个平行,每个平行24条鲫鱼,持续染毒21 d。
1.3.4 样品采集
在持续染毒第7天和第21天,分别从各组随机取6尾鲫鱼,头部穿刺处死,解剖取肝脏,放入冻存管中,液氮速冻后转存于-80 ℃。染毒第21天,分别从各组随机取6尾鲫鱼,断尾采血。在4 ℃条件下,3 000 r·min-1离心10 min,取上清,用于血生化分析。染毒第21天,分别从各组随机取6尾鲫鱼,断尾采血,用于制备血涂片,同时,解剖取肝脏,用于制备肝细胞悬液。
1.3.5 血生化的测定
采用全自动生化分析仪检测鲫鱼血清中的碱性磷酸酶(ALP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)活性。
1.3.6 抗氧化酶活性的测定
从-80 ℃取出样品,冰上解冻,按1∶9的质量体积比加入磷酸盐缓冲液(PBS),冰上匀浆,4 ℃,12 000 r·min-1离心15 min,取上清液检测相关生化指标。总蛋白浓度、SOD、CAT和谷胱甘肽过氧化物酶(GPx)的酶活性及MDA含量的测定步骤参照试剂盒说明书。
1.3.7 抗氧化酶相关基因的表达分析
采用实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)测定基因sod、cat和gpx的mRNA表达,应用Primer Premier 5.0设计基因引物(表2),引物由南京擎科生物科技有限公司合成。将待测鲫鱼肝脏组织从-80 ℃冰箱中取出后在液氮中研磨后,快速转移至2 mL管中,加入1 mL RNAiso,冰上匀浆。加入0.2 mL氯仿,涡旋后12 000 r·min-1离心15 min,转移上清。加入1 mL异丙醇,涡旋后12 000 r·min-1离心10 min,弃液。加入75%乙醇(1 mL)洗涤,12 000 r·min-1离心5 min,弃液,洗涤2次。室温干燥8~10 min,加DEPC水80 μL溶解,RNA溶液于-80 ℃短期保存。测定RNA样品中RNA浓度及OD值,以OD260/OD280比值判断RNA纯度,比值为1.8~2.0的RNA作反转录。反转录过程及RT-qPCR程序参见本实验室已发表文献[16],以ef1α为内参基因,按照2-ΔΔCT法计算目的基因相对表达量。
1.3.8 外周血微核试验
鲫鱼断尾取血,前2~3滴丢弃,用预先经肝素钠溶液湿润过的枪头吸取尾部的外周血,滴加到洁净载玻片的一端,取另一盖玻片以30°左右的夹角均匀推动血液,在玻片上形成一层血膜,晾干后甲醇中固定15 min。血涂片置于染缸中,10%吉姆萨染液室温下染色15 min。蒸馏水从一端冲洗,自然晾干。使用显微镜的油镜观察染色后的血膜并用MShot Image Analysis System软件拍照。每张血涂片观察并拍照1 000个细胞,计算微核率,公式如下:
微核率(‰)=观察到含微核细胞数/观察细胞总数×1000‰
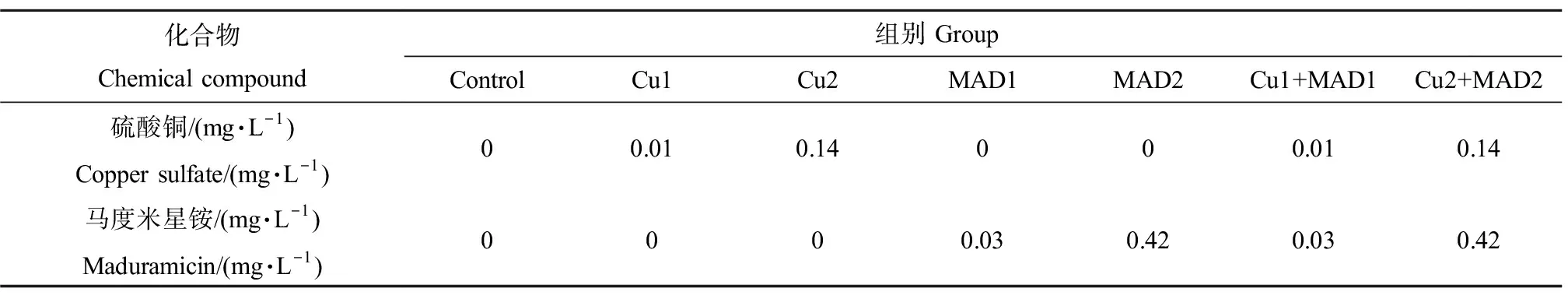
表1 染毒剂量与分组Table 1 Exposure doses and group setting
1.3.9 单细胞凝胶电泳1.3.9.1 试剂溶液配制
称取0.20 g 0.5%正常熔点琼脂糖,加PBS 40 mL,加热溶解;称取0.14 g 0.7%低熔点琼脂糖,加PBS 20 mL,加热溶解。0.4 mg·L-1Tris-HCl:称取Tris 12.114 g,加水溶解,HCl调pH值至7.5,定容至250 mL。300 mmol·L-1NaOH:称取NaOH 3.0 g,加水溶解,定容至250 mL。1 mmol·L-1EDTA-Na2:称取EDTA-Na20.1861 g,加水溶解,定容至500 mL。碱性电泳缓冲液:将EDTA-Na2与NaOH溶液等体积混合,调节pH值>13,现用现配。
1.3.9.2 肝细胞悬液制备
鲫鱼解剖取肝脏于离心管中,加入所取组织10倍体积的0.25%胰蛋白酶,4 ℃消化15 min,1 000 r·min-1离心5 r·min-1,弃上清,PBS清洗,过200目细胞筛,细胞计数,调整细胞浓度至1×106个·mL-1左右。
1.3.9.3 单细胞凝胶电泳步骤
制备琼脂糖胶。第1层:载玻片上滴加正常熔点琼脂糖100 μL,加盖玻片,4 ℃固化。第2层:取肝细胞悬液10 μL与低熔点琼脂糖75 μL混匀,滴加至第1层,加盖玻片,4 ℃固化。第3层:揭去盖玻片,滴加低熔点琼脂糖75 μL,加盖玻片,4 ℃固化。
细胞裂解:玻片浸入冷的细胞裂解液中,4 ℃避光1.5 h。DNA碱解旋:向电泳槽中加入电泳缓冲液,载玻片浸于液面以下,碱解旋30 min。电泳:电压25 V,电流300 mA,电泳30 min。中和:载玻片置于平皿中,加Tris-HCl,4 ℃中和10 min,中和3次,弃去Tris-HCl。染色镜检:加PI染液20 μL,加盖玻片,避光染色10 min,荧光显微镜观察拍照。
1.3.10 数据处理及分析
用Excel分析数据,按寇式法计算LC50和安全浓度,公式如下:
95%可信限=lg-1(lgLC50±1.96×Sm)
式中:Xi是剂量对数,Pi是死亡率,Sm是标准误,d是对数差,n是实验动物数。采用SPSS 26.0软件统计分析,差异显著性检验采用单因素方差分析(One-way ANOVA, LSD)。结果以平均值±标准误(mean±SE)表示,并用GraphPad Prism 8软件作图。用CASP 1.22软件分析彗星图像。
2 结果(Results)
2.1 硫酸铜和马度米星铵单一或联合暴露对鲫鱼的急性毒性
由表3可知,硫酸铜对鲫鱼的96 h-LC50为3.6 mg·L-1,其95%置信区间是3.31~3.95 mg·L-1,安全浓度为0.36 mg·L-1。硫酸铜和马度米星铵联合暴露时,硫酸铜对鲫鱼的96 h-LC50为1.4 mg·L-1,其95%置信区间是1.16~1.73 mg·L-1,安全浓度为0.14 mg·L-1;马度米星铵对鲫鱼的96 h-LC50为4.2 mg·L-1,其95%置信区间是3.45~5.16 mg·L-1,安全浓度为0.42 mg·L-1。采用水生毒理联合效应Marking相加指数法[9]评价硫酸铜和马度米星铵的联合毒性大小,生物毒性之和为0.76,AI值为0.31,AI>0,表明硫酸铜与马度米星铵对鲫鱼的联合急性毒性为协同作用。

表2 RT-qPCR的引物序列Table 2 Primer sequences of RT-qPCR
2.2 硫酸铜和马度米星铵单一及联合暴露对鲫鱼肝脏抗氧化酶活性及MDA含量的影响
2.2.1 硫酸铜单一暴露对鲫鱼肝脏抗氧化酶活性和MDA含量的影响
如图1(a)所示,与空白对照组相比,Cu1组鲫鱼肝脏中SOD活性无显著变化(P>0.05);染毒第21天,Cu2组SOD活性显著低于对照组(P<0.05)。染毒期间,Cu2组CAT活性均低于对照组;染毒第7天,Cu2组CAT活性显著低于对照组(P<0.05),如图1(b)所示。染毒第21天,Cu2组GPx活性显著低于对照组(P<0.05),如图1(c)所示。Cu1和Cu2组MDA含量在染毒期间逐渐升高,存在时间-效应关系(图1(d)),但与空白对照组相比差异不显著(P>0.05)。
2.2.2 马度米星铵单一暴露对鲫鱼肝脏抗氧化酶活性和MDA含量的影响
与空白对照组相比,染毒第21天,MAD1组SOD活性显著高于对照组(P<0.05),如图2(a)所示。染毒第7天,MAD1组CAT活性显著高于对照组(P<0.05),如图2(b)所示。染毒第21天,MAD2组GPx活性显著低于对照组(P<0.05),如图2(c)所示。染毒第21天,MAD2组MDA含量显著高于对照组(P<0.01),如图2(d)所示。
2.2.3 硫酸铜和马度米星铵联合暴露对鲫鱼肝脏抗氧化酶活性和MDA含量的影响
如图3(a)所示,染毒第7天,Cu1+MAD1组SOD活性显著高于对照组(P<0.01);染毒第21天,Cu2+MAD2组SOD活性显著低于对照组(P<0.01)。染毒第7天,Cu1+MAD1组CAT活性显著高于对照组(P<0.01),如图3(b)所示。染毒第21天,Cu2+MAD2组GPx活性显著低于对照组(P<0.01),如图3(c)所示。如图3(d)所示,Cu1+MAD1和Cu2+MAD2组MDA含量均高于对照组;第21天,染毒组MDA含量显著高于对照组(P<0.01)。
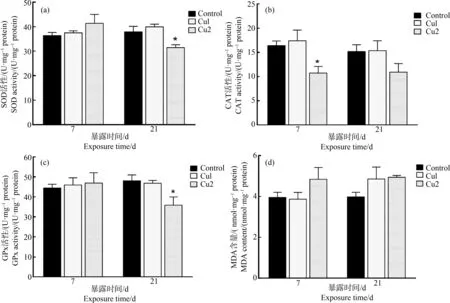
图1 硫酸铜单一暴露对鲫鱼肝脏超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx) 活性和丙二醛(MDA)含量的影响注:Cu1代表0.01 mg·L-1 CuSO4处理组,Cu2代表0.14 mg·L-1 CuSO4处理组,下同;与对照组相比,*表示差异显著(P<0.05),n=6。Fig. 1 Effects of single copper sulphate exposure on the activities of superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GPx) and malondialdehyde (MDA) content in the liver of Carassius auratusNote: Cu1 means 0.01 mg·L-1 CuSO4 treatment group; Cu2 represents 0.14 mg·L-1 CuSO4 treatment group; the same below; *indicates significant difference at 0.05 level compared with control group (P<0.05), n=6.
2.3 硫酸铜和马度米星铵单一及联合暴露对鲫鱼肝脏抗氧化基因表达的影响
2.3.1 硫酸铜单一暴露对鲫鱼肝脏抗氧化基因表达的影响
染毒期间,各组sod的mRNA相对表达量无显著变化(P>0.05),如图4(a)所示。如图4(b)所示,染毒第7天,Cu2组cat的mRNA相对表达量显著低于对照组(P<0.05);染毒第21天,Cu1组cat的mRNA相对表达量显著低于对照组(P<0.05),Cu2组cat的mRNA相对表达量显著低于对照组(P<0.01)。试验期间,各组gpx的mRNA相对表达量均低于对照组,但无显著性差异(P>0.05),如图4(c)所示。
图2 马度米星铵单一暴露对鲫鱼肝脏SOD、CAT、GPx活性和MDA含量的影响注:MAD1代表0.03 mg·L-1马度米星铵处理组,MAD2代表0.42 mg·L-1马度米星铵处理组,下同;与对照组比, *表示差异显著(P<0.05),**表示显著差异(P<0.01),n=6。Fig. 2 Effects of single maduramicin exposure on SOD, CAT, GPx activity and MDA content in the liver of Carassius auratusNote: MAD1 represents 0.03 mg·L-1 maduramicin treatment group; MAD2 indicates 0.42 mg·L-1 maduramicin treatment group; the same below; compared with the control group, *indicates a significant difference (P<0.05), **indicates a significant difference (P<0.01), n=6.

表3 硫酸铜与马度米星铵单一及联合暴露对鲫鱼的急性毒性Table 3 Acute toxicity of single and combined exposure of copper sulphate and maduramicin on Carassius auratus
2.3.2 马度米星铵单一暴露对鲫鱼肝脏抗氧化基因的影响
试验期间,各组sod和gpx的mRNA相对表达量上下波动,与对照相比无显著变化(P>0.05),如图5(a)和图5(c)所示。如图5(b)所示,各组cat的mRNA相对表达量均低于对照组,其中第21天,MAD2组cat的mRNA相对表达量与对照组相比有显著差异(P<0.05)。
2.3.3 硫酸铜和马度米星铵联合暴露对鲫鱼肝脏抗氧化基因表达的影响
试验期间,各联合处理组sod和gpx的mRNA相对表达量上下波动,与对照相比无显著变化(P>0.05),如图6(a)和图6(c)所示。由图6(b)可知,Cu2+MAD2组cat的mRNA相对表达量显著低于对照组(P<0.05)。
2.4 硫酸铜和马度米星铵单一及联合暴露对鲫鱼血生化的影响
硫酸铜和马度米星铵单一及联合暴露对鲫鱼血生化的影响如表4所示。染毒第21天,MAD2和Cu2+MAD2组ALT活性显著高于对照组(P<0.05);其他染毒组与对照相比无显著差异(P>0.05)。染毒第21天,Cu2组AST活性最高,显著高于Cu1和对照组(P<0.05)。染毒第21天,Cu2+MAD2组ALP活性显著高于对照组(P<0.05)。
2.5 硫酸铜和马度米星铵单一及联合暴露对鲫鱼红细胞微核率的影响
由表5可知,硫酸铜和马度米星铵单一及联合染毒均诱导鲫鱼红细胞微核率上升,并且随着剂量增加而升高。Cu2和Cu2+MAD2组红细胞微核率显著高于对照组(P<0.01);MAD2组红细胞微核率显著高于对照组(P<0.05);Cu2+MAD2组红细胞微核率显著高于Cu2、MAD2和Cu1+MAD1组(P<0.01)。
2.6 硫酸铜和马度米星铵单一及联合暴露对鲫鱼肝细胞的DNA损伤
如图7所示,对照组中,鲫鱼肝细胞DNA图像为规则的圆形,没有拖尾现象。随着硫酸铜和马度米星铵浓度的增加,细胞DNA出现断裂,整体结构变得松散,头部DNA集中,尾部由DNA断片组成,呈现类似彗星的图像。随着浓度升高,荧光强度变大且彗星尾部变长。高浓度复合染毒组中彗星尾部大于单独暴露组,说明复合暴露对鲫鱼肝细胞DNA损伤更为严重。
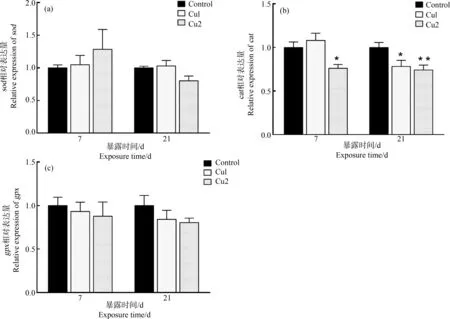
图4 暴露于硫酸铜中的鲫鱼肝脏sod、cat和gpx的mRNA相对表达量注:与对照组相比,*表示差异显著(P<0.05),**表示显著差异(P<0.01),n=6。Fig. 4 The relative mRNA level of sod, cat and gpx in the liver of Carassius auratus exposed to copper sulphateNote: Compared with the control group, *indicates a significant difference (P<0.05), **indicates a significant difference (P<0.01), n=6.
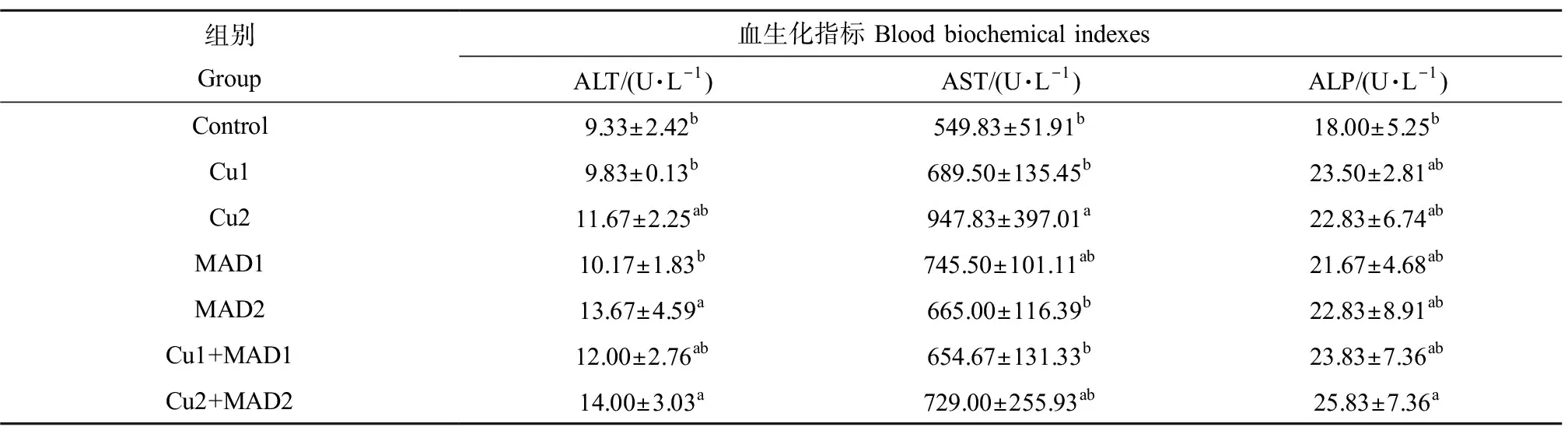
表4 硫酸铜和马度米星铵单一及联合暴露对鲫鱼血生化的影响Table 4 Effects of single and combined exposure of copper sulphate and maduramicin on blood biochemistry of Carassius auratus
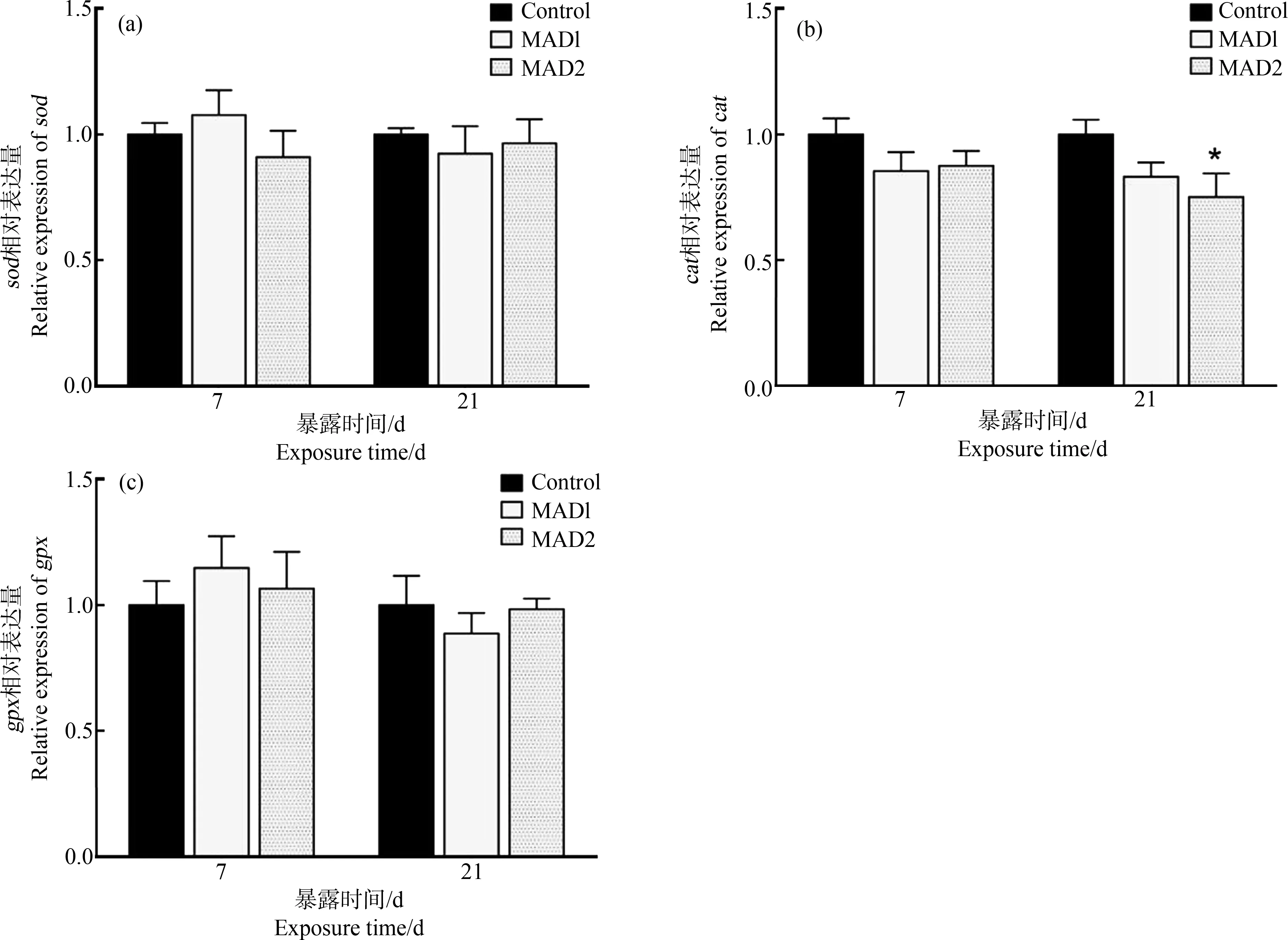
图5 暴露于马度米星铵溶液中的鲫鱼肝脏sod、cat和gpx的mRNA相对表达量注:与对照组相比,*表示差异显著(P<0.05),n=6。Fig. 5 The relative mRNA level of sod, cat and gpx in the liver of Carassius auratus exposed to maduramicinNote: *mean significant difference at 0.05 level compared with control group (P<0.05), n=6.
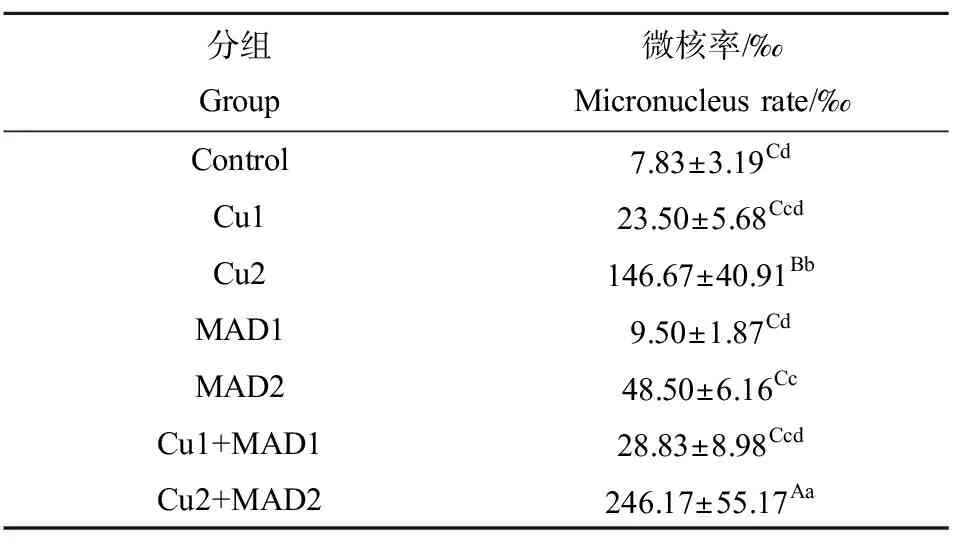
表5 硫酸铜和马度米星铵单一及联合暴露对 鲫鱼红细胞微核率的影响Table 5 Effects of single and combined exposure of copper sulphate and maduramicin on the micronucleus rate of erythrocytes of Carassius auratus
如图8所示,鲫鱼肝细胞DNA彗星图像的尾部DNA百分比、尾距、尾部长度和Oliver尾距随着硫酸铜和马度米星铵剂量升高均增高。Cu2、MAD2和Cu2+MAD2组上述指标均显著高于对照组(P<0.01)。
3 讨论(Discussion)
3.1 硫酸铜和马度米星铵单一与联合暴露对鲫鱼的急性毒性
本研究中,硫酸铜对(146±15) g鲫鱼的96 h-LC50为3.6 mg·L-1,按鱼类急性毒性标准,Cu2+对鲫鱼为高等毒性。文献报道,Cu2+对(2.58±0.27) g丰产鲫的96 h-LC50为0.085 mg·L-1[26],Cu2+对(13.2±0.8) g黄河鲤的96 h-LC50为1.12 mg·L-1[27],Cu2+对(1.95±0.53) g棕二须魮的96 h-LC50为7.5 mg·L-1[28]。由此可见,不同种属试验动物的日龄和体质量对Cu2+毒性反应差异较大,但均表明高浓度Cu2+对鱼类产生严重的毒性效应。马度米星铵对鲫鱼的96 h-LC50为11.22 mg·L-1(数据尚未发表),低于其对斑马鱼的96 h-LC50(13.33 mg·L-1),均为高等毒性。当二者联合暴露时,其96 h-LC50进一步降低至1.4 mg·L-1和4.2 mg·L-1,采用相加指数法评价二者联合毒性为协同作用。评价联合毒性的方法很多,不同的评价手段可能造成不同的结果[29]。Markering相加指数法常与时间结合以观察相互作用的变化,是目前水生毒理学研究中较为常用的一种方法[30]。截至目前,尚未有Cu2+和马度米星铵对水生动物联合毒性的报道,对于其他种属水生动物的联合毒性亦值得深入研究。
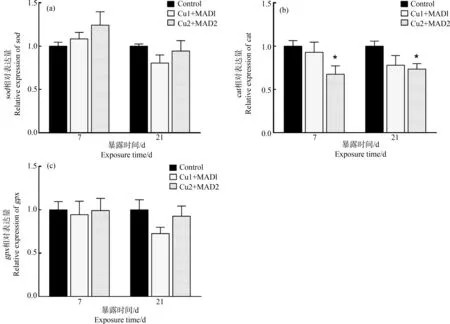
图6 暴露于硫酸铜和马度米星铵溶液中的鲫鱼肝脏sod、cat和gpx的mRNA相对表达量注:与对照组相比,*表示差异显著(P<0.05),n=6。Fig. 6 The relative mRNA levels of sod, cat and gpx in the liver of Carassius auratus exposed to copper sulphate and maduramicinNote: *means significant difference at 0.05 level compared with control group (P<0.05), n=6.

图7 硫酸铜和马度米星铵暴露对鲫鱼肝细胞DNA损伤的影响注:(a) 空白对照组;(b) 0.03 mg·L-1马度米星铵;(c) 0.01 mg·L-1硫酸铜;(d) 0.03 mg·L-1马度米星铵+0.01 mg·L-1硫酸铜; (e) 0.42 mg·L-1马度米星铵;(f) 0.14 mg·L-1硫酸铜;(g) 0.42 mg·L-1马度米星铵+0.14 mg·L-1硫酸铜。Fig. 7 Effects of copper sulphate and maduramicin exposure on DNA damage of Carassius auratus liver cellsNote: (a) negative control group; (b) 0.03 mg·L-1 maduramicin; (c) 0.01 mg·L-1 copper sulfate; (d) 0.01 mg·L-1 copper sulfate+0.03 mg·L-1 maduramicin; (e) 0.42 mg·L-1 maduramicin; (f) 0.14 mg·L-1 copper sulfate; (g) 0.14 mg·L-1 copper sulfate+0.42 mg·L-1 maduramicin.
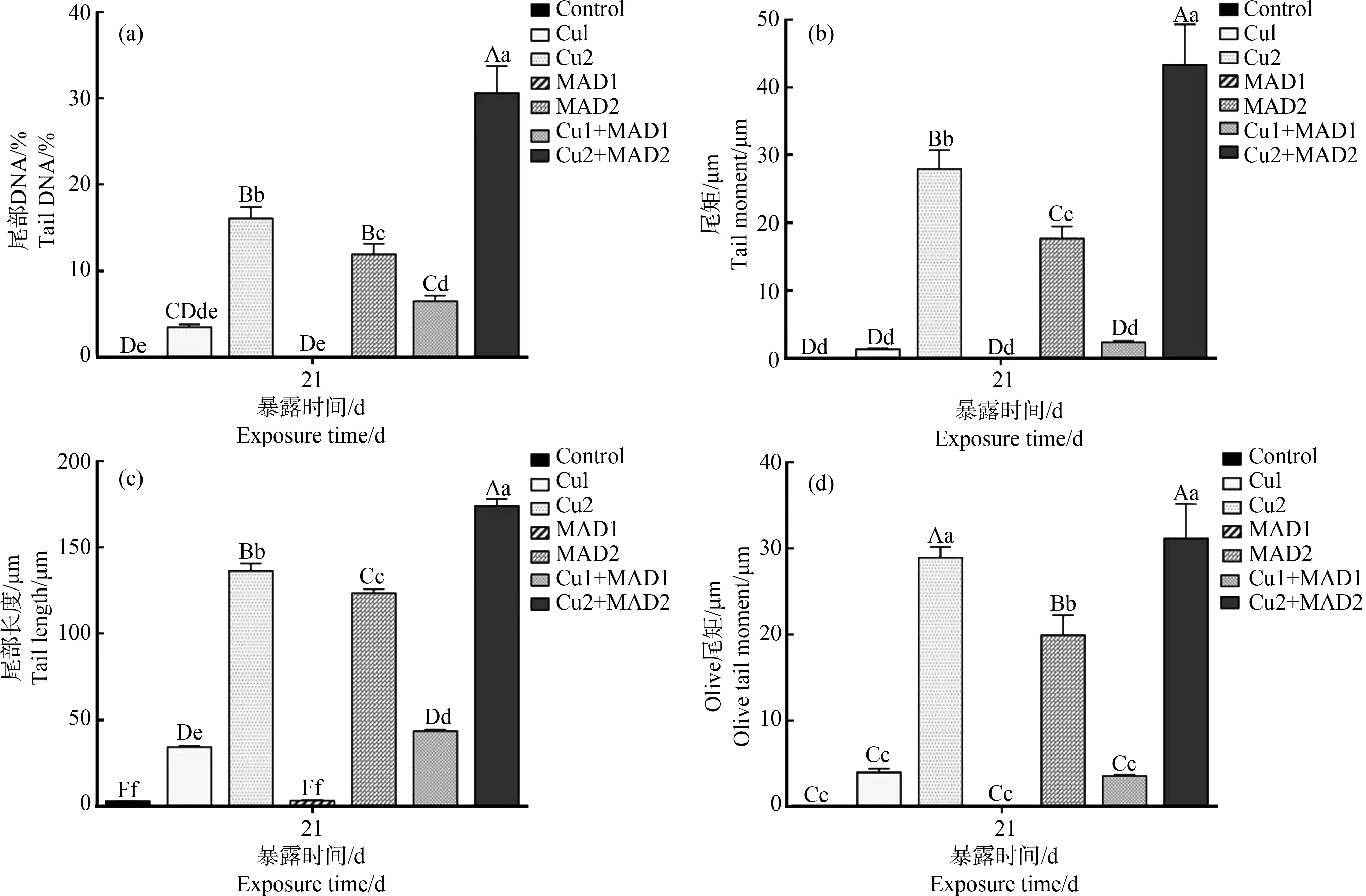
图8 硫酸铜和马度米星铵暴露对鲫鱼肝脏细胞DNA损伤的定量分析注:不同小写字母表示各处理组之间的显著差异(P<0.05),不同大写字母表示各处理组之间的显著差异(P<0.01),n=6。Fig. 8 Quantitative analysis of DNA damage of Carassius auratus liver cells induced by copper sulphate and maduramicinNote: Different lower case letters indicate significant differences between treatment groups (P<0.05), and different upper case letters indicate significant differences between treatment groups (P<0.01), n=6.
3.2 硫酸铜和马度米星铵单一或联合暴露对鲫鱼的亚急性毒性
为进一步认识Cu2+和马度米星铵二者联合暴露对鲫鱼的亚急性毒性,本研究选取二者联合染毒96 h-LC50的1/10和1/140进行亚急性毒性试验。研究显示,Cu2+和马度米星铵可影响ALT、AST和ALP的活性,当机体肝组织发生中毒、炎症等情况时,血液中ALT与AST浓度升高[31]。ALP广泛分布于肝脏、肠、肾和骨等组织,是参与机体去磷酸化和磷酸化反应的非特异性表达酶[32]。肝组织受到损伤时,血清中ALP活性增强[33]。提示Cu2+和马度米星铵对肝脏有损伤作用,然而联合染毒组上述指标与单一染毒组相比并无显著差异,表明ALT、AST和ALP尚不能作为评价Cu2+和马度米星铵的联合毒性的生物标志物。
SOD是一类广泛分布于生物体内的金属酶,其活力可间接反映机体清除氧自由基的能力[34]。本研究发现,高浓度Cu2+与马度米星铵联合暴露导致SOD活性在染毒第21天显著降低,而高浓度马度米星铵暴露可在一定程度升高SOD活性,提示Cu2+单一及联合染毒时,对鲫鱼肝脏毒性超过机体承受能力,SOD活性受到抑制,从而对机体造成毒害作用[35]。而马度米星铵对鲫鱼肝脏的毒性小于Cu2+和联合染毒组,机体可通过升高SOD活性减缓氧化损伤。CAT是生物体内重要的酶,主要通过减少过氧化氢含量降低有害物质对机体的损伤[36]。本研究发现,单一及联合染毒组的CAT活性均呈下降趋势,说明Cu2+和马度米星铵会抑制CAT活性,降低机体清除过氧化氢的能力,使机体受到过氧化氢的毒害。GPx也是组成抗氧化系统中的一种酶,其功能是将机体内的过氧化物转换成水等无害物质[37-38],本研究发现各组GPx的活性整体呈下降趋势,说明Cu2+和马度米星铵可通过破坏抗氧化系统,进而对机体造成氧化损伤。MDA是机体内脂质过氧化产物[39],MDA含量越高,机体受到的氧化损伤程度越高。本研究发现,Cu2+与马度米星铵单一和联合暴露呈浓度依赖性地升高鲫鱼肝脏中的MDA含量,但联合暴露组MDA含量和单一暴露组相比无显著差异,不能由此判断Cu2+和马度米星铵联合毒性作用的类型。《渔业水质标准》(GB 11607—89)[40]要求水环境中Cu2+的浓度不能高于0.01 mg·L-1,本试验Cu2+对鲫鱼染毒的低剂量为0.01 mg·L-1,研究发现,染毒后第21天,低浓度Cu2+显著抑制catmRNA的表达,提示鲫鱼长期暴露于低浓度Cu2+会受到氧化损伤,应当加强环境监控力度,以保护生态环境安全。
3.3 硫酸铜和马度米星铵单一或联合暴露对鲫鱼细胞微核和DNA损伤的影响
水中有害物质会影响鱼的造血器官,导致红细胞染色体畸变甚至断裂[41],当血液干细胞分裂形成新细胞时,残留于红细胞质内的断片形成微核[42]。鱼吸收了重金属等致突变物后,其外周血红细胞产生的微核数目与致畸物浓度呈正比。因此,可通过检测鱼类外周血红细胞微核数来评价水环境的污染状况[43-44]。彗星试验是快速检测单细胞DNA损伤的方法[7]。
研究表明,斑马鱼持续14 d暴露于0.5 mg·L-1的马度米星铵溶液中,红细胞微核率为(337±21.66)‰,是对照组的43.9倍[15]。有研究表明,将鲫鱼置于0.02 mg·L-1的Cu2+溶液中7 d后,红细胞微核率是对照组的6.3倍[45]。本研究中高浓度马度米星铵和Cu2+组微核率分别是对照组的6.2倍和18.7倍,这种差异可能由试验动物及染毒时间不同所致。高浓度的Cu2+和马度米星铵可明显损伤鲫鱼肝细胞DNA,推测Cu2+和马度米星铵对鲫鱼的毒害作用,导致细胞内产生大量的活性氧(ROS),损害细胞内的核糖、氨基酸和蛋白质等物质,最终导致DNA链的断裂,造成DNA损伤[46]。高浓度联合染毒组红细胞微核率和肝细胞尾部DNA百分比显著高于单独染毒组,表明高浓度Cu2+和马度米星铵联合暴露对鲫鱼的遗传毒性高于单一暴露。
综上所述,Cu2+和马度米星铵对鲫鱼的联合暴露急性毒性高于单一暴露,表现为协同作用;环境浓度下的Cu2+和一定浓度的马度米星铵单一及联合暴露均可引起一定程度的血液毒性和肝脏氧化损伤;Cu2+与马度米星铵联合暴露可显著诱导细胞微核和肝脏细胞DNA损伤,其遗传毒性高于单一暴露。养殖水体或自然水体环境中应加强Cu2+和马度米星铵的复合污染的监控与处理,以保障水生态安全及水产养殖健康发展。
