GD2 抗体达妥昔单抗β 治疗神经母细胞瘤的临床应用专家共识(2021 年版)
2022-01-20GD2单抗治疗神经母细胞瘤临床应用协作组
GD2 单抗治疗神经母细胞瘤临床应用协作组
神经母细胞瘤(neuroblastoma,NB)是儿童最常见的颅外实体肿瘤,临床表现及预后具有高度异质性。低危患儿预后较好,高危患儿即使接受化疗、放疗、手术、造血干细胞移植等多种方法的综合治疗,长期存活率仍不足50%。探索潜在的治疗靶点对于提高高危患者的生存率具有重要意义。双唾液酸神经节苷脂抗原GD 2 在NB 细胞高表达,达妥昔单抗β可与NB细胞膜表面过表达的GD2特定靶点结合,触发抗体依赖性细胞介导的细胞毒性作用和补体依赖的细胞毒性效应,通过双重免疫机制而发挥抗肿瘤作用。通过总结国外多项关键临床研究,并结合在海南和天津医疗先行区的上市前初步应用经验,我们对达妥昔单抗β 的安全性、有效性、适用人群及使用方法进行总结和推荐,提出本共识,旨在为临床医师提供指导与帮助。
1 NB概况
1.1 流行病学
NB起源于未分化的交感神经节细胞[1],好发于1~4岁,发病率约占儿童恶性肿瘤的8%~10%[2-4],但病死率占儿童期肿瘤相关性死亡的15%[5],中国儿童NB的发病率约为10.1/100万[6]。根据NB的发病年龄、组织学类型、INRG分期、MYCN扩增状态、11 q 变异、染色体倍性等多个预后影响因素,国际NB 危险度协作组将NB 患者分为极低危、低危、中危和高危4 组。危险度分组不仅反映了疾病临床表现的异质性,也是治疗方案选择的依据[7]。
1.2 治疗现状
NB 患者的5 年总体生存率已从1990 年的44%提升到2014年的61%[8],低、中危NB患者在接受以手术和/或化疗药物为主的标准方案治疗后,通常预后良好,低危组患者5 年总体生存率可达到85%以上[9],部分Ⅳs期患者的肿瘤甚至可发生自发性消退。但高危患者的治疗仍面临诸多挑战,由于微小残留病灶的存在,即使那些对诱导和巩固治疗反应良好的高危患者依然有很大的复发风险,长期存活率仍不足50%[10]。约有60%的高危患者会出现复发,20%的患者进展为难治性疾病[11],复发和难治性NB患者的中位总生存期分别仅为11.0个月和27.9个月[12]。
为优化治疗方案,开发更为有效的药物,(欧洲)国际儿童肿瘤神经母细胞瘤协作组(International Society of Paediatric Oncology Europe Neuroblostoma,SIOPEN)及北美儿童肿瘤协作组(Children’s Oncology Group,COG)开展了针对高危NB患者的系列研究,其主要治疗阶段可分为:诱导治疗(包括3~4 个月的诱导化疗和手术切除)、巩固治疗(清髓性化疗后的自体造血干细胞移植和局部放疗)和维持治疗(基于深度清除微小残留病变为目的的GD 2 免疫治疗和诱导分化为目的的顺式维甲酸的维持治疗)。
2 GD2抗体免疫治疗
2.1 GD2单克隆抗体概述
针对神经节苷脂的抗体疗法是近年来NB 治疗中应用最为广泛、特异性最强的靶向免疫疗法。GD2是一种双唾液酸神经节苷脂抗原,主要在神经外胚层肿瘤中表达。有研究显示,GD2在NB细胞100%高表达[13],因此其成为高危NB 患者最理想的治疗靶点[14]。
GD 2 单抗的研发经历了三代变迁[15]。第一代为最早研发并应用于临床的鼠源性抗体3 F 8 和14.G2a,抗肿瘤活性有限,且易引起剧烈疼痛、高血压、荨麻疹等不良反应及人类抗鼠抗体反应。第二代为人鼠嵌合性抗体,是利用基因工程将人IgG1免疫球蛋白的恒定区结合鼠14.G 2 a 抗体可变区形成的融合抗体,其介导抗体依赖性细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)的效力较14.G2a提高了50~100倍[16]。目前已有2种上市药物,第一种是2015年3月美国食品及药物管理局(Food and Drug Administration,FDA)批准上市的达妥昔单抗(dinutuximab),即ch14.18/SP 2/0,主要用于高危NB 的一线治疗;第二种是2017 年5 月欧洲药品管理局(European Medicines Agency,EMA)获批的达妥昔单抗β,即ch14.18/CHO,由ch 14.18 构建体重新克隆到中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞中得到。2018年,中国国家药品监督管理局(National Medical Products Administration,NMPA)已将达妥昔单抗β纳入境外已上市的临床急需新药名单,并于2021年8月12日批准其在中国上市,用于初治高危和复发/难治性NB患者的维持治疗。第三代是人源化抗体,其中hu3F8于2020年11月通过美国FDA的快速审批,用于治疗复发/难治性NB,而hu14.18目前仍处于临床试验阶段。
2.2 达妥昔单抗β基本信息
2.2.1 作用机制 达妥昔单抗β可与NB细胞上过表达的GD2特定靶点结合,触发ADCC和补体依赖的细胞毒性效应(complement dependent cytotoxicity,CDC),通过双重免疫机制而发挥抗肿瘤作用。
2.2.2 适应证 达妥昔单抗β 适用于:①治疗≥12 月龄的高危NB 患者,这些患者既往接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;②治疗伴或不伴有残留病灶的复发性或难治性NB。在治疗复发性NB之前,应采取适当措施使活动性进展性疾病保持稳定。难治性NB是指经过诱导化疗4疗程后,未达到部分缓解但疾病未进展;或者诱导治疗后达到部分缓解但经间碘苄胍(metaiodoenzylguanidine,MIBG)和活检证实为活动性疾病。
2.2.3 药代动力学 达妥昔单抗β采用静脉输注方式给药。APN-311-202和APN-311-303研究使用长期输注方案(10 mg/m2×10 d,每天24小时持续滴注),在输注结束时血药浓度峰值达到12 µg/mL左右。APN-311-101使用短期输注(20 mg/m2×5 d,每天滴注8 小时),血药浓度在第5 次输注结束时峰值达到16.5 µg/mL[17]。一项单中心、随机、开放标签的研究纳入了53例NB患者,采用达妥昔单抗β长期输注方案,结果显示,长期输注治疗的暴露量与短期输注治疗差异无统计学意义[18]。达妥昔单抗β可被蛋白水解酶降解为短肽和氨基酸,消除半衰期约为190 小时,即7.9天[19]。基于群体药代动力学分析,未发现性别和年龄会影响达妥昔单抗β的药代动力学,但2岁以下患儿的数据有限。肾功能(eGFR)和肝功能(胆红素)与药物暴露量没有关系。
3 达妥昔单抗β的临床应用及关键性研究
已有6 项临床应用及关键性研究评价了达妥昔单抗β治疗NB的疗效,其中包括1项针对高危NB一线维持治疗的Ⅲ期临床研究和1项历史对照实验研究、4项针对复发/难治性NB的Ⅰ/Ⅱ期单臂和Ⅲ期研究。
3.1 针对高危NB
APN311-302是一项国际多中心、随机、开放标签的Ⅲ期临床研究,共纳入406例高危NB患者。其中200例接受达妥昔单抗β+异维甲酸治疗,206例接受达妥昔单抗β+白细胞介素-2(interleukin-2,IL-2)+异维甲酸治疗。一线维持治疗时,达妥昔单抗β 单药治疗显示了与联合IL-2 治疗相似的生存结局,3 年无事件生存(EFS)率分别为55.4%和61.2%,3年总生存(overall survival,OS)率分别为64.1%和69.1%,两组间未见显著统计学差异[20]。提示与仅采用包括异维甲酸在内的传统综合治疗手段相比,高危NB 患者接受达妥昔单抗β 免疫治疗后显示出明显的生存优势,但该获益与是否联合IL-2给药无关。另一项与历史对照组比较的临床试验评估了以达妥昔单抗β为基础的免疫治疗用于高危NB 的疗效[21],与仅接受异维甲酸的标准治疗组相比,达妥昔单抗β 为基础的免疫治疗组5 年EFS率从42%提高至57%(P<0.001),5年OS率从50%提高至64%(P<0.001),累计复发/进展的发生率由57%降低至41%(P<0.001)。提示达妥昔单抗β为高危NB患者带来了明显的生存获益。
3.2 针对复发或难治性NB
APN 311-202 为Ⅰ/Ⅱ期单臂研究,APN 311-303为开放标签、非对照、回顾性、单中心Ⅲ期研究,旨在研究达妥昔单抗β治疗复发/难治性NB的疗效和安全性,结果证实达妥昔单抗β对提高高危和复发/难治性NB患者的客观缓解率 (40.5%~52%)、无病生存率(3 年EFS为54%~57%)和总体生存率(3年OS为71%)方面表现出良好的临床获益[18,22-23]。而在历史对照组中,2 年OS 率约为20%~30%[24]。上述研究还进一步证实复发/难治性NB 患者接受10 mg·m-2·d-1×10d连续24 h输注给药与20 mg·m-2·d-1×5d短期输注(8 h)相比疗效数据相当,但前者的不良反应明显降低。
4 达妥昔单抗β治疗NB方案推荐
达妥昔单抗β的推荐用法为长期输注方案。治疗共计5个周期,每个周期为35天,个体剂量基于体表面积计算,每个疗程的总剂量应为100 mg/m2。每周期前10 天内连续静脉输注给药(共240 小时),单日剂量为10 mg/m2。
4.1 用药前评估
每一疗程前脏器功能参数需满足下列条件才能接受治疗。①不吸氧状态下血氧饱和度>94%;②外周血常规:中性粒细胞绝对计数≥0.5×109/L(2 周内未使用过集落刺激因子类药物),血小板计数≥20×109/L,血红蛋白>80 g/L(血小板和血红蛋白不依赖于输注);③肝功能:丙氨酸氨基转移酶和天冬氨酸氨基转移酶均<5 倍正常值上限;④肾功能:肌酐清除率或肾小球滤过率(GFR)>60 mL/(min·1.73 m2);⑤超声心动图:心功能基本正常(左室射血分数≥50%);⑥在启动免疫治疗前患者应无全身感染迹象,且任何已确定的感染应该得到控制。
4.2 方案一
4.2.1 适用对象 高危患者经过规范治疗(须包含诱导化疗、清髓性治疗和造血干细胞移植)达到完全缓解(complete remission,CR)后的一线维持治疗。
4.2.2 具体用药 采用达妥昔单抗β 与13-顺式维甲酸(13-cis-RA,剂量四舍五入到10 mg的整数倍,建议与食物同服)联合治疗。每个疗程35天,共5个疗程(图1)。
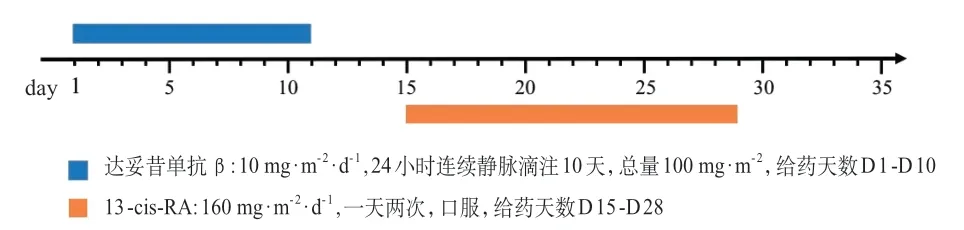
图1 方案一用药方法
4.3 方案二
4.3.1 适用对象 ①高危患者经过规范治疗(须包含诱导化疗、清髓性治疗和造血干细胞移植)后达到非常好的部分缓解(very good partial remission,VGPR);②复发/难治患者经过适当治疗措施后达到VGPR 或CR。
4.3.2 具体用药 采用达妥昔单抗β+粒细胞-巨噬细胞集落刺激因子(GM-CSF)+13-cis-RA联合治疗。每个疗程35天,共5个疗程(图2)。当中性粒细胞绝对值计数>20×109/L时应停用GM-CSF。
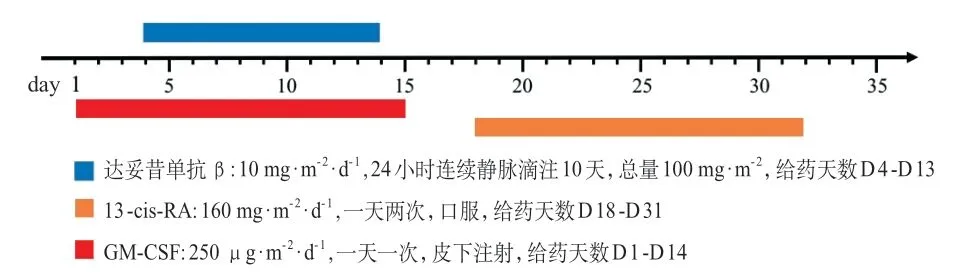
图2 方案二用药方法
4.4 方案三
4.4.1 适用对象 ①高危患者经过规范治疗(须包含诱导化疗、清髓性治疗和造血干细胞移植)后达到部分缓解(partial remission,PR)且疾病处于稳定状态;②复发/难治性患者采取适当治疗措施后,进展性病灶达到PR且疾病处于稳定状态。
4.4.2 具体用药 采用达妥昔单抗β+VIT化疗+GM-CSF+13-cis-RA联合治疗。每疗程35天,共5个疗程(图3)。当中性粒细胞绝对值计数>20×109/L时应停用GM-CSF。
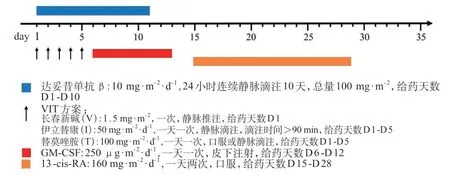
图3 方案三用药方法
4.5 评估节点及随访
接受达妥昔单抗β 治疗前2~4 周内完成血神经元特异性烯醇化酶(NSE)、乳酸脱氢酶(LDH)和免疫功能、24 h 尿香草扁桃酸(VMA)和高香草酸(HVA)、影像学及骨髓穿刺涂片和骨髓活检作为患者的基线数据。每个疗程复查血NSE 和LDH,每2个疗程复查24 h 尿VMA 和HVA。至少在第3 疗程开始前1周内和第5疗程完成后1周内复查影像学评估,第5疗程完成后4周复查免疫功能,治疗前骨髓检查阳性者需同步复查骨髓穿刺活检。
完成达妥昔单抗β治疗后的随访评估时间点及内容与其他NB患者的常规随访相同。
5 安全性管理建议
5.1 安全性
治疗相关性疼痛是达妥昔单抗β 最显著的不良反应,主要因其与神经细胞表面的GD2结合可产生神经病理性疼痛,通常在第一个疗程中比较明显。APN311-303和APN311-202研究表明,随着治疗周期延长,达妥昔单抗β治疗相关性疼痛逐步减轻,吗啡使用量逐渐减少并可停用[22-23]。其他常见不良反应包括发热、超敏反应、呕吐、腹泻、毛细血管渗漏综合征、低血压等。大多数不良事件为轻至中度,随着治疗疗程的延长,其发生率及严重程度均逐步降低[25]。
5.2 预处理用药
为预防输液过程中可能出现的不良反应,在每次输注达妥昔单抗β前应首先进行预处理用药。
5.2.1 镇痛 通常使用三联疗法,包括非阿片类镇痛药、加巴喷丁和阿片类药物进行疼痛治疗。①建议在达妥昔单抗β 给药的第1 个周期内,使用非阿片类镇痛药(如对乙酰氨基酚或布洛芬),剂量推荐参照说明书。在后续周期,若患儿未感觉明显疼痛,可考虑不用。②加巴喷丁:从达妥昔单抗β输注前3天开始,第1天口服10 mg·kg-1·d-1,第2天增加至2×10 mg·kg-1·d-1,输注的前1天及输注期间,增加至每日3×10 mg·kg-1·d-1,最大单次剂量为300 mg,维持时间根据患者需求决定。停止静脉吗啡输注后,可以逐渐减少加巴喷丁的剂量。③阿片类药物:在达妥昔单抗β 输注前2 小时,开始推注0.02至0.05 mg·kg-1·h-1的吗啡。继而在开始输注达妥昔单抗β 时,同时输注0.03 mg·kg-1·h-1的吗啡。连续输注过程中,可根据患者的疼痛感觉逐渐降低吗啡剂量。如果需要连续输注吗啡超过5 天,则应在输注达妥昔单抗β的最后一天后,每天逐渐减少20%的剂量。如停止静脉吗啡输注后,出现严重的神经性疼痛,可以按需口服吗啡硫酸盐。对于中度神经性疼痛,可以口服曲马多。若患儿出现腹痛,可给予抗胆碱能解痉药。
5.2.2 抗过敏 达妥昔单抗β可能引起输注相关的严重反应,包括细胞因子释放综合征和超敏反应。抗组胺药(如苯海拉明、氯雷他定或西替利嗪)应在每次输注单抗前约20 分钟开始静脉给药或者提前1天口服给药,在单抗输注期间持续给予抗组胺药。剂量推荐参照说明书。
5.2.3 止吐 对于达妥昔单抗β 可能引起的致吐风险,应给予止吐药物预防,如5-羟色胺受体拮抗剂。
5.3 一般不良反应的监测及处理
5.3.1 监测时间 用药期间出现的任何不良事件均进行监测和随访,直到末次用药后7天。
5.3.2 疼痛 疼痛是最常见的不良反应之一,可表现为腹痛、肢端疼痛、背痛、胸痛或关节痛等。通常发生在首次输注达妥昔单抗β期间,且发生频率在整个治疗过程中逐渐减少。因此在每次输注达妥昔单抗β前需要使用镇痛剂进行预处理用药。
5.3.3 发热 通常出现在达妥昔单抗β输注的前几天,可予以对乙酰氨基酚、布洛芬等药物,必要时进行血培养以排除感染。仅发热患者不推荐经验性抗生素治疗,即使是轻度CRP 升高,但除外伴发中性粒细胞减少或临床高度怀疑感染。发热性中性粒细胞减少症应根据相应指南[26]予以治疗。
5.3.4 消化道症状 腹泻是达妥昔单抗β常见的不良反应,常出现在输注晚期或输注结束后,主要由毛细血管渗漏综合征或吗啡停药引起,严重腹泻可给予洛哌丁胺(2 岁以下禁用)或消旋卡多曲。若出现非甾体类抗炎药引起的消化道不良反应,可给与H2受体拮抗剂或质子泵抑制剂。
5.3.5 血液学毒性 达妥昔单抗β用药期间可发生血小板减少、中性粒细胞减少和贫血。如果在下一个疗程开始前,4级血液学毒性已改善至1~2级,可予以50%输注速度给药;如恢复到基线值,可按照初始速度输注。
5.3.6 全身感染 患者因既往治疗可导致免疫功能低下,且由于NB患者通常留置中心静脉导管,因此发生全身感染的风险较大。在启动免疫治疗前患者应无全身感染迹象,且任何已确定的感染应该得到控制。在免疫治疗过程中,一旦临床高度怀疑或有明确感染依据,应尽早同步予以抗感染治疗。
5.4 需特别关注的不良反应及处理
5.4.1 超敏反应 最常见的超敏反应包括低血压(39%)、细胞因子释放综合征(32%)、荨麻疹(18%)、支气管痉挛(4%)和严重速发过敏反应(3.5%)[25]。
如果发生重度输液相关反应(包括细胞因子释放综合征),需要立即停止达妥昔单抗β治疗,且可能需要急救治疗。速发过敏反应最早可出现在首次输注达妥昔单抗β后几分钟内,通常与支气管痉挛和荨麻疹相关。细胞因子释放综合征常在首次输注后几分钟至几小时内出现,多伴有发热、低血压和荨麻疹等全身症状。因此应密切监测患者的速发过敏反应和超敏反应,尤其在前2个疗程内。
干预措施:在达妥昔单抗β 给药期间,抗组胺药、肾上腺素和静脉糖皮质激素应处于立即可用状态。对于较轻的超敏反应,如仅出现荨麻疹,可给予抗组胺药并减慢滴速到50%继续观察,若皮疹未消退,可继续减慢滴速至停药。如仅出现血管神经性水肿,应先停药,给予抗组胺药观察,若症状缓解可以25%滴速重新给药并密切观察[27]。一旦发生危及生命的超敏反应,应立即进行治疗,包括根据临床反应按需每3至5分钟使用肾上腺素静脉推注,按需静脉推注地塞米松。如果发生支气管和/或肺部超敏反应,建议吸入肾上腺素,并应根据临床反应每2小时重复给药。糖皮质激素应仅用于治疗危及生命的严重超敏反应。
建议在可立即提供全面复苏服务的医疗单位予以达妥昔单抗β输注。
5.4.2 毛细血管渗漏综合征(CLS)CLS 的特征为血管张力丧失,血浆蛋白和液体外渗到血管外间隙。CLS通常发生在开始输注后数小时内,可先于低血压、心动过速等临床症状出现,因此应密切监测患者的体质量、血压等循环及呼吸功能。≥3级的CLS出现后应该立即中断达妥昔单抗β输注并给予支持性措施,如果不良反应消退或改善至1、2级,可采用50%的速率重新开始输注。
干预措施:出现轻度CLS时,如血压尚稳定,可予以利尿剂和白蛋白静脉注射(对利尿剂顽固性急性肾损伤患者,需要肾脏替代治疗);出现重度CLS时,如患者血压不稳定,可予以晶体液、血管升压药、白蛋白静脉注射治疗,若病情严重,必要时予以有创/无创通气及肾脏替代治疗[27-28]。
5.4.3 眼部问题 达妥昔单抗β可导致眼部相关疾病的发生,包括瞳孔散大、瞳孔紧张症、眼肌麻痹、视神经乳头水肿、视物模糊、畏光等。如果视力受损可通过眼镜矫正调节,只要眼睛可耐受,则无需调整剂量。但出现3级眼毒性的患者必须永久中断治疗。如果出现任何眼部问题,患者应立即转诊至眼科就诊。
5.4.4 周围神经病变 达妥昔单抗β用药期间偶发周围神经病变。但如果患者出现因输注达妥昔单抗β导致的任何客观性长期疲乏,应永久终止治疗。对于2级神经病变患者,应暂时中断治疗,可在神经症状消退后恢复治疗。出现3 级周围神经病变或持续的2级周围神经病变,则必须永久中断治疗。
5.5 输注速度及剂量的调整原则
发生1、2 级不良事件时,应将达妥昔单抗β 的输注速度降低至50%,待症状完全缓解后,以初始速度恢复输注。发生3、4 级不良事件时,应暂时中断输注并给予支持性干预措施,如不良反应部分缓解或改善至1、2级,以50%的初始速率重新开始输注;完全缓解后,加快到原输注速度;若复发,则停止输注,如果不良反应完全缓解,则于次日恢复输注。
如果发生下述不良反应,应永久终止达妥昔单抗β治疗:①3或4级速发过敏反应;②持续的2级周围运动神经病变;③3级周围神经病变;④3级眼毒性;⑤经液体治疗无法缓解的4级低钠血症;⑥复发性或4级CLS(需呼吸机支持)。
5.6 用药注意事项
①除非出现危及生命的情况,在开始达妥昔单抗β治疗前2周、整个用药期间、以及最后1个疗程结束后1 周内,不建议使用全身性糖皮质激素或其他有免疫抑制作用的药物,可允许局部使用含有上述成分的乳膏或吸入性药物。②在达妥昔单抗β给药前2 周,至最后1 疗程给药结束后1 周内,强烈建议不使用静脉注射人丙种免疫球蛋白(IVIG),因为IVIG会干扰达妥昔单抗β的细胞毒效应。③疫苗有通过达妥昔单抗β产生免疫刺激和罕见神经毒性的潜在风险,因此应避免在达妥昔单抗β给药期间至最后1个疗程后10周内接种疫苗。
6 结语
国外多项临床应用及关键性研究表明,采用达妥昔单抗β 治疗高危和复发/难治NB 患者,具有明确的客观疗效和明显的生存获益,获得全球多个权威指南推荐。我国在上市前也初步积累了一定的用药经验。本共识结合了达妥昔单抗β治疗高危和复发/难治NB的 Ⅰ/Ⅱ/Ⅲ 期临床研究数据以及在中国上市前的海南及天津医疗先行区的临床用药经验,对于如何规范、安全、有效地应用达妥昔单抗β提出了意见和建议,为临床医师提供用药参考。由于上市时间较短,有关达妥昔单抗β在中国患者中的最佳给药方法、剂量强度、用药终点的探索、不良反应的类型和程度以及有关防治措施等,都需要进一步密切观察和积累证据,以完善用药细节和注意事项,我们将据此对本方案及时进行更新和补充。
(袁晓军 执笔)
利益冲突声明:所有作者均声明不存在利益冲突。
协作组专家名单(按姓氏汉语拼音排序):董岿然(复旦大学附属儿科医院)、方拥军(南京医科大学附属儿童医院)、高举(四川大学华西第二医院)、顾硕(海南医学院第一附属医院)、黄东生(首都医科大学附属北京同仁医院)、蒋马伟(上海交通大学医学院附属新华医院)、李杰(天津医科大学肿瘤医院)、吕志宝(上海市儿童医院)、马晓莉(首都医科大学附属北京儿童医院)、钱晓文(复旦大学附属儿科医院)、邵静波(上海市儿童医院)、苏雁(首都医科大学附属北京儿童医院)、汤静燕(上海交通大学医学院附属上海儿童医学中心)、汪健(苏州大学附属儿童医院)、王焕民(首都医科大学附属北京儿童医院)、王金湖(浙江大学医学院附属儿童医院)、王景福(山东省肿瘤医院)、王珊(重庆医科大学附属儿童医院)、吴晔明(上海交通大学医学院附属新华医院)、袁晓军(上海交通大学医学院附属新华医院)、翟晓文(复旦大学附属儿科医院)、张伟令(首都医科大学附属北京同仁医院)、张翼鷟(中山大学肿瘤防治中心)、赵强(天津医科大学肿瘤医院)。
致谢:上海交通大学医学院附属新华医院陈霁晖博士对达妥昔单抗β 的安全性管理及具体用药方面给出的专业指导。
