BMPR-IB、BMP15、ESR、GDF9与ADAMTS1基因多态性与杜泊羊繁殖性状的关联性分析
2022-01-20孙新颖李美玉朱新远董焕声潘庆杰
孙新颖,李美玉,孙 鹏,颜 硕,朱新远,董焕声*,潘庆杰*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.山东畜牧兽医职业技术学院,山东潍坊 261061)
目前国内外对影响绵羊多胎性状的基因已有大量研究。基因是已经确定的能够影响绵羊多胎的基因。、和也相继被证实为影响绵羊多胎性状的相关基因。但在国内绵羊品种中存在并发现的高繁殖力基因突变较少。狄冉等利用PCR-SSCP技术在8个品种的山羊、绵羊中并未检测到FecXR突变。金慧慧等通过测序法与PCR-RFLP技术在绵羊与山羊中检测G7和FecGV突变情况,结果均不存在突变。王金鑫等利用PCR-RFLP技术在17个绵羊品种中检测到基因FecTT位点无突变。
杜泊羊以长势快、肉质嫩而闻名国内外,其遗传性较其他绵羊品种更稳定,在纯繁或是改良后代性状方面,都表现出优良的生产繁殖性能。然而,杜泊羊的产羔数较少、产羔率低,极大影响了其作为肉羊的经济性状。因此,寻找与杜泊羊产羔数相关的候选基因尤为重要。湖羊因其高产而举世闻名,是中国优良的绵羊品种,这些年来由湖羊生产的羊肉在中国羊肉市场占比较大。但是直到现在,湖羊多胎基因研究通常仅限于检测单个突变,关于湖羊其他基因位点多态性的信息很少。因此,开展绵羊多羔性状相关基因的研究,对比高繁殖力与低繁殖力羊品种突变位点多态性异同对于揭示绵羊高繁殖力的机制、利用分子标记辅助选择来迅速提高杜泊羊等产羔数少的绵羊种类的繁殖性能具有重要意义。
1 材料与方法
1.1 实验动物 本实验所用60只黑头杜泊羊均来自山东省潍坊市某种羊场;47只湖羊均来自山东省聊城市某种羊场,杜泊羊与湖羊分别处于同一饲养环境,健康状况良好。用75%酒精棉球将杜泊羊耳缘表面彻底消毒,称取耳组织10 g,放入装有无水乙醇的2 mL离心管中,标好序号,并与羊耳号一一对应;带回实验室放置-20℃保存。湖羊与杜泊羊产仔记录参照各羊场中产仔数记录,统计母羊每胎平均产羔数。
1.2 实验试剂和仪器 组织基因组DNA提取试剂盒(天根);DL2000 DNA Marker、2×Pro Taq预混液(含染料)由TaKaRa公司提供;核酸染料(生工);恒温摇床;离心机;电泳仪。
1.3 实验方法
1.3.1 引物设计与合成 根据所研究的基因位点上下游约200 bp序列设计引物,引物由北京擎科生物科技有限公司合成,引物序列见表1。

表1 引物序列信息
1.3.2 PCR扩增 PCR扩增以绵羊基因组DNA为模板。PCR反应体系20 µL:PCR预混液10 µL,上下游引物(10 mol/L)各0.5 µL,DNA模板为1 µL,Rnase free HO为8 µL。PCR反应条件:94℃预变性30 s,98℃变性10 s,退火30 s,72℃延伸1 min,共25个循环;72℃最终延伸2 min;4℃保存。PCR产物用1%琼脂糖凝胶电泳检测。
1.3.3 蛋白质结构预测 利用DNAStar软件中的EditSeq翻译测序得到的基因序列,使用protean预测蛋白质的二级结构。
1.3.4 遗传变异分析 统计基因频率、基因型频率、Hardy-Weinberg平衡,并分析群体纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)。
1.3.5 基因位点多态性与绵产羔数关联性分析 利用GraphPad Prism 6软件将杜泊羊基因位点多态性与产羔数之间进行关联性分析,结果以“平均值±标准误”表示,以<0.05为差异显著性判断标准。
2 结果分析
2.1 DNA检测结果 绵羊基因组DNA的琼脂糖凝胶电泳条带清晰且明亮,如图1所示。利用核酸蛋白仪检测DNA浓度,A260/A280比值在1.8~2.0区间内。DNA质量与浓度均符合后续实验的要求。稀释DNA使DNA范围处于30~60 µg/mL。
“哼哼叽叽”、“唱唱咧咧”这两个词中的“哼”和“唱”是可以单独成词的,而“叽”和“咧”不可以。重叠后也是一样,AA式“哼哼”和“唱唱”是可以独立使用的,而BB式“叽叽”和“咧咧”一般不能单独使用。但“叽叽”作为叠音词时改变声调,音为“jìji”时变成动词是可以单独成词的,当然,这种情况是比较少见的。
图1 绵羊基因组DNA质量检测结果
2.2 PCR产物检测结果基因PCR产物经1%琼脂糖凝胶电泳检测,分别在343、358 bp处有清晰明亮的条带;基因PCR产物经1%琼脂糖凝胶电泳检测,在421 bp处有清晰条带;基因PCR产物经1%琼脂糖凝胶电泳检测,分别在167、516 bp处有清晰条带;基因PCR产物经1%琼脂糖凝胶电泳检测,分别在354、361 bp处有清晰条带;基因PCR产物经1%琼脂糖凝胶电泳检测,分别在208、496 bp处有清晰条带。以上所有条带均与预期片段大小一致。
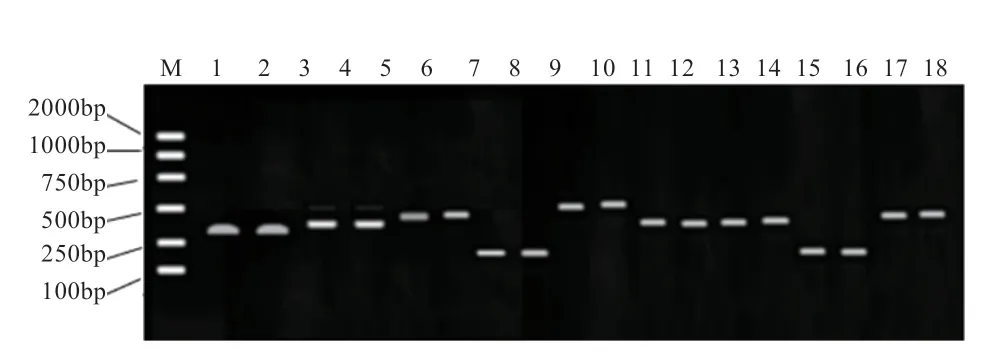
图2 PCR扩增产物
2.3基因测序结果 由图3可知,基因RS42 8438934位点处发生T→C的突变,此突变为错义突变,导致了氨基酸改变。
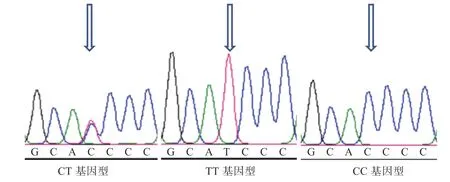
图3 ESR2基因测序结果
2.4基因蛋白质二级结构预测基因RS4284 38934位点TT与CT、CC与CT基因型序列的蛋白质二级结构比对结果如图4所示,TT基因型氨基酸序列与CT基因型相比较发现:在区域和区域分别缺少一个氨基酸,且在两性区上氨基酸存在部分缺失情况,位于蛋白质表面的可能性和抗原决定簇比例也不同。CC基因型氨基酸序列与CT基因型氨基酸序列相比在两性区上存在较大不同,且在区域也存在着差异。TT、CC与CT相比较来说,TT、CC都在氨基酸位置5~10区间内缺少螺旋结构。综上,TT与CT、CC与CT基因型的蛋白质二级结构比较差异均较大。

图4 ESR2基因CT、TT与CC基因型的蛋白质二级结构比对
2.5 遗传多态性分析 2个绵羊群体、、、、基因多态位点基因型频率、基因频率结果见表2。由表2可知,实验所研究的基因中的RS603752979位点在杜泊羊与湖羊中均呈现1种相同的基因型GG,无突变类型,处于平衡状态。RS418841713在杜泊羊中存在2种基因型GG、AA,在湖羊中存在AA、GG、GA3种基因型,均处于不平衡状态。RS398521635、RS402413016、G7、G8、RS417060437、RS604746425在杜泊羊与湖羊中均只有1种基因型,无突变类型,处于Hardy-Weinberg平衡状态。RS428438934在杜泊羊中存在3种基因型CC、TT、CT,处于不平衡状态。
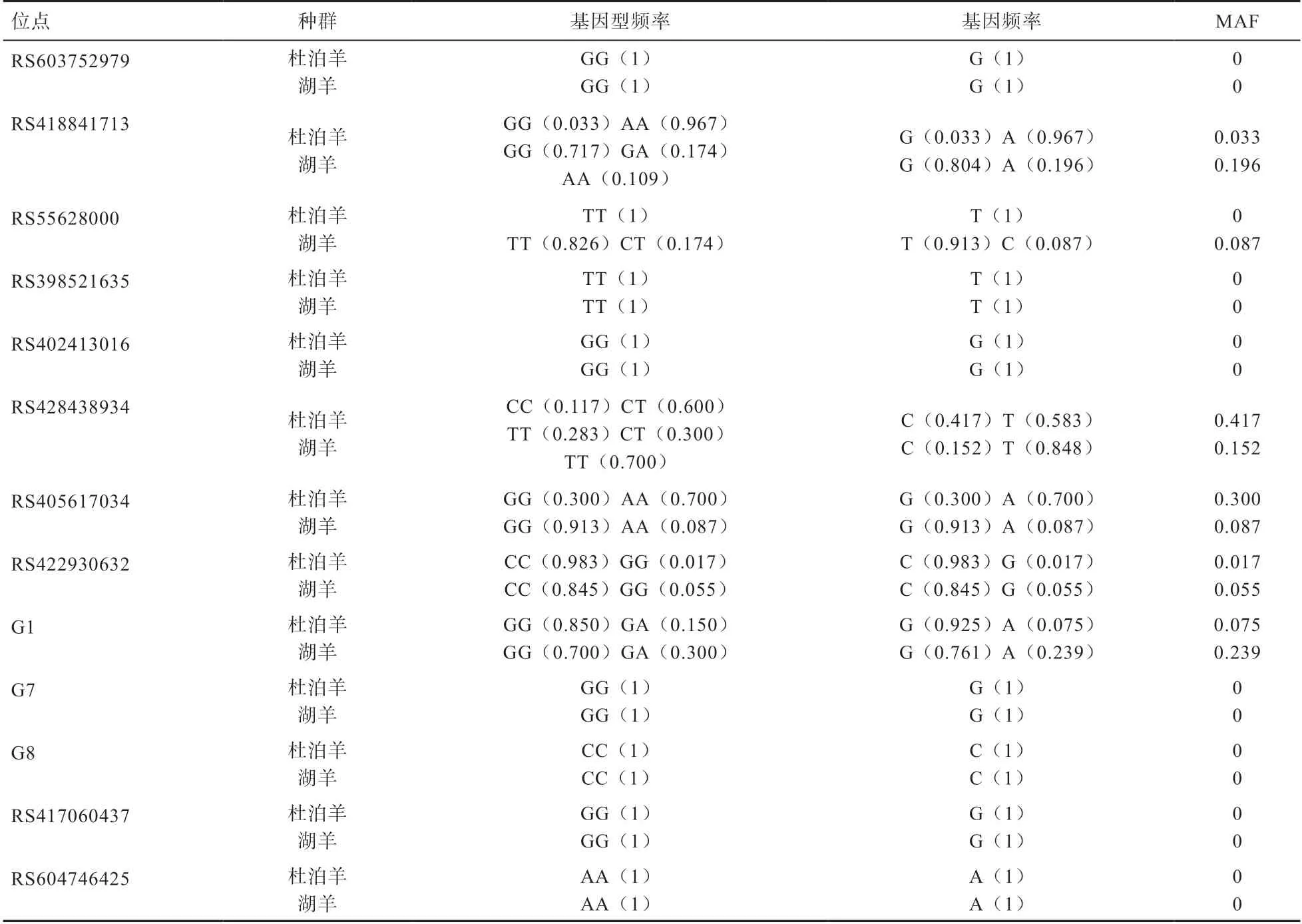
表2 绵羊群体BMPR-IB、BMP15、GDF9、ESR2、ADAMTS1基因位点基因型频率、等位基因频率、MAF
2.6 绵羊群体遗传变异分析结果 由表3可知,不同基因不同群体的遗传Ho均较高,湖羊群体中、基因中的位点均为中度多态(0.25<PIC<0.5);在杜泊绵羊群体中,RS418841713、RS422930632、G1为低度多态(PIC<0.25),RS428438934、RS405617034为中度多态(0.25<PIC<0.5)。
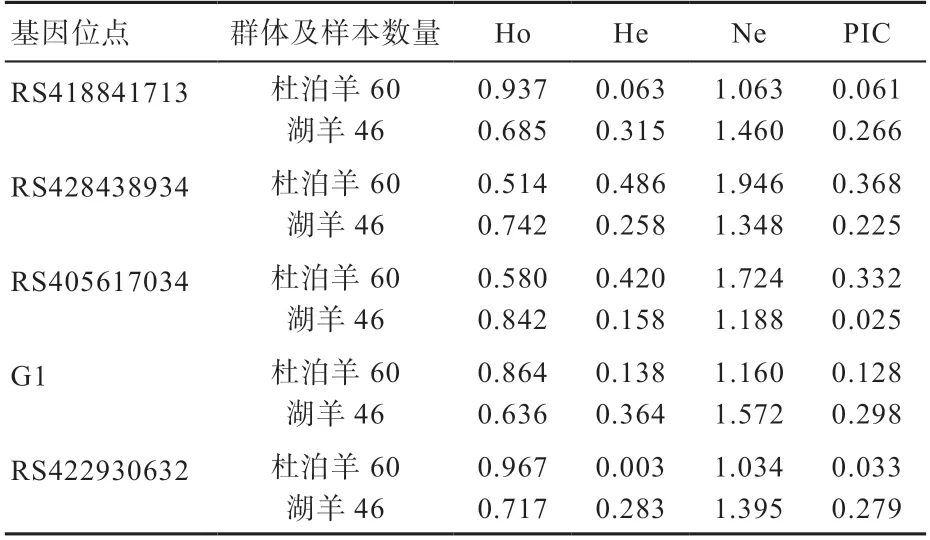
表3 绵羊群体不同位点遗传变异分析
2.7不同基因型与绵羊产羔数相关性分析 由表4可知,杜泊羊基因3种基因型群体的平均产羔数分别为1.408、1.015、1.336只,CC与CT、TT与CT基因型之间产羔数相比差异显著。湖羊基因2种基因型群体的平均产羔数分别为2.041、2.035只,TT与CT基因型之间产羔数相比差异不显著。
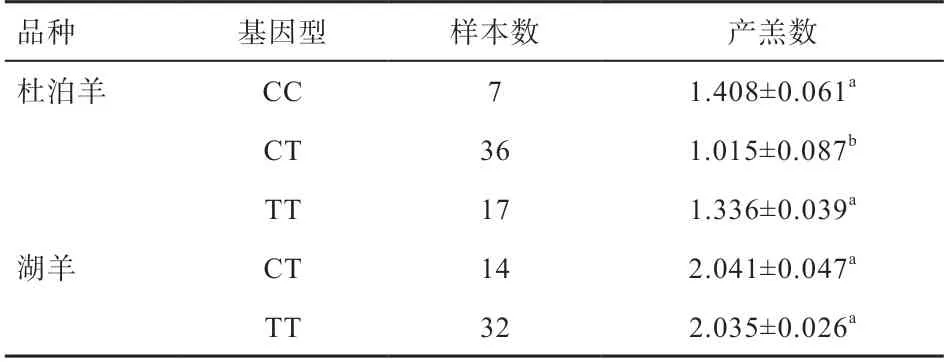
表4 ESR2基因不同基因型与产羔数相关性分析
3 讨 论
目前研究发现在新吉细毛羊、小尾寒羊、蒙古羊以及甘肃现代肉羊群体中基因存在与多胎性状相关的突变位点。前人研究发现,RS599417043、RS109219782、RS402413016和RS398 521635位点在小尾寒羊、滩寒杂交羊、杜泊羊和滩羊群体中都分别只有一种相同的基因型且处于哈代-温伯格平衡状态,这与本实验结果一致。本实验在黑头杜泊羊与湖羊群体中均未检测到相应位置上的位点具有多态性,说明这4个位点不是影响杜泊羊与湖羊产羔数差异的原因,由此推测并不是影响杜泊羊与湖羊群体多胎性状的主效基因。
基因和基因属于同一个家族,其在卵泡的生长分化过程中发挥极为重要的作用。研究发现,在Cambridge羊中存在G8突变,此突变与Cambridge羊和Belclare高排卵数(突变杂合体)和不育(纯合体)都密切相关。刘永斌等蒙古羊群体中未检测到G8位点具有多态性。金慧慧等通过测序法与RFLP-PCR在绵羊与山羊中检测G7和FecGV突变情况,结果均不存在突变。此结果与本实验结果一致,本实验结果显示G7在杜泊羊与湖羊中都只有1种基因型。
是卵母细胞中的一种转化生长因子,是与绵羊多胎性状相关的主效基因。FecB就是基因突变导致第249位置上的谷氨酸突变成精氨酸的结果。本实验在杜泊羊与湖羊中均未检测到相应位置上的多态性位点,这与张坤研究结果一致。RS418841713位点在杜泊羊中无突变情况,只有AA 1种基因型,但是在湖羊中具有GG、GA、AA 3种基因型,处于不平衡状态,猜测原因可能是样本数量较少所致。
虽然研究较其他基因时间较晚但受到越来越多的关注。何小龙等在单羔与双羔蒙古羊的卵巢中发现存在表达差异推测基因可能是影响蒙古羊多胎性状的基因。蔡倩方等发现排卵时在卵巢颗粒细胞层中的转录活性显著增强,而孕激素受体基因敲除小鼠卵巢局部后表达显著下降,有明显的排卵障碍。本实验研究结果显示在杜泊羊与湖羊中只存在1种基因型,显示位于外显子2与外显子8上的位点并不是影响杜泊羊与湖羊多胎的位点。且乌吉斯古楞研究也证实在蒙古羊中基因外显子3的位点不是影响产羔性状的主效基因。
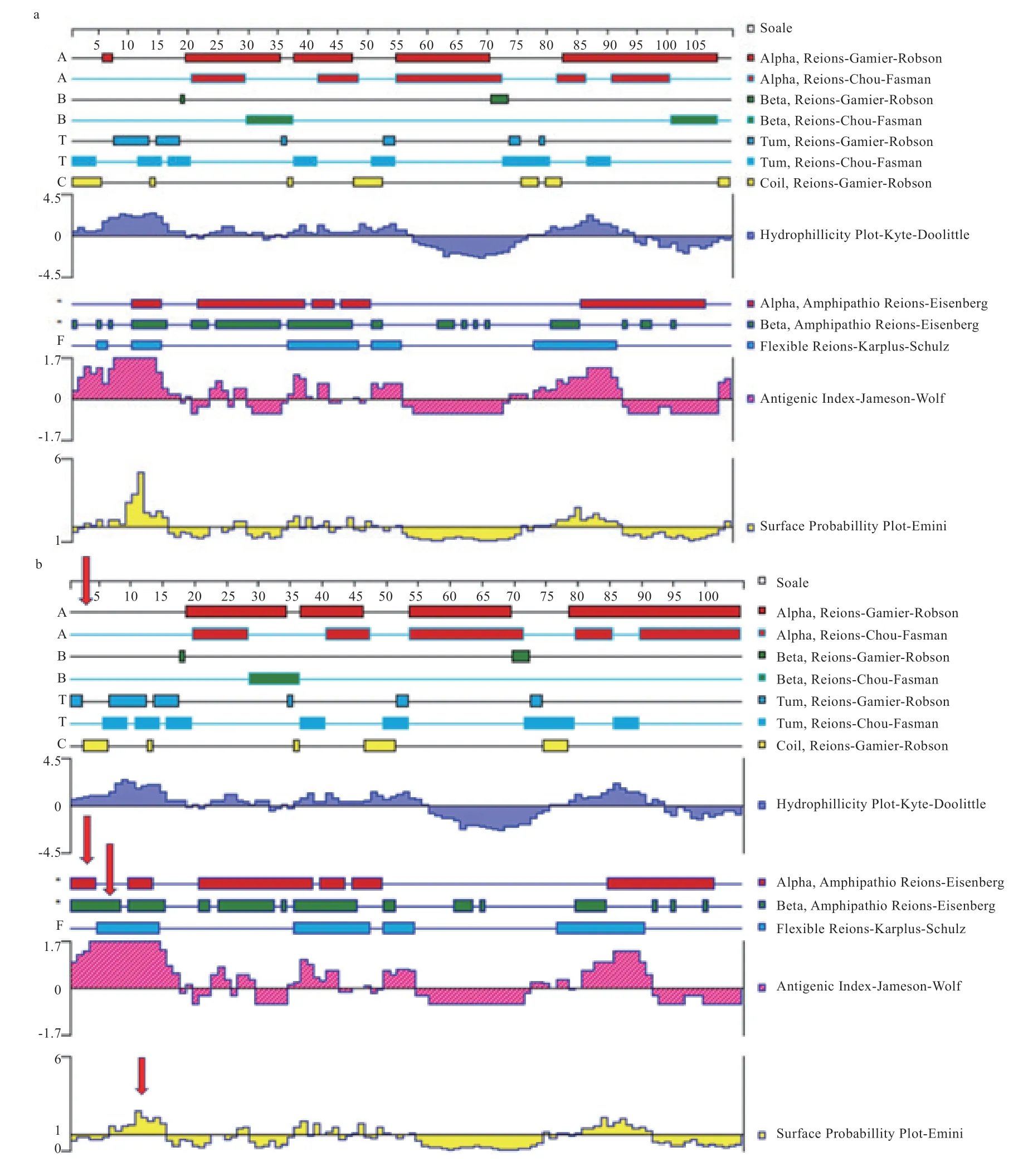
ESR在生殖生物学中起着重要作用。研究表明在鲁中肉羊品种选育中基因g.73324006C>T位点具有可靠的标记作用。储明星等利用PCR-SSCP技术研究表明基因可能是控制小尾寒羊多胎性状的主效基因之一。张坤发现RS405617034、RS428438934位点具有多态性,RS405617034、RS428438934在小尾寒羊、滩寒羊和杜泊羊中突变极显著高于滩羊。以上研究结果说明基因中位点与多胎性状密切相关。本研究发现在杜泊羊中在RS428438934位点处存在的TT、CT、CC 3种基因型相对应的产羔数分别是1.336、1.015、1.408,CC基因型比CT基因型平均产羔数多0.393只,TT基因型比CT基因型平均产羔数多0.321只。CC与CT、TT与CT基因型之间产羔数相比差异显著。另外RS428438934位点在杜泊羊与湖羊中相同位置都出现了TT、CT基因型,但发现只有在杜泊羊中出现CC基因型,猜测此位点或许是影响杜泊羊多胎的原因。在对突变序列的蛋白质二级的预测中,发现RS428438934位点CC与CT之间、TT与CT之间,RS405617034位点AA与GG基因型之间的二级结构均存在差异。这进一步说明这2个突变位点存在着一定的生物学意义。
4 结 论
本实验利用测序法对60只黑头杜泊羊进行位点多态性检测,以46只湖羊做对照,研究发现:
1)RS428438934位点处CC与CT、TT与CT基因型之间产羔数相比差异显著,可以作为杜泊羊多胎标记位点。
2)RS405617034位点处AA与GG基因型之间产羔数相比无显著差异,不能作为杜泊羊多胎标记位点。
3)RS603752979、RS402413016、RS418841713、RS417060437、RS422930632、RS604746425、RS55628000、RS398521635、G1、G7、G8并不能作为杜泊羊多胎标记位点。
