“微观繁殖体”溯源*
2022-01-19沈颂东
沈颂东
“微观繁殖体”溯源*
沈颂东
(苏州大学细胞生物学系 江苏苏州 215123)
通过查阅“微观繁殖体”相关文献, 对其概念进行溯源追踪并据以总结归纳。笔者认为“微观繁殖体”这个概念不应该作为放散的孢子、配子、合子、不同生长阶段的显微个体及有生长能力的大型海藻碎片的统称, 而应只是泛指那些肉眼不可见的只进行营养繁殖的二倍体细胞团、脱落下来的组织块和“色素体”(有色藻段)等碎片, 即是一个或者多个二倍体的藻类细胞。并以石莼属绿藻浒苔()为例, 简述浒苔微观繁殖体在其生活史中的主要作用, 为浒苔“微观繁殖体”的理论研究和实际利用奠定基础。
种子库; 微观繁殖体; 绿潮; 浒苔; 生活史; 营养繁殖
1 微观繁殖体的定义
就群落生态学而言, “土壤种子库(soil seed bank)”是指存在于土壤表层凋谢物和土壤中全部活性种子的总和, 其概念的形成与发展主要基于不同的陆地植物研究成果(Hodáňová, 1981; Leck, 1989)。与此同时, 学者们也开始关注藻类植物中的“种子库(微观形态库bank of microscopic forms)”。Hoffmann (1987)和Santelices (1990)认为“种子库”可能是起源于作为“种子雨”到达地下的种子, 而“微观形态库”可能是起源于“孢子雨”。
早在1918年, Spence (1918)就曾报道, 在奥克尼群岛(Orkney Islands), 冬季(绿僵菌)的叶状体就会被从海面吹到岸上, 借风着陆在岛上的“铃铛状藻体(bell)”会牢牢地附着在岛面上, 进而留在岛上。这些被风吹散后留在岛上生长的叶状体碎片, 可能是目前我们所能找到的有关藻体的“微观繁殖体”的最早报道。
此后直到二十世纪五十年代, 学者们才开始对藻体微观繁殖体开展更为细致的研究。Burrows (1958)首先发现了藻体有大量肉眼不可见的、无法识别物种的微观阶段。1956年9月, 他从曼岛艾琳港采集到了6块小石头(每块小石头上仅可见一两种植株), 并将上面的(糖海带)剪至约3 cm后放入海水培养基中继续培养。糖海带经过一个冬天后长至25~30 cm, 并且数量庞大、无法计数。不仅如此, 到1957年4月时, 另有11个可被鉴别出物种的孢子在糖海带的枝节及石头表面附着。这表明藻种存在着大量的肉眼无法观测到的微观阶段, 并可据以越冬。他猜测这是第二年海藻生物量快速增长的来源之一。
Chapman (1987)的实验进一步为“藻体的微观形态能为第二年海藻生物量的快速增长提供来源”这一说法提供了佐证。他将陶瓷片放置在海藻森林(kelp forest)中, 在流动的海水和高光照条件下, 微观藻体附着在陶瓷片上, 并长到了肉眼可见的尺寸, 通过计数, 估测每年在微底栖动物中沉降的孢子会发展出近6×106个微观形态。由此, 在1986年他首次创造了术语“bank of microscopic forms”即微观形态库, 用于描述在适当环境条件下大型海洋藻类生长的微观阶段, 类似于陆地植物的“seed bank”即种子库。在许多藻类物种中, 从孢子产生的高峰期到可检测到幼苗出现之间会经过一段时间, 这种滞后通常与气候条件有关。在这段滞后期中, 藻种迫于宏观的生存压力, 通常会选择通过能够作为越冬阶段的微观发育阶段存活下来。在陆地植物中, 这一阶段通常是由休眠在土壤中的种子来完成的, 由此构成陆地植物的“种子库”; 据此, 他认为藻类的微观形态库应主要包括沉降的孢子(settled spores)以及其他微观形式存在的碎片。通过进一步将微观形态库与陆地植物的种子库进行比较, Hoffmann等(1991)在Chapman的基础上认可藻体的微观形态库可能为藻种提供更大的物种存活率的观点。然而他认为微观形态库主要是由于沉降的孢子萌发而产生的。虽然这种方式能够帮助它们度过恶劣的环境, 但易受到细菌或真菌侵袭而损失, 不如休眠种子生存能力强。到2001年, Worm等(2001)通过操纵食草动物和繁殖体库的存在以及营养供应完成一个析因现场实验, 监测了藻类补充和成年藻株的生长过程。他还在整个波罗的海进行了大规模实地调查, 量化了大型藻类的丰度和补充模式, 据以支持Chapman对微观形态库的定义。
“Micropropagule”即“微观繁殖体”这一说法首先由Dawes等(1991)针对红藻门的长心卡帕藻()提出, 即藻体的部分愈伤组织、能够转化并产生大量的球形或椭圆形细胞并最终发育成藻体的的微小细胞或组织块(外植体)等。
Clayton (1992)首次提出利用生殖方式的区别来对藻体繁殖体(propagules)进行区别定义。他认为大型海洋绿藻的繁殖体主要包括有性或无性生殖过程中产生的单细胞产物, 如合子、单性配子和减数分裂以及有丝分裂形成的孢子等(包含被质膜包裹的裸细胞, 以及在某些物种中还覆盖有一层黏液), 但其他种类的繁殖体(包括一些较小或较大的藻体片段以及高度分化的多细胞营养繁殖体等)都不考虑其中。Reed等(1997)和Kamermans等(1998)也认为应该将藻体的有性繁殖体与用于度过逆境的休眠微观繁殖体区分开来, 但他们与Clayton对微观繁殖体的定义却恰恰相反; Reed等(1997)还认为, 藻体的大面积定殖, 要么是由于在藻体生活环境受扰动后繁殖体(propagules)的大规模扩散和迁移, 要么是由于在扰动过程中存活下来的处于微观休眠阶段(microscopic stages)藻体的广泛补充。而Kamermans等(1998)发现, 在Veerse Meer lagoon(韦瑟米尔泻湖)石莼属藻株的有性生殖几乎可以忽略不计时, 埋藏在沉淀物中藻体仍然能够在黑暗中度过寒冷的冬天, 这可能是在第二年春天观察到的石莼生物量快速增加的原因——基于营养片段的再生。
通过对潮汐池塘中石头上的一排微观形态的研究, Santelices等(1995)认为藻类的微观形式(microscopic forms)可能包括以下几种组分: 其中一个组成部分包括可在宏观藻种栖息地中发生的多年生的微观阶段; 第二部分是与发育阶段所对应的(如繁殖体, 细丝等); 第三组分是由新萌发的直接发育的藻类的繁殖体组成; 第四种组分是如硅藻的单细胞藻类。这种多样性可能是由于潮汐池塘水的多变所导致。
Schories (1995)则表示成体植物或植物碎片的越冬是保证植株下一季大量发育的常见过程。他通过进一步对浒苔孢子抗逆特性等方面的研究, 认为浒苔第二年发育的情况可能主要取决于藻体孢子的越冬能力。Lotze等(1999)在此基础上进一步研究了孢子萌发的环境条件及萌发时间。Santelices等(2002)的研究也提出能够忍受黑暗和极低的辐射条件的藻体孢子才是该藻种的微观形态的繁殖体。在自然海水环境下, 处于显微阶段的这些繁殖体可以在海水中自由漂浮, 形成一个庞大的天然微观繁殖体库。在适宜的温度、光照条件下, 这个繁殖体库就会迅速的生长增殖, 从而为来年的快速增殖提供基础。
直到2003年, Reddy等(2003)的研究才继续采用了Dawes提出“微观繁殖体”这一描述方式, 并进一步通过实验证明了藻段区域的微小切块(microcuttings of thallus segments)以及可以发育成完整藻体的愈伤组织/体细胞胚可以作为维持和繁殖种子库的一种手段。Gao等(2010)发现石莼属海藻浒苔的藻体的微小切块可以有效地发育为孢子囊, 且主要集中在断口处; 进一步研究还发现浒苔微小切块的面积与孢子囊的形成以及成熟孢子的释放和萌发关系密切, 表现为微小切块越大, 形成孢子囊的面积越小, 但是释放的孢子成熟度高, 易于附着萌发形成新的藻体; 浒苔片段越小, 形成孢子囊的面积越大, 但是释放的孢子质量较差。Zhang等(2010)的实验表明, 数以百万计的体细胞, 包括在胁迫条件下培养的细胞, 也能够在适当的条件下再生成新的植株。因此, 体细胞也是大型藻类的生存机制之一。在生物学层面上, 对大型藻类尤其浒苔断口处的体细胞易发育为孢子囊的机制也进行了阐述, 认为与高等植物伤口处易脱分化形成愈伤组织类似, 浒苔断口处通过形成孢子囊来实现新个体的产生, 二者均是通过形成易于发育为新个体的方式来响应机械损伤这种非生物胁迫; 由此推断, 在自然海域中动物滤食和螺旋桨等生物和非生物因素产生众多的藻类微小碎片, 这类碎片的伤口细胞相对较多, 由此发育为孢子囊的比例也相应增加(王广策等, 2016)。由此可见, 体细胞微小切块的埋藏和冬季存活也可以用来解释浒苔生物量在春季快速增加的原因。
然而, 近年来, 国内的藻类学家又普遍认为海藻的微观形态库应不区分其来源, 即不论是生殖细胞还是营养细胞碎片, 只要能生长成大的藻体, 都将其称为微观繁殖体。邹定辉等(2004)提出海藻繁殖体库是由多种微小形态所组成。除了有性繁殖过程中产生的配子、合子(胚)等可作为其重要组分外, 集落的孢子或其他在环境条件不利时暂停生长的微小形体等也是繁殖体库的重要组成成分。Liu等(2012)赞同邹定辉的看法, 认为微观繁殖体(microscopic propagules)是潮间大型藻类应对恶劣条件的主要生存阶段, 提出繁殖体的定义应包含配子、孢子、合子、显微的幼苗以及营养碎片等。通过在实验室条件下研究温度对微观繁殖体(micro-propagules)萌发的影响, Song等(2015)发现海水温度对绿藻微观繁殖体的萌发起着重要作用, 并可能据此解释苏北浅滩定生绿藻的群落演替的缘由——不同种的绿藻微观繁殖体在不同的海水温度下萌发。她认为绿藻微观繁殖体(micropropagules)这一概念是指放散的孢子、配子、合子以及不同生长阶段显微个体的总称。微观繁殖体不是绿藻生活史中的一个阶段, 而是一个类似于高等植物种子库的生物学概念。在自然海水环境条件尤其是温度条件适宜的情况下, 微观繁殖体会依附在适合的附着基上生长发育, 进一步生长萌发成幼苗。通过对秦皇岛近岸和近海区域中微观繁殖体的时空分布格局和生物量变化的调查, 发现受绿潮影响的区域表现出非常高的微观繁殖体丰度, Han等(2019)认为包括有配子、孢子、微繁殖体micro-germlings和微观营养体碎片的绿藻微观繁殖体(micro-propagules)是绿潮的“种子”来源。然而, 与赤潮微藻(甲藻和硅藻等)形成的厚壁孢子不同, 绿藻的孢子和配子没有细胞壁, 实际上是“裸露”的原生质体, 存活的时间非常有限, 很难想象这种“裸露”的原生质体在自然海域中可以越冬度夏。
综上, 对于藻体用于越冬或应对其他恶劣环境的“微观繁殖体”的概念主要有以下三种观点: (1) 以Hoffmann、Clayton、Schories Dirk、Lotze、Santelices为代表的藻类学家认为是由有性或无性过程中的单细胞产物如合子、雌雄配子和由减数分裂或有丝分裂形成的孢子组成, 这种观点可据倍性被总结为N; (2) 以Dawes、Reed、Kamermans、Reddy、王广策、高山、张晓雯为代表的藻类学家认为微观繁殖体是指那些除孢子配子以外的具有生长能力并能够发育成完整植株的二倍体细胞或营养细胞碎片或藻段, 包括藻体组织块等, 这种观点可据倍性总结为2N; (3) 而以Champan、Worm、邹定辉、刘峰、宋伟、韩红宾为代表的藻类学家则认为应将藻的所有微观形态统称为“微观繁殖体”, 包括藻的生殖细胞以及其他各种微观形式碎片, 这种观点可据倍性总结为N+2N。笔者认为第一种观点中主要是描述藻体“繁殖体(propagules)”的概念, 且已经有诸如“孢子”“配子”“合子”等这些专门的术语来更加细化表示, 不必再冠以“微观繁殖体”加以混淆; 而第三种观点中, 少数藻类学家将藻类在有性生殖过程中的减数分裂孢子及配子这些“繁殖体”的概念和营养繁殖过程中产生的二倍体的“微观繁殖体”的观念不加区分地相互混淆, 并在以往的研究对这些肉眼不可见的藻体的微观形态有多种多样的描述定义——“bank of microscopic forms”、“microscopic stages”、“microscopic forms”、 “microscopic propagules”、“micropropagules”等, 不利于学者理解。此外, 根据Spence (1918)最早在1918年提出的藻体的叶状体(碎片)可附着在岛上继续生长发育, 由此开始出现藻类“微观繁殖体(micropropagules)”概念的雏形。因此, 笔者更倾向于认同第二种观点, 即“微观繁殖体(micropropagules)”应该是泛指那些只进行营养繁殖的二倍体细胞团、脱落下的组织块、单细胞等绿藻碎片, 是藻体用于度过逆境环境的微观形态。
2 微观繁殖体在绿潮浒苔生活史中的作用
近些年来, 随着黄海绿潮的持续性暴发, “微观繁殖体”这个术语逐渐被用于各项有关浒苔的研究中(方松等, 2012; Song, 2015; Huo, 2016; Han, 2019; 缪晓翔等, 2020)。同时在许多藻类的生活史中, “微观繁殖体”在“越冬和度夏”过程中起着种子库的作用, 帮助它们度过恶劣的环境, 待到环境适宜时再重新生长出来。
微观繁殖体在藻类生活史循环过程中的影响不容小觑(Hiraoka, 2010)。因此, 对藻类微观繁殖体层面的进一步研究对完善该藻生活史循环具有重要意义。就以浒苔为例, 一般认为其生活史主要包括两个阶段: 二倍的孢子体世代和单倍的配子体世代, 属于同型世代交替。雄或雌配子体(n)成熟后能够自然放散出顶生两鞭毛的雌雄配子(n), 雌雄配子融合后形成合子(2n)能够进一步发育成孢子体(2n), 属于有性生殖生活史阶段; 小部分不与异性配子融合的配子能够单独发育成配子体(n), 属于单性生殖生活史阶段; 孢子体(2n)成熟后形成的孢子囊可以经减数分裂形成顶生四鞭毛的游孢子(n)并发育成配子体(n); 部分孢子囊可不经过减数分裂, 释放的游孢子(2n)能够直接再发育成孢子体(2n), 属于无性生殖生活史阶段; 还有一部分孢子体细胞(2n)通过不断的有丝分裂, 却不产生任何生殖细胞进行发育进入营养繁殖阶段(图1)(王晓坤等, 2007; 王浩东, 2012)。由此可见, 绿潮浒苔的整个生活史循环过程包括肉眼可见的宏观藻体阶段以及肉眼不可见需借助显微镜观察的藻体微观繁殖体和繁殖体阶段。浒苔宏观个体可以产生两种繁殖细胞, 一种用于倍性转换, 另一种则用于个体的自我补充。前者包括由孢子体产生的减数孢子和由配子体产生的配子; 后者则包括由孢子体产生的中性孢子和由配子体产生的类孢子(一些文献中将其描述为具负趋光性的“配子”)。减数孢子虽然是源自浒苔细胞的减数分裂, 但其只完成了第一次减数分裂, 第二次减数分裂尚未开始, 所以其染色体倍性仍为二倍(王广策等, 2020)。
我们可以通过对漂浮在海面上的宏观藻体进行随机取样进而估算整个黄海绿潮藻的生物量, 但此举忽视掉了海水中肉眼不可见的藻体微观繁殖体和繁殖体阶段, 且这些阶段可能无法通过随机取样来准确估算定量。刘峰等(2010)将在海水中采集的浒苔藻体的繁殖体和微观繁殖体样培养成肉眼可见的藻体幼苗, 并通过对幼苗的定量分析从而估算出水体中绿潮浒苔的显微阶段个体数, 研究为预测海水中潜在绿潮海藻生物量和预测绿潮暴发规模方面提供了有利方法。
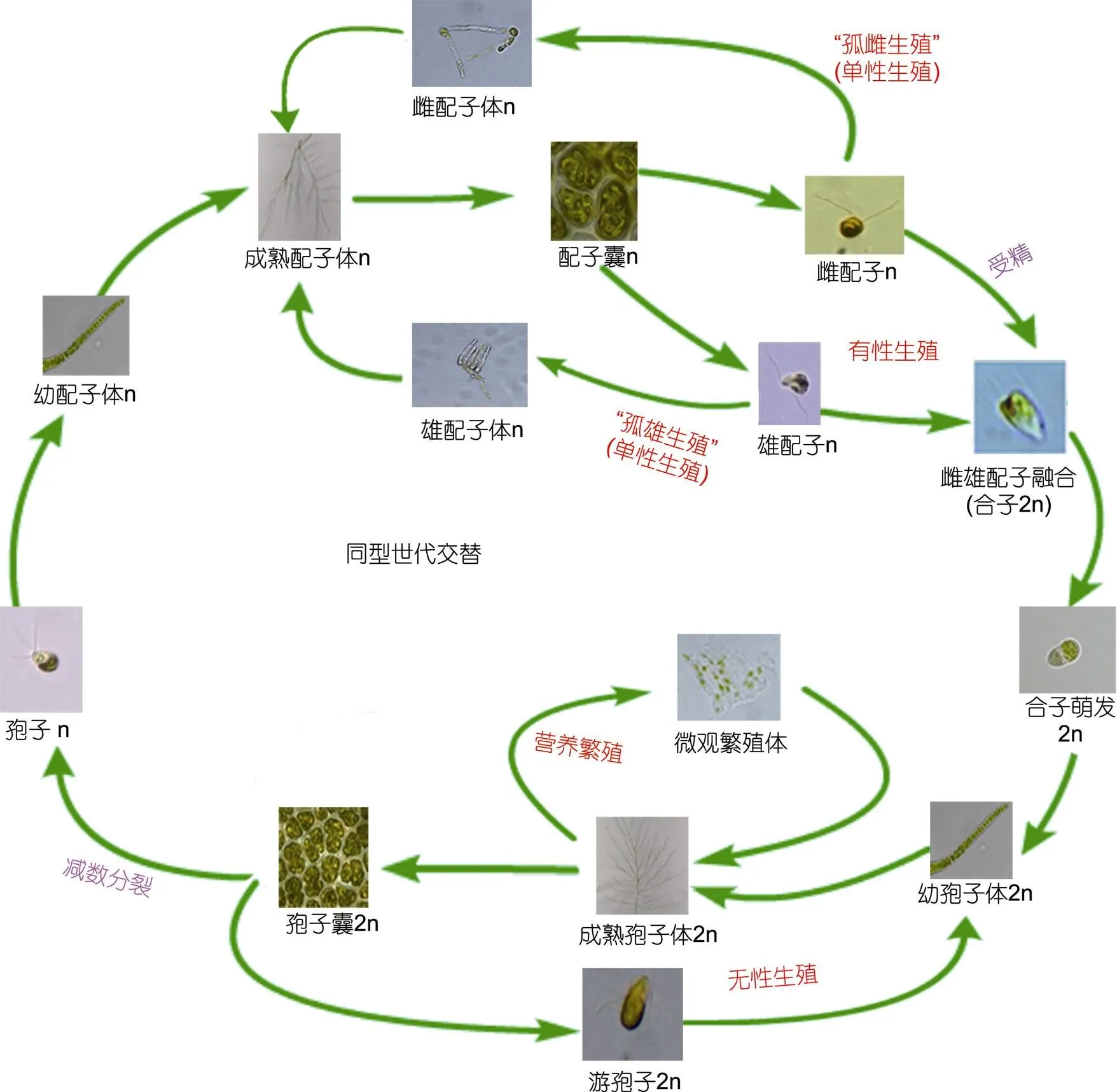
图1 浒苔生活史
注: 图片引用自敖愿(2020)
此外, 微观繁殖体也对藻体生长发育及繁殖过程有重要影响。Worm等(2001)通过在波罗的海沿岸对大型藻类在不同影响条件(生物因素、腹足类草食动物、营养盐、繁殖体库)下的生长实验进行分析, 结果认为繁殖体库的存在对于具有快速生长增殖能力的藻体的种群生物量具有显著的影响, 而且对藻体的“保种越冬”具有重要意义。方松等(2012)对微观繁殖体的时空分布展开调查并进一步对其进行来源分析, 认为绿藻的微观繁殖体和早期漂浮藻体的最早起源存在一定联系。但其认为绿藻繁殖体是放散的孢子、配子、合子以及不同生长阶段显微个体的统称。研究表明在外界自然环境条件适宜时, 微观繁殖体能够附着在附着基上, 萌发形成幼苗。此外, 刘湘庆等(2015)还探讨了实验室条件下的环境温度对微观繁殖体生长萌发的影响, 研究表明如东紫菜养殖区沉积物中始终存在绿藻微观繁殖体, 这些沉积物使得绿藻繁殖体得以度过寒冷冬季, 在次年温度适宜时, 这些微小的绿藻繁殖体便在养殖设施上附着萌发生长, 为进一步追溯黄海绿潮浒苔的溯源提供理论基础。Miao等(2018)分析了自2016年至2017年为期一年的青岛近海岸微观繁殖体的丰度和物种组合, 揭示了青岛沿海微观繁殖体群落的年际变化, 且微观繁殖体的丰度表现出明显的季节变化。并通过分析遥感数据, 发现当夏季大规模绿潮接近青岛海岸时, 微观繁殖体的物种组成发生了显著变化, 据以说明漂浮浒苔生物量与微观繁殖体群落波动之间的关系。Gao等(2010)的研究发现由于掠食者的掠食作用以及海浪、螺旋桨等多种因素产生的绿潮藻浒苔的二倍体碎片(微观繁殖体)极易产生孢子囊释放孢子并进一步发育成植株, 由此认为这些藻体碎片(微观繁殖体)可能与绿藻生物量的快速大量积累有关。张华伟等(2011)也认为漂浮浒苔能够依托微观繁殖体的强大繁殖力大量萌发使藻体的生物量在短时间内大量增加, 成为绿潮暴发的主要原因之一。由于当前方法及手段的限制, 目前对于微观繁殖体的研究大都将繁殖体和微观繁殖体混淆在一起, 实际是对整个微观形态库进行的生理生态等方面的研究。因此, 利用明确的定义将孢子、配子、合子等这些藻类“繁殖体”与二倍体碎片“微观繁殖体”区分开, 并进一步分析细化他们在生活史循环中的职能, 或许能够为绿潮爆发的起源及预测提供更坚实有力的证据。
3 展望
杜宇(2019)通过对2017年至2018年绿藻世代交替的年际变化分析发现, 当表层海水温度低于10 °C时, 绿藻的孢子体世代相对配子体世代占主要优势。且盐度变化对其世代交替变化的影响不明显, 这与Miao等(2018)的研究结果相符。此外, 研究表明黄海绿潮浒苔在暴发时期(6~7月), 孢子体世代相对配子体世代占主要优势(Zhao, 2019; 敖愿, 2020)。王广策等(2020)表示钩虾等能够啃食藻体使其碎片化, 这些或沉降在海底或漂浮在海水中的海藻碎片能够进一步生长发育成为绿潮的“种源”。已有很多研究表明, 藻体能利用微观繁殖体(藻体的微观形态)来“越冬”、“度夏”, 而根据杜宇和敖愿的研究我们可知, 石莼属绿潮在冬(海水表面温度低于10 °C)、夏(绿潮浒苔暴发时期)均是二倍孢子体占优势。且微观繁殖体的出现与否具有季节性。春季到初夏达最高, 秋季为次高峰, 其他季节丰度较低(Miao, 2018)。因此我们认为这些由于钩虾的“啃食”或是海水的冲击作用等从藻体上脱落下来的孢子体(二倍体)碎片为微观繁殖体, 藻体可借此度过恶劣(高温、低温)环境。但是这些微观繁殖体更倾向于哪种何种生殖方式(是藻细胞可直接原位萌发进行营养繁殖还是由破碎处的细胞变成孢子囊释放孢子进入生活史循环)来发育成来年大的藻体仍需要进一步的研究。
随着近年来黄海绿潮的持续性暴发, 学者们对于绿潮浒苔越来越重视, 研究也随之增多。而对于绿潮浒苔的源头主要有以下几个观点: 第一个观点认为黄海漂浮浒苔起源于黄海南部的一些沿岸动物养殖池塘, 养殖产业肥料的使用给绿潮浒苔的快速增殖提供了物质条件(Liu, 2010; Pang, 2010); 第二个观点是黄海绿潮浒苔是多点起源的, 在江苏、山东等地都有检测到漂浮浒苔分散的现象(梁宗英等, 2008); 第三个观点认为在绿潮暴发结束后, 大生物藻体沉降到海底, 第二年达到适宜条件重新成为暴发的种源(Zhang, 2011); 第四个观点通过遥感观测数据检测到黄海绿潮起源于黄海南部浅滩筏式养殖区(Liu, 2009)。通过这几种可能性的源头接下来的试验可以对不同地点的沉积物进行采集, 培养检测萌发出的幼苗种类, 对其进行分子鉴定, 与绿潮暴发时期的绿藻进行比较, 即可从微观繁殖体方面佐证绿潮浒苔的来源。其中, 内转录单元间隔区IGS被认为是适用于种下鉴定的一种分子标记手段, 沈伟杰等(2019)采用内转录单元间隔区IGS作为分子标记对不同时间和地点的绿潮漂浮和筏架定生浒苔进行鉴定, 发现两者具有很近的亲缘关系, 而漂浮浒苔之间没有碱基差异, 那么可以对不同地点微观繁殖体培养出的幼苗进行IGS检测有多少碱基差异从而对亲缘关系进行分析。
此外, 对于从微观繁殖体层面上对黄海绿潮浒苔进行防治还需要进一步的研究。李靖等(2015)通过利用不同浓度的改性粘土对浒苔的微观繁殖体进行处理, 发现适量的改性粘土能有效降低其萌发率从而达到去除效果。这为我们之后在浒苔微观繁殖体层面上对绿潮浒苔进行消除或减弱提供了新的思路。
王广策, 王辉, 高山, 等, 2020. 绿潮生物学机制研究[J]. 海洋与湖沼, 51(4): 789-808.
王广策, 唐学玺, 何培民, 等, 2016. 浒苔光合作用等关键生理过程对环境因子响应途径的研究进展[J]. 植物生理学报, 52(11): 1627-1636.
王晓坤, 马家海, 叶道才, 等, 2007. 浒苔()生活史的初步研究[J]. 海洋通报, 26(5): 112-116.
王浩东, 2012. 浒苔()生殖遗传学的初步研究[D]. 青岛: 中国海洋大学.
方松, 王宗灵, 李艳, 等, 2012. 南黄海及长江口附近海域绿潮暴发前期微观繁殖体的动态变化[J]. 海洋学报, 34(4): 147-154.
刘峰, 逄少军, 单体锋, 等, 2010. 一种新的海水中石莼属海藻显微阶段个体数定量方法及在黄海绿潮爆发过程中的应用[J]. 科学通报, 55(6): 468-473.
刘湘庆, 王宗灵, 李艳, 等, 2015. 温度对沉积物中的绿藻微观繁殖体萌发的影响[J]. 海洋科学进展, 32(2): 219-226.
杜宇, 2019. 南黄海筏架区定生浒苔生长繁殖及连续多世代倍性比例的初步研究[D]. 苏州: 苏州大学.
李靖, 孙雷, 宋秀贤, 等, 2015. 改性粘土对浒苔()微观繁殖体去除效果及萌发的影响[J]. 海洋与湖沼, 46(2): 345-350.
邹定辉, 夏建荣, 2004. 海藻有性繁殖生态学研究进展[J]. 生态学报, 24(12): 2870-2877.
沈伟杰, 缪晓翔, 何渊, 等, 2019. 浒苔()核糖体基因簇单元全长序列的克隆与分析[J]. 海洋科学进展, 37(3): 487-494.
张华伟, 马家海, 胡翔, 等, 2011. 绿潮漂浮浒苔繁殖特性的研究[J]. 上海海洋大学学报, 20(4): 600-606.
敖愿, 2020. 绿潮相关绿藻的细胞与分子鉴定[D]. 苏州: 苏州大学.
梁宗英, 林祥志, 马牧, 等, 2008. 浒苔漂流聚集绿潮现象的初步分析[J]. 中国海洋大学学报, 38(4): 601-604.
缪晓翔, 肖洁, 王宗灵, 等, 2020. 江苏-山东沿岸大型绿藻微观繁殖体时空分布特征研究[J]. 海洋学报, 42(2): 115-123.
BURROWS E M, 1958. Sublittoral algal population in Port Erin Bay, Isle of Man [J]. Journal of the Marine Biological Association of the United Kingdom, 37(3): 687-703.
CHAPMAN A R O, 1987. Population and community ecology of seaweeds [J]. Advances in Marine Biology, 23: 1-161.
CLAYTON M N, 1992. Propagules of marine macroalgae: structure and development [J]. British Phycological Journal, 27(3): 219-232.
DAWES C J, KOCH E W, 1991. Branch, micropropagule and tissue culture of the red algaeandfarmed in the Philippines [J]. Journal of Applied Phycology, 3(3): 247-257.
GAO S, CHEN X Y, YI Q Q,, 2010. A strategy for the proliferation of, main causative species of green tides, with formation of sporangia by fragmentation [J]. PLoS One, 5(1): e8571.
HAN H B, SONG W, WANG Z L,, 2019. Distribution of green algae micro-propagules and their function in the formation of the green tides in the coast of Qinhuangdao, the Bohai Sea, China [J]. Acta Oceanologica Sinica, 38(8): 72-77.
HIRAOKA M, YOSHIDA G, 2010. Temporal variation in isomorphic phase and sex ratios of a natural population of(chlorophyta) [J]. Journal of Phycology, 46(5): 882-888.
HODÁŇOVÁ D, 1981. Plant strategies and vegetation processes[J]. Biologia Plantarum, 23(4): 254.
HOFFMANN A J, 1987. The arrival of seaweed propagules at the shore: a review [J]. Botanica Marina, 30(2): 151-166.
HOFFMANN A J, SANTELICES B, 1991. Banks of algal microscopic forms: hypotheses on their functioning and comparisons with seed banks [J]. Marine Ecology Progress Series, 79: 185-194.
HUO Y Z, HAN H B, HUA L,, 2016. Tracing the origin of green macroalgal blooms based on the large scale spatio-temporal distribution ofmicroscopic propagules and settled maturevegetative thalli in coastal regions of the Yellow Sea, China [J]. Harmful Algae, 59: 91-99.
KAMERMANS P, MALTA E, VERSCHUURE J M,, 1998. Role of cold resistance and burial for winter survival and spring initiation of anspp. (Chlorophyta) bloom in a eutrophic lagoon (Veerse Meer lagoon, The Netherlands)[J]. Marine Biology, 131: 45-51.
LECK M A, 1989. Wetland seed banks [M] // LECK M A, PARKER V T, SIMPSON R L. Ecology of Soil Seed Banks. San Diego, CA, USA: Academic Press: 283-305.
LIU D Y, KEESING J K, XING Q G,, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China [J]. Marine Pollution Bulletin, 58(6): 888-895.
LIU F, PANG S J, XU N,, 2010.diversity in the Yellow Sea during the large-scale green algal blooms in 2008-2009[J]. Phycological Research, 58(4): 270-279.
LIU F, PANG S J, ZHAO X B,, 2012. Quantitative, molecular and growth analyses ofmicroscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred [J]. Marine Environmental Research, 74: 56-63.
LOTZE H K, SCHRAMM W, SCHORIES D,, 1999. Control of macroalgal blooms at early developmental stages:versusspp. [J]. Oecologia, 119(1): 46-54.
MIAO X X, XIAO J, PANG M,, 2018. Effect of the large-scale green tide on the species succession of green macroalgal micro-propagules in the coastal waters of Qingdao, China [J]. Marine Pollution Bulletin, 126: 549-556.
PANG S J, LIU F, SHAN T F,, 2010. Tracking the algal origin of thebloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses [J]. Marine Environmental Research, 69(4): 207-215.
REDDY C R K, KUMAR G R K, SIDDHANTA A K,, 2003.somatic embryogenesis and regeneration of somatic embryos from pigmented callus of(Doty) DOTY (Rhodophyta, Gigartinales) [J]. Journal of Phycology, 39(3): 610-616.
REED D C, ANDERSON T W, EBELING A W,, 1997. The role of reproductive synchrony in the colonization potential of kelp [J]. Ecology, 78(8): 2443-2457.
SANTELICES B, 1990. Patterns of reproduction, dispersal and recruitment in seaweeds [J]. Oceanography and Marine Biology - An Annual Review, 28: 148-154.
SANTELICES B, AEDO D, HOFFMANN A, 2002. Banks of microscopic forms and survival to darkness of propagules and microscopic stages of macroalgae [J]. Revista Chilena De Historia Natural, 75(3): 547-555.
SANTELICES B, HOFFMANN A J, AEDO D,, 1995. A bank of microscopic forms on disturbed boulders and stones in tide pools [J]. Marine Ecology Progress Series, 129(1/3): 215-228.
SCHORIES D, 1995. Sporulation ofspp. (Chlorophyta) and overwintering of spores in sediments of the Wadden Sea, Island Sylt, North Sea [J]. Netherland Journal of Aquatic Ecology, 29(3/4): 341-347.
SONG W, PENG K Q, XIAO J,, 2015. Effects of temperature on the germination of green algae micro-propagules in coastal waters of the Subei Shoal, China [J]. Estuarine, Coastal and Shelf Science, 163: 63-68.
SPENCE M, 1918. Laminariaceae of Orkney: their ecology and economics [J]. Journal of Botany, 56: 281-285.
WORM B, LOTZE H K, SOMMER U, 2001. Algal propagule banks modify competition, consumer and resource control on Baltic rocky shores [J]. Oecologia, 128(2): 281-293.
ZHANG X W, WANG H X, MAO Y Z,, 2010. Somatic cells serve as a potential propagule bank offorming a green tide in the Yellow Sea, China [J]. Journal of Applied Phycology, 22(2): 173-180.
ZHANG X W, XU D, MAO Y Z,, 2011. Settlement of vegetative fragments ofconfirmed as an important seed source for succession of a large-scale green tide bloom [J]. Limnology and Oceanography, 56(1): 233-242.
ZHAO X H, CUI J J, ZHANG J H,, 2019. Reproductive strategy of the floating algain blooms in the Yellow Sea based on a combination of zoid and chromosome analysis [J]. Marine Pollution Bulletin, 146: 584-590.
BRIEF INTRODUCTION OF MICROPROPAGULE
SHEN Song-Dong
(Department of Cell Biology, Soochow University, Suzhou 215123, China)
The concept of “micropropagule” is traced and summarized by referring to the relevant reports in this study. We suggest that the concept of “micropropagule” should not be regarded as a general term of the released spores, gametes, zygotes, microscopic forms in the different stages or the large seaweed fragments, it refers to those fragments which are invisible, for example, the diploid cell clusters, the fallen tissue blocks and “pigment bodies” (colored algal segments). Actually, micropropagules are one or more diploid algal cells. Takingas an example, the main role of the micropropagules in the life history ofis briefly described, which lays a foundation for theoretical research and practical use of the “micropropagule” of.
seed bank; micropropagule; green tide;; life history; vegetative generation
Q178.1
10.11693/hyhz20210600129
*国家重点研发专项, 2016YFC1402102号; 江苏省高等学校自然科学研究项目, 20KJD170004号。沈颂东, 博士生导师, 教授, E-mail: shensongdong@suda.edu.cn
2021-06-04,
2021-09-07
