核酸适配体-金纳米粒子比色法快速检测盐酸克伦特罗*
2022-01-19肖淑艳孙良卢继平董忠平
肖淑艳,孙良,卢继平,董忠平
(1.内蒙古科技大学 材料与冶金学院,内蒙古 包头 014010;2.内蒙古科技大学 内蒙古自治区先进陶瓷材料与器件重点实验室,内蒙古 包头 014010))
盐酸克伦特罗(CLB)俗称瘦肉精,属苯乙醇胺类化合物,它通过改变猪的代谢途径提高胴体瘦肉率,减少脂肪沉积[1].瘦肉精是我国明令禁止的食品添加剂,人们食用含有一定剂量克伦特罗的产品后将产生不同的中毒症状,如头晕、呕吐、发热等[2].酶联免疫法、高效液相色谱法、毛细管电泳法等是检测克伦特罗常用的方法[3].Du等[4]将固相微萃取和高效液相色谱法相结合同时检测样品中的克伦特罗、沙丁胺醇和莱克多巴胺,线性范围为0.5~50 g/L,检测限为0.1 g/L,具有较高的灵敏度. Fan等[5]利用毛细管电泳对猪尿样中的克伦特罗进行检测,检测限为0.26 ng/mL.这些方法虽然有很高的灵敏度,但操作复杂、实验过程需要昂贵仪器和专业技术人员,因此,开发新型高效、简便的盐酸克伦特罗检测方法具有重要意义.
核酸适配体是经过体外筛选得到的DNA或RNA片段,对靶标分子具有很强的识别能力[6].利用适配体与传感器元件结合,将适配体与靶标的作用转化为可测量的电化学、荧光、比色等信号即可实现对靶标的检测[7].其中,适配体比色传感器具有操作简单、检测迅速、成本低等特点,已广泛应用于食品安全、环境监测、医药卫生等领域[8].
金纳米粒子(AuNPs)具有比表面积大、吸附能力强、消光系数高、生物相容性好等特点,在比色分析法中受到越来越多的关注.金溶液的颜色和表面等离子共振峰的位置与金纳米粒子的尺寸、形状、表面修饰、介质折射率、聚集状态等因素密切相关,利用这种性质可建立多种金纳米粒子比色生物传感器,实现对靶标的检测[9].
将适配体与金纳米粒子相结合,通过适配体与盐酸克伦特罗作用改变氯化钠诱导的金纳米粒子的聚集-分散状态,建立一种快速检测盐酸克伦特罗的方法,对支持实际食品检测具有重要意义.
1 实验部分
1.1 仪器设备
SQP电子天平,赛多利斯科学仪器(北京)有限公司;Tecnai G2 F20场发射透射电子显微镜,FEI公司,美国;TGL-20M台式高速冷冻离心机,湘潭湘仪仪器有限公司;SPJ2100-2,重庆盛普超纯水设备制造商;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司.
1.2 试剂与材料
核酸适配体购自生工生物工程股份有限公司,实验中所用适配体序列为:5’-TCA TGC CAA GCT GTA CAC CGT CCT GGC CTG GTT GGG ATG T-3’;盐酸克伦特罗、六水氯化镁、葡萄糖、柠檬酸钠购自上海阿拉丁生化科技股份有限公司;甘氨酸购自生工生物工程股份有限公司;氯化钠、氯化钙、L-半胱氨酸购自天津市永大化学试剂有限公司;氯金酸购自国药集团化学试剂有限公司.
1.3 金纳米粒子的制备
金纳米粒子的制备采用Liu等[10]报道的方法:(1)用王水浸泡实验用到的全部玻璃器皿及转子,并用超纯水洗净,放入烘箱烘干.(2)在三颈烧瓶中加入98 mL超纯水和2 mL 50 mmol·L-1氯金酸溶液,氯金酸最终浓度为1 mmol·L-1. (3)加热回流.(4)溶液出现回流时快速向烧瓶中加入10 mL 38.8 mmol·L-1柠檬酸钠,1 min之内溶液颜色由黄色变成酒红色,继续回流20 min.(5)关闭加热,在搅拌下使装置冷却到室温,存放于棕色瓶中置于4 ℃保存,一个月内保持稳定.
1.4 金纳米粒子比色法检测盐酸克伦特罗方法的建立
将10 μL不同浓度的盐酸克伦特罗分别与10 μL 0.8 μmol·L-1适配体在酶标板中混匀,放置6 min,加入30 μL 11.5 nmol·L-1金纳米粒子,静置12 min;加入141 μL超纯水和9 μL 1 mol·L-1氯化钠溶液,混匀静置16 min,观察溶液颜色变化,记录400~700 nm的吸收光谱.以加入盐酸克伦特罗前后522 nm处吸光度的差为纵坐标、盐酸克伦特罗浓度为横坐标,绘制标准曲线.测定未知样品吸光度值,由标准曲线方程即可求出未知样品中盐酸克伦特罗的浓度.
2 结果与讨论
2.1 AuNPs的表征
粒径在1~100 nm间的金纳米粒子具有良好的光学性质及生物相容性,是构建生物传感器的常用物质.如图1所示,制备的金纳米粒子在400~700 nm的范围内有紫外吸收,最大吸收波长是522 nm.根据朗伯比尔定律计算出金纳米粒子的浓度为11.5 nmol·L-1.透射电子显微镜的结果表明合成的金纳米粒子呈现良好的分散状态,能够满足后续实验要求.

图1 金纳米粒子吸收光谱和透射电子显微镜图(a)金纳米粒子吸收光谱;(b)金纳米粒子透射电子显微镜图
2.2 金纳米粒子比色法检测盐酸克伦特罗实验原理
金纳米粒子比色法检测盐酸克伦特罗的原理如图2所示,制备的金纳米粒子在分散状态下呈红色,加入一定浓度氯化钠后,其表面的负电荷被屏蔽,纳米颗粒间的排斥力减弱,金纳米粒子聚集,溶液颜色由红色变成蓝色(图2(a)).当有盐酸克伦特罗适配体存在时,适配体吸附在金纳米粒子的表面,阻止盐诱导引起的聚集,溶液仍为红色(图2(b)).加入靶标盐酸克伦特罗后,适配体与靶标特异性结合,失去保护的金纳米粒子在氯化钠中聚集,溶液变成蓝色(图2(c)).

图2 基于适配体的金纳米粒子比色生物传感器用于快速检测盐酸克伦特罗示意图
上述实验原理可通过金纳米粒子的紫外可见光谱图得到进一步验证.如图3所示,分散的金纳米粒子在522 nm处具有强的紫外吸收.加入氯化钠后,氯化钠引起金纳米粒子聚集,吸收峰显著降低.有适配体存在时,适配体吸附在金纳米粒子的表面,有效阻止盐诱导金纳米粒子聚集,吸收峰值回升.加入盐酸克伦特罗后,适配体与盐酸克伦特罗特异性结合,金纳米粒子失去表面核酸链的保护,在氯化钠中聚集,吸收峰降低.因此可通过氯化钠诱导金纳米粒子聚集引起紫外吸收光谱的变化和溶液颜色的变化实现对盐酸克伦特罗的检测.

图3 不同体系中金纳米粒子的紫外吸收光谱
2.3 实验条件优化
2.3.1氯化钠浓度的优化
氯化钠浓度是影响金纳米粒子聚集的重要因素,氯化钠浓度过低不能引起金纳米粒子聚集,氯化钠浓度过高则适配体不能完全保护金纳米粒子,导致背景偏高.因此,首先优化氯化钠浓度.分别在30 L金纳米粒子中加入超纯水和氯化钠溶液,各管最终总体积为200 L,氯化钠最终浓度分别是0,25,30,35,40,45,50 mmol·L-1,静置16 min,测定其吸收光谱.
结果如图4所示,在25 mmol·L-1至45 mmol·L-1范围内,随着氯化钠浓度的升高,金纳米粒子在522 nm处的吸光度值逐渐降低,溶液颜色由红色逐渐变为蓝紫色,当氯化钠浓度为50 mmol·L-1时,522 nm处的紫外吸收峰几乎消失,说明此时氯化钠聚集严重.因此,选用45 mmol·L-1氯化钠用于后续实验.

图4 氯化钠浓度对金纳米粒子吸收光谱和溶液颜色的影响
2.3.2金纳米粒子-氯化钠反应时间的优化
将30 L金纳米粒子与161 L超纯水和9 L 1 mol·L-1氯化钠混合均匀,分别在0,2,4,6,8,10,12,14,16,18 min时测定其紫外可见吸收光谱.结果显示:随着时间的增加,522 nm处的吸收值逐渐下降,16 min后,吸收值基本不再变化,故最优金纳米粒子-氯化钠反应时间为16 min,如图5所示.

图5 金纳米粒子和氯化钠反应时间对金纳米粒子吸光度的影响
2.3.3核酸适配体浓度的优化
将10 L不同浓度的核酸适配体分别与30 L金纳米粒子混合均匀,孵育12 min;加入151 L超纯水与9 L 1 mol·L-1氯化钠,核酸适配体的最终浓度分别为5,10,15,20,25,30,35,40,45 nmol·L-1,孵育16 min,测定其吸收光谱.结果显示随着核酸适配体浓度的增加,金纳米粒子在522 nm处的吸光度值逐渐升高;核酸适配体浓度达到40 nmol·L-1后,金纳米粒子吸光度值不再发生变化,故最优核酸适配体浓度选为40 nmol·L-1,如图6所示.

图6 适配体浓度对金纳米粒子吸光度的影响
2.3.4金纳米粒子-核酸适配体反应时间的优化
将30 L金纳米粒子与10 L 0.8 mol·L-1核酸适配体混合均匀,分别静置0,3,6,9,12,15 min,然后各加入151 L超纯水和9 L 1 mol·L-1氯化钠,静置16 min,测其吸收光谱.如图7所示,随着核酸适配体与金纳米粒子反应时间的增加,522 nm处的吸光度值增加;12 min后,吸光度值不再变化,故最优金纳米粒子-核酸适配体反应时间选为12 min.

图7 金纳米粒子和适配体反应时间对金纳米粒子吸光度的影响
2.3.5盐酸克伦特罗-核酸适配体反应时间的优化
将10 L 6 mol·L-1盐酸克伦特罗与10 L 0.8 mol·L-1适配体混匀,静置0,2,4,6,8 min后,各加入30 L金纳米粒子,孵育12 min;加入141 L超纯水和9 L 1 mol·L-1氯化钠,静置16 min,测定吸收光谱.如图8所示,随着核酸适配体与盐酸克伦特罗反应时间的增加,522 nm处的吸光度值逐渐降低;6 min后,吸光度值不再变化,故最优盐酸克伦特罗-核酸适配体反应时间选为6 min.

图8 盐酸克伦特罗和适配体反应时间对金纳米粒子吸光度的影响
2.4 线性范围与检出限
在最佳实验条件下,向体系中加入浓度为50~400 nmol·L-1的盐酸克伦特罗,记录紫外光谱,结果如图9所示,靶标浓度在50~350 nmol·L-1范围内,加入盐酸克伦特罗前后522 nm处吸光度的差值和盐酸克伦特罗浓度间呈线性关系,线性方程是y=0.000 29X+0.005 86,R2=0.997 5,检出限为18.7 nmol·L-1.

图9 ΔA522与克伦特罗浓度的线性标准曲线
2.5 干扰实验
为了考察肉类及动物尿液中其它物质对检测盐酸克伦特罗的影响,本文分别选用甘氨酸、L-半胱氨酸、Mg2+、葡萄糖、Ca2+作为干扰物质,测定加入盐酸克伦特罗或干扰物质对522 nm处吸光度值的影响.
如图10所示,加入盐酸克伦特罗前后引起522 nm处吸光度值的变化远远大于其它物质,说明本方法对盐酸克伦特罗具有选择性,其它物对盐酸克伦特罗检测的干扰较小.

图10 加入克伦特罗或其他干扰物质前后金纳米粒子ΔA522的变化值
2.6 回收实验
向水样中加入盐酸克伦特罗进行加标回收实验,3组水样中分别加入最终浓度为100,150,200 nmol·L-1的盐酸克伦特罗,在最优实验条件下进行回收率测定.结果表明:加标回收率在92.2%~109.9%之间.中华人民共和国出入境检验检疫行业标准中采用液相色谱-质谱/质谱法对克伦特罗残留量测定的回收率在83.7%~114.5%之间[11].本方法的回收率范围与上述标准及其它方法的回收率范围类似,见表1所示,本方法具有可行性.
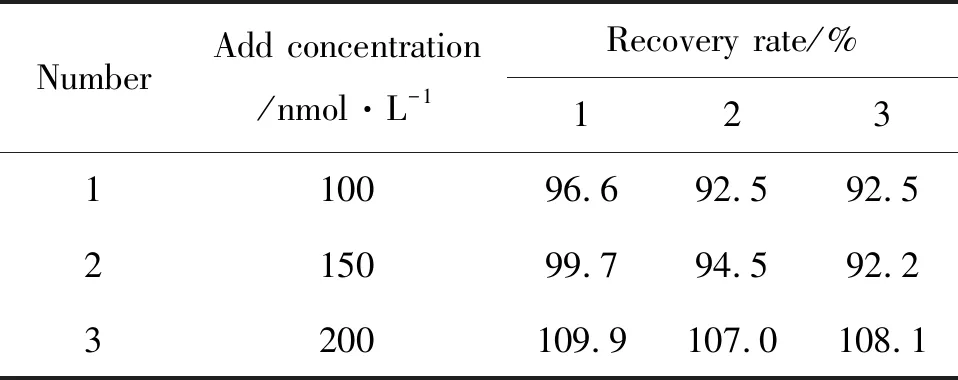
表1 水样中克伦特罗的加标回收率
目前检测盐酸克伦特罗的方法有高效液相色谱-质谱/质谱法、电化学法、免疫法等[12-16].本方法的检出限小于或接近其它方法的检出限(表2).但与这些方法相比,本方法不需要昂贵的仪器,实验过程耗时短,结合便携式紫外可见光谱仪可实现现场检测.

表2 克伦特罗检测方法比较
3 结论
以克伦特罗适配体作为识别探针,金纳米粒子作为比色探针,通过比较加入盐酸克伦特罗前后紫外光谱的变化,实现了对盐酸克伦特罗的快速检测.与其它传统方法相比,所使用的仪器设备简单,耗时短.
