化学物质诱导对马氏珠母贝眼点幼虫附着的影响
2022-01-19杨创业章佳斌曾业涛廖永山邓岳文王庆恒
杨创业,章佳斌,曾业涛,廖永山,邓岳文,3,王庆恒,3
化学物质诱导对马氏珠母贝眼点幼虫附着的影响
杨创业1,章佳斌1,曾业涛1,廖永山2,邓岳文1,3,王庆恒1,3
(1. 广东海洋大学水产学院 // 2. 广东海洋大学珍珠研究所 // 3. 广东省珍珠养殖与加工工程技术研究中心,广东 湛江 524088)
【目的】研究血清素(5-HT)、蜕皮激素、γ-氨基丁酸(GABA)、腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤对马氏珠母贝眼点幼虫附着的影响。【方法】以不同浓度的5-HT、蜕皮激素、GABA、腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤溶液处理马氏珠母贝眼点幼虫,不同时间后,分析眼点幼虫附着率的变化。【结果】在24 ~ 96 h作用时间里,5-HT、蜕皮激素、GABA对眼点幼虫附着的诱导效果整体上均呈上升趋势;在24 ~ 120 h作用时间里,腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤对眼点幼虫附着的诱导效果整体上呈上升趋势。眼点幼虫在10-5mol/L的5-HT和GABA处理24、48、72和96 h后,附着率均显著高于对照组(< 0.01);10-5mol/L的蜕皮激素处理24 h和72 h,10-6mol/L的蜕皮激素处理24 h和96 h,10-7mol/L的蜕皮激素处理24 h,附着率均显著高于对照组(< 0.01);10 μmol/L腺嘌呤核苷处理24、48、72和120 h,1 μmol/L腺嘌呤核苷处理24、48、72、96和120 h,附着率均显著高于对照组(< 0.01);10 μmol/L次黄嘌呤核苷处理48和72 h,1 μmol/L次黄嘌呤核苷处理48、72、96和120 h,附着率均显著高于对照组(< 0.01);10 μmol/L的次黄嘌呤处理72、96和120 h,附着率均显著高于对照组(< 0.01)。【结论】5-HT、蜕皮激素、GABA、腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤溶液在适宜的浓度和处理时间均可诱导马氏珠母贝眼点幼虫附着,其中10-5mol/L的5-HT处理24 h对附着率的诱导效果最佳,可达对照组的6.3倍。
马氏珠母贝;眼点幼虫;附着;化学物质
贝类附着变态阶段幼虫对环境因素异常敏感,常因受到不良环境因素的影响,出现变态延迟或大量死亡,死亡率有时可以高达80% ~ 90%,给生产造成巨大损失[1]。在贝类苗种培育过程中,以优化育苗技术方案来促进浮游幼虫大量同步定向附着和变态,可显著提高育苗的产量和效益。研究表明,物理环境诱导(如基质、水流、温度和盐度等)[2-4]、生物诱导[1, 5-6]及化学物质诱导[7-9]等均影响着贝类幼虫的附着变态。然而,同一种药物对于双壳贝类,甚至同属并不具备有普适性。例如,肾上腺素在厚壳贻贝()眼点幼虫具诱导作用[10],而在紫贻贝()上却没有作用[11]。因此,寻找促进特定贝类附着变态的有效解决方案具有重要意义。
马氏珠母贝()是我国南方沿海特色养殖贝类,主要用于培育海水珍珠,同时具有较高营养和药用价值[12],然而,苗种生产中的幼虫附着变态率低的问题一直是限制马氏珠母贝产业发展的主要因素之一。为缩短幼虫附着变态时间,提高幼虫附着变态率,本团队前期利用代谢组结合转录组技术研究了马氏珠母贝幼虫附着变态过程调控特征,筛选了参与附着变态过程的差异代谢物,包括血清素(5-HT)、γ-氨基丁酸(GABA)、蜕皮激素、腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤等[13]。本研究在此基础上探讨了以上差异代谢物对马氏珠母贝眼点幼虫附着的影响,以期为高效苗种培育提供技术指导。
1 材料和方法
1.1 实验材料
从本团队培育的马氏珠母贝黑壳色品系中挑出性腺成熟的个体,清洗贝体表面的附着物,剖取马氏珠母贝的精子和卵子,将收集到的精子与卵子在砂滤海水中混合,使其受精(温度25 °C ± 1 °C,盐度30 ± 1)。完成受精后,使用砂滤海水洗涤受精卵3 ~ 4次,去除多余的精子和未成熟的卵子,并将卵移入新的砂滤海水中进行早期培育。受精后21 d,幼虫后腹部口与肛门之间出现足和鳃的原基,在足原基的基部前方两侧靠近贝壳的位置出现圆形或椭圆形的眼点,选取此时期幼虫作为实验材料。
1.2 实验方法
实验开始前,使用过滤海水分别配制成5-HT、蜕皮激素 [助溶剂为0.9 µL/L二甲基亚砜 (DMSO)溶液]、GABA、腺嘌呤核苷、次黄嘌呤核苷和次黄嘌呤的储备液。5-HT设计3个浓度实验梯度,分别是10-5、10-6、10-7mol/L和1个空白对照组,作用时间为24、48、72和96 h;蜕皮激素设计3个浓度实验梯度,分别是10-5、10-6和10-7mol/L,对照组为1个空白对照组和0.9 μL/L DMSO溶液组,作用时间为24、48、72和96 h;GABA设计3个浓度实验梯度,分别是10-5、10-6、10-7mol/L和1个空白对照组,作用时间为24、48、72和96 h;腺嘌呤核苷设计3个浓度实验梯度,分别是10-4、10-5、10-6mol/L和1个空白对照组,作用时间为24、48、72、96和120 h;次黄嘌呤核苷设计3个浓度实验梯度,分别是10-4、10-5、10-6mol/L和1个空白对照组,作用时间为24、48、72、96和120 h;次黄嘌呤设计3个浓度实验梯度,分别是10-4、10-5、10-6mol/L和1个空白对照组,作用时间为24、48、72、96和120 h。
实验在60 mL的一次性培养皿中进行,各培养皿中放置40 mL过滤海水,每个培养皿幼虫数为80 ~ 130只,并通过微型蠕动泵进行增氧,每12 h投喂湛江等鞭金藻(),各组处理设置3个重复。
通过对附着在培养皿中的幼虫进行计数并统计附着率(附着率= 附着个体数/实验个体总数),具体技术方法参照Yu等[14]。
1.3 数据处理
数据运用EXCEL进行处理,将获得的附着率百分比数值进行平方根的反正弦转换,以增加数据的正态和方差齐性。采用SPSS 26. 0对所得数据进行单因素方差分析,若差异达到显著,则进行Tukey多重比较,显著性水平= 0.05。
2 结果
2.1 5-HT对马氏珠母贝眼点幼虫附着率的影响
在24 ~ 96 h作用时间里,5-HT对马氏珠母贝眼点幼虫附着的诱导效果整体呈上升趋势(图1)。其中,10-5mol/L的5-HT对幼虫附着的诱导效果最佳,10-5mol/L的5-HT处理24、48、72和96 h后,幼虫的附着率均显著高于对照组(< 0.05),附着率分别是对照组的6.3倍、6.0倍、3.9倍和2.0倍;10-6mol/L和10-7mol/L的5-HT对马氏珠母贝眼点幼虫附着率无显著提高(0.05)。
2.2 蜕皮激素对马氏珠母贝眼点幼虫附着率影响
在24 ~ 96 h作用时间里,蜕皮激素对马氏珠母贝眼点幼虫附着的诱导效果整体上呈上升趋势(图2)。10-5mol/L的蜕皮激素处理24 h和72 h后,眼点幼虫附着率均显著高于对照组和DMSO组(< 0.05),附着率分别是对照组的2.4倍和2.6倍;10-6mol/L的蜕皮激素处理24 h和96 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组的2.0倍和2.1倍;10-7mol/L的蜕皮激素处理24 h后,幼虫的附着率显著高于对照组(< 0.05),附着率是对照组的2.5倍。
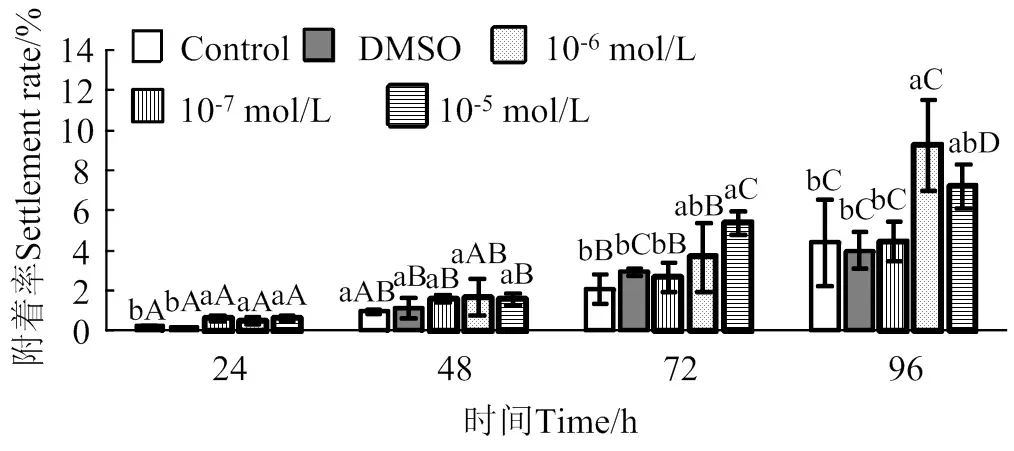
相同浓度处理组在不同时间之间,凡含一个相同大写字母,表示差异不显著(P > 0.05),相同时间里不同浓度处理组之间,凡含一个相同小写字母表示差异不显著(P > 0.05)
2.3 GABA对马氏珠母贝眼点幼虫附着率的影响
在24 ~ 96 h作用时间里,GABA对马氏珠母贝眼点幼虫附着的诱导效果整体呈上升趋势(图3)。10-5mol/L的GABA对幼虫附着的诱导效果最佳,10-5mol/L的GABA处理24、48、72和96 h后,幼虫的附着率均显著高于对照组(< 0.05),附着率分别是对照组的5.5倍、3.0倍、2.8倍和2.2倍;10-6mol/L和10-7mol/L的GABA对马氏珠母贝眼点幼虫附着率无显著提高(> 0.05)。
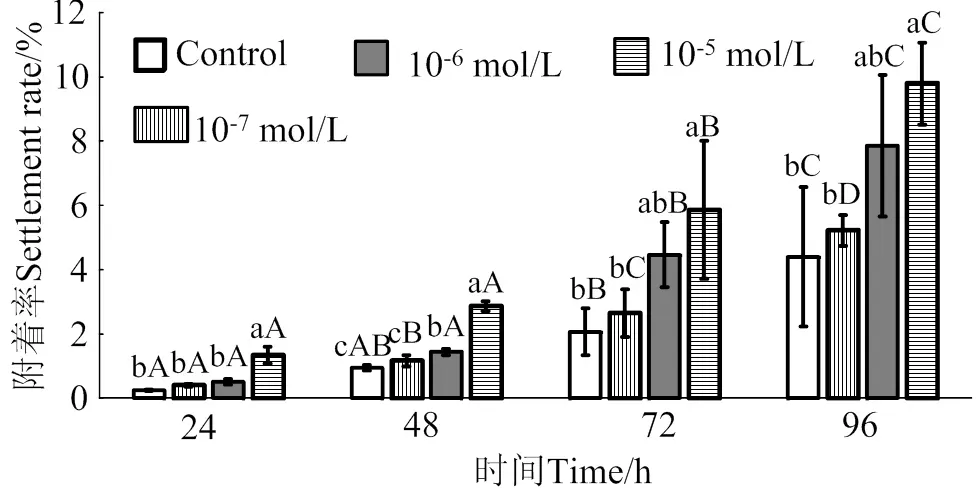
相同浓度处理组在不同时间之间,凡含一个相同大写字母,表示差异不显著(P > 0.05),相同时间里不同浓度处理组之间,凡含一个相同小写字母表示差异不显著(P > 0.05)
2.4 腺嘌呤核苷对马氏珠母贝眼点幼虫附着率影响
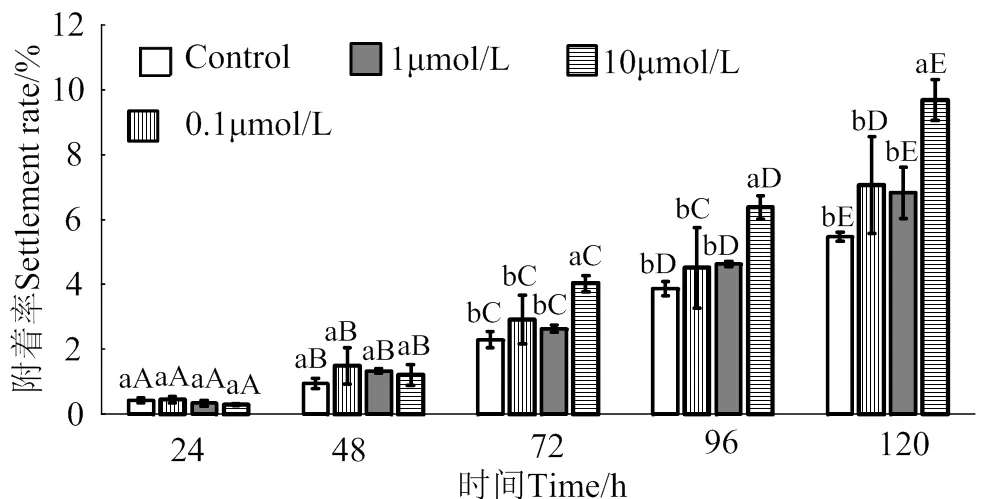
在24 ~ 120 h作用时间里,腺嘌呤核苷对马氏珠母贝眼点幼虫附着的诱导效果整体呈上升趋势(图4)。10 μmol/L的腺嘌呤核苷处理24、48、72和120 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组的2.1倍、3.5倍、2.7倍和2.1倍;1 μmol/L的腺嘌呤核苷处理24、48、72、96和120 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组的1.9倍、3.0倍、2.6倍、2.1倍和2.3倍;0.1 μmol/L的腺嘌呤核苷对马氏珠母贝眼点幼虫附着率无显著提高(> 0.05)。
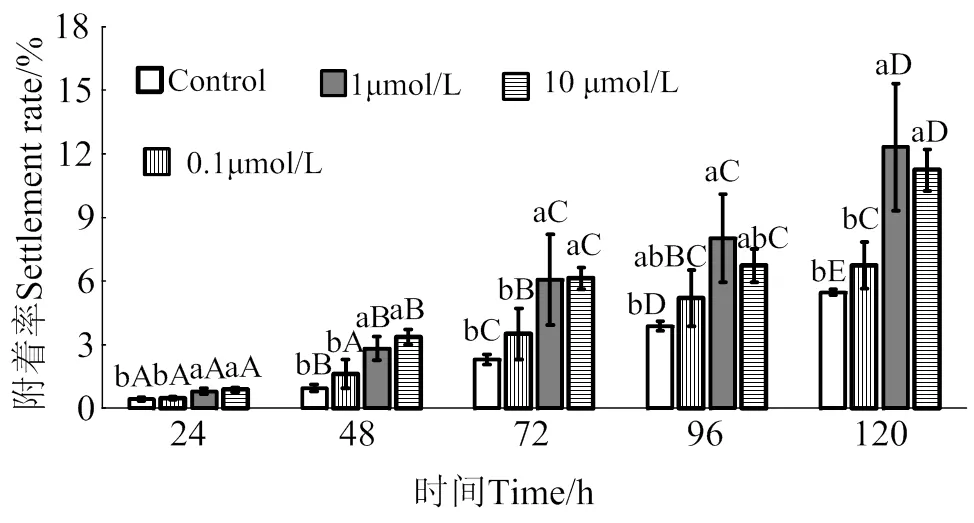
相同浓度处理组在不同时间之间,凡含一个相同大写字母,表示差异不显著(P > 0.05),相同时间里不同浓度处理组之间,凡含一个相同小写字母表示差异不显著(P > 0.05)
2.5 次黄嘌呤核苷对马氏珠母贝眼点幼虫附着率影响
在24 ~ 120 h作用时间里,次黄嘌呤核苷对马氏珠母贝眼点幼虫附着诱导效果整体呈上升趋势(图5)。10 μmol/L次黄嘌呤核苷处理48 h和72 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组2.4倍和1.8倍;1 μmol/L次黄嘌呤核苷处理48、72、96和120 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组1.8倍、1.5倍、1.3倍和1.3倍;0.1 μmol/L次黄嘌呤核苷对马氏珠母贝眼点幼虫附着率无显著提高(> 0.05)。
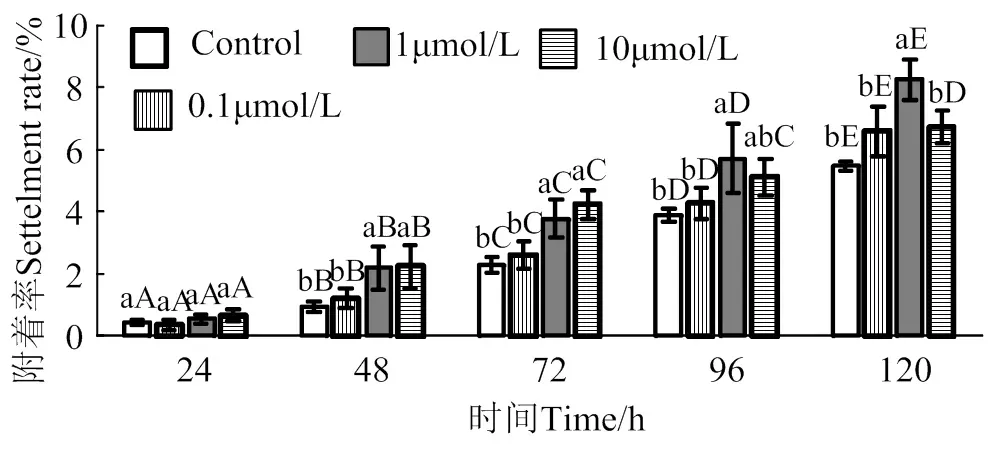
相同浓度处理组在不同时间之间,凡含一个相同大写字母,表示差异不显著(P > 0.05),相同时间里不同浓度处理组之间,凡含一个相同小写字母表示差异不显著(P > 0.05)
2.6 次黄嘌呤对马氏珠母贝眼点幼虫附着率影响
在24 ~ 120 h作用时间里,次黄嘌呤对马氏珠母贝眼点幼虫附着的诱导效果整体呈上升趋势(图6)。10 μmol/L的次黄嘌呤处理72、96和120 h后,幼虫附着率均显著高于对照组(< 0.05),附着率分别是对照组的1.8倍、1.6倍和1.8倍;0.1 μmol/L和1 μmol/L的次黄嘌呤对马氏珠母贝眼点幼虫附着率无显著提高(> 0.05)。
相同浓度处理组在不同时间之间,凡含一个相同大写字母,表示差异不显著(P > 0.05),相同时间里不同浓度处理组之间,凡含一个相同小写字母表示差异不显著(P > 0.05)
3 讨论
在水产经济贝类的苗种生产中,幼虫附着变态的成功与否直接决定出苗量和育苗的成败。提高幼虫附着变态率是解决这一问题的主要途径之一。化学物质通过对软体动物行为方式或生活方式的影响,可使更多幼虫附着到基质上。因此,幼虫一旦探测到化学信号,就可能会改变其垂直分布,使幼虫集中分布在水体的底部或附着在附着基上[15]。
5-HT是一种神经递质和调节剂,在无脊椎动物的神经系统中起着重要的作用[16]。研究表明,5-HT可以诱导大珠母贝()[17]和羊鲍()[8]等幼虫的变态发育。本研究中,10-5mol/L的5-HT处理24、48、72和96 h后,马氏珠母贝眼点幼虫的附着率均显著高于对照组,最高可达对照组的6.3倍。该结果与Yu等[14]的诱导结果相似;同时与本团队马氏珠母贝眼点幼虫附着变态前后转录组与代谢组研究中血清素及血清素受体相关基因的变化相呼应[13]。
蜕皮激素是节肢动物幼虫启动变态过程中最重要的激素之一,蜕皮激素与蜕皮激素受体触发昆虫变态的一系列级联反应[18]。蜕皮激素受体最初被认为是蜕皮动物所特有,但现有基因组和转录组数据的分析显示,蜕皮激素受体以及蜕皮激素级联反应相关转录因子同样存在于软体动物,例如,长牡蛎()[19]、青螺()[20]和光滑双脐螺()[21]。Vogeler等[22]研究发现蜕皮激素在长牡蛎()变态前的面盘幼虫中高表达,推测了蜕皮激素在双壳类变态中起到诱导作用。Chelikowsk等[23]在对海湾扇贝()的研究中发现,合成的蜕皮激素与pavlovol(微藻属的一种甾醇,与蜕皮激素结构相似)能够诱导海湾扇贝幼虫的变态。本团队前期的代谢组分析发现蜕皮激素在进入稚贝期后发生下调;并且甾醇激素生物合成通路在幼虫附着期到稚贝期之间被富集[13]。本研究结果显示,适宜浓度的蜕皮激素能够引起马氏珠母贝眼点幼虫附着率上升,进一步证明马氏珠母贝的附着受到蜕皮激素的调控。
GABA是一种重要的抑制性氨基酸类神经递质,它是由谷氨酸经谷氨酸脱羧酶催化脱羧基产生,GABA敏感细胞的去极化可能参与幼体的附着变态,并在多种贝类中发挥作用[24-25]。然而,GABA可能对一些贝类的幼虫产生毒性作用,例如绿唇贻贝()[26];Young等[26]推测该毒性作用是由于GABA受体导致的神经元膜的抑制性超极化。但是GABA在适宜浓度时,其诱导效果显著,且无毒副作用。本研究中,10-5mol/L的GABA处理24、48、72和96 h后,马氏珠母贝眼点幼虫的附着率均显著高于对照组,最高可达对照组的5.5倍。这与诱导西施舌幼虫附着变态的GABA适宜浓度相一致[27]。
嘌呤类物质可以作为一种信号分子影响鱼类与多毛类的生理活动。例如,ATP、ADP、AMP和腺嘌呤核苷可以提高鱼类的食欲,而次黄嘌呤3-N-氧化物可以引起鱼类的回避行为或警惕行为[28-29];嘌呤代谢物尿酸和次黄嘌呤核苷可以分别作为精子和卵子的释放信息素[30-31]。He等[32]研究发现腺嘌呤核苷、次黄嘌呤核苷与次黄嘌呤作为信息素,可以诱导沙筛贝()幼虫的沉降形成聚集,并且三种嘌呤共同作用的诱导效果比单一嘌呤的作用更强,且沙筛贝对特定比例的嘌呤混合物最为敏感。本研究发现腺嘌呤核苷、次黄嘌呤核苷与次黄嘌呤对马氏珠母贝幼虫的附着存在不同程度的诱导作用,推测嘌呤可能作为一种信号分子诱导马氏珠母贝幼虫附着。但是,是否存在诱导幼虫附着的最佳特定比例及嘌呤类化合物是如何引起马氏珠母贝幼虫变态等问题还需要进一步研究。
本研究中,5-HT、蜕皮激素、GABA、腺嘌呤核苷酸、次黄嘌呤核苷酸和次黄嘌呤溶液在适宜的浓度和处理时间均可诱导马氏珠母贝眼点幼虫附着,其中10-5mol/L的5-HT处理24 h对附着率的诱导效果最佳,可达对照组的6.3倍。研究结果为珍珠贝幼虫附着变态研究奠定基础,有助于为高效的商业化苗种培育提供技术支撑。
[1] 杜美荣, 方建光, 毛玉泽, 等. 底栖硅藻生物膜附着基对扇贝幼虫附着和变态的影响[J]. 海洋与湖沼, 2020, 51(1): 125-131.
[2] VELASCO L A, BARROS J. Survival and growth of hatchery-produced postlarvae and spat of the Caribbean scallopsand[J]. Aquaculture Research, 2009, 40(3): 362-375.
[3] 胡冰, 米成志, 闫喜武, 等. 水温及密度对皱纹盘鲍()幼虫运输存活率和变态率的影响[J]. 海洋通报, 2017, 36(3): 320-325.
[4] 梁飞龙, 林伟财, 邓岳文, 等. 换水频率和附着基对大珠母贝育苗效果的影响[J]. 中国农学通报, 2015, 31(29): 33-38.
[5] 蔡雨珊, 张秀坤, 竹攸汀, 等. 海假交替单胞菌()鞭毛蛋白对生物被膜形成及厚壳贻贝附着的影响[J]. 海洋学报, 2021, 43(4): 75-83.
[6] VASQUEZ H E, HASHIMOTO K, YOSHIDA A, et al. A glycoprotein in shells of conspecifics induces larval settlement of the Pacific oyster[J]. PLoS One, 2013, 8(12): e82358.
[7] YANG J L, LI S H, BAO W Y, et al. Effect of different ions on larval metamorphosis of the mussel[J]. Aquaculture Research, 2015, 46(1): 155-162.
[8] 浦舒为, 逯峰, 王佳伟, 等. γ-氨基丁酸、氯化钾和5-羟色胺对羊鲍()幼虫存活、附着和变态的影响[J]. 海洋与湖沼, 2020, 51(3): 541-546.
[9] 王涛, 李琪. 肾上腺素对岩牡蛎幼虫变态的诱导[J]. 水产学报, 2018, 42(11): 1729-1736.
[10] YANG J L, LI S H, LI Y F, et al. Effects of neuroactive compounds, ions and organic solvents on larval metamorphosis of the mussel[J]. Aquaculture, 2013, 396/397/398/399: 106-112.
[11] Galley T H. Induction of metamorphosis and seed attachment in hatchery production of the king scallop(L.) and the blue mussel(L.) [M]. Bangor University (United Kingdom), 2014.
[12] 杨创业, 廖永山, 蔡炜裕, 等. 流沙湾海区不同规格马氏珠母贝氨基酸组成的研究[J]. 广东海洋大学学报, 2017, 37(4): 86-91.
[13] ZHANG J B, XIONG X W, DENG Y W, et al. Integrated application of transcriptomics and metabolomics provides insights into the larval metamorphosis of pearl oyster ()[J]. Aquaculture, 2021, 532: 736067.
[14] YU X J, HE W H, GU J D, et al. The effect of chemical cues on settlement of pearl oyster(Dunker) larvae[J]. Aquaculture, 2008, 277(1/2): 83-91.
[15] WANG X B, BAI Y, HUANG B. Effects of chemical cues on larval survival, settlement and metamorphosis of abalone[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(6): 1261-1265.
[16] 李一峰, 杨金龙, 包卫洋, 等. 人工诱导物影响海洋无脊椎动物幼体附着变态的研究[J]. 海洋科学, 2011, 35(8): 102-107.
[17] ZHAO B, ZHANG S, QIAN P Y. Larval settlement of the silver- or goldlip pearl oyster(Jameson) in response to natural biofilms and chemical cues[J]. Aquaculture, 2003, 220(1/2/3/4): 883-901.
[18] KING-JONES K, THUMMEL C S. Nuclear receptors—a perspective from[J]. Nature Reviews Genetics, 2005, 6(4): 311-323.
[19] VOGELER S, GALLOWAY T S, LYONS B P, et al. The nuclear receptor gene family in the Pacific oyster,, contains a novel subfamily group[J]. BMC Genomics, 2014, 15: 369.
[20] KAUR S, JOBLING S, JONES C S, et al. The nuclear receptors ofand: implications for developing new model organisms[J]. PLoS One, 2015, 10(4): e0121259.
[21] LAGUERRE M, VEENSTRA J A. Ecdysone receptor homologs from mollusks, leeches and a polychaete worm[J]. FEBS Letters, 2010, 584(21): 4458-4462.
[22] VOGELER S, BEAN T P, LYONS B P, et al. Dynamics of nuclear receptor gene expression during Pacific oyster development[J]. BMC Developmental Biology, 2016, 16(1): 33.
[23] CHELIKOWSKY D J, KAPAREIKO D, JEFFRESS D, et al. The microalga Pavlova contains an analog for the hormone ecdysone that promotes metamorphosis of larval bay scallops ()[J]. Connect, 2013: 517-561.
[24] HE J, QI J F, HUANG Y Q, et al. Larval settlement and metamorphosis of the invasive biofouler,, in response to ions and neuroactive compounds[J]. Marine Biology Research, 2017, 13(6): 645-658.
[25] MESÍAS-GANSBILLER C, BENDIMERAD M E A, ROMÁN G, et al. Settlement behavior of black scallop larvae (, L.) in response to GABA, epinephrine and IBMX[J]. Journal of Shellfish Research, 2008, 27(2): 261-264.
[26] YOUNG T, ALFARO A C, ROBERTSON J. Effect of neuroactive compounds on the settlement of mussel () larvae[J]. Aquaculture, 2011, 319(1/2): 277-283.
[27] 高如承, 刘文彪. 几种化学物质对西施舌幼虫附着和变态的诱导技术[J]. 水产学报, 2006, 30(5): 597-602.
[28] WAKISAKA N, MIYASAKA N, KOIDE T, et al. An adenosine receptor for olfaction in fish[J]. Current Biology, 2017, 27(10): 1437-1447.e4.
[29] SHAMCHUK A L, BLUNT B J, LYONS D D, et al. Nucleobase-containing compounds evoke behavioural, olfactory, and transcriptional responses in model fishes[J]. FACETS, 2018, 3(1): 79-102.
[30] ZEECK E, HARDER T, BECKMANN M. Uric acid: the sperm-release pheromone of the marine polychaete[J]. Journal of Chemical Ecology, 1998, 24(1): 13-22.
[31] ZEECK E, HARDER T, BECKMANN M. Inosine, L-glutamic acid and L-glutamine as components of a sex pheromone complex of the marine polychaete(Annelida:)[J]. CHEMOECOLOGY, 1998, 8(2): 77-84.
[32] HE J, DAI Q, QI Y X, et al. Aggregation pheromone for an invasive mussel consists of a precise combination of three common purines[J]. iScience, 2019, 19: 691-702.
Effect of Chemical Cues on Settlement of Pearl OysterEyespot Larvae
YANG Chuang-ye1, ZHANG Jia-bin1, ZENG Ye-tao1, LIAO Yong-shan2, DENG Yue-wen1,3, WANG Qing-heng1,3
(1.// 2.// 3.,524088,)
【Objective】The objective of the present study was to research the effects of 5-Hydroxytryptamine (5-HT), ecdysone, γ-aminobutyric acid (GABA), adenine nucleotides, hypoxanthine nucleotides and hypoxanthine on theeyespot larvae settlement of. 【Method】By studying thetime-course and changes on settlement rate of eyespot larvae after5 treating with different concentrations of 5-HT, ecdysone, GABA, adenine nucleotides, hypoxanthine nucleotides and hypoxanthine.【Result】During the 24−96 h, the settlement of eyespot larvae was induced by 5-HT, ecdysone and GABA showed an overall upward trend. During the 24-120 h, the settlement of eyespot larvae induced by adenine nucleotides, hypoxanthine nucleotides and hypoxanthine showed an overall upward trend. After treatment with 10-5mol/L 5-HT and GABA for 24 h, 48 h, 72 h and 96 h, the settlement rate of eyespot larvae was significantly higher than that of the control group (< 0.01). The 10-5mol/L ecdysone treatment for 24 h and 72 h, 10-6mol/L ecdysone treatment for 24 h and 96 h, and 10-7mol/L ecdysone treatment for 24 h, the settlement rate of eyespot larvae was significantly higher than that of the control group (< 0.01). The 10 μmol/L adenosine nucleotides treatment for 24 h, 48 h, 72 h and 120 h, 1 μmol/L adenosine nucleotides treatment for 24 h, 48 h, 72 h, 96 h and 120 h, the settlement rate of eyespot larvae was significantly higher than that of the control group (< 0.01). The10 μmol/L inosine treatment for 48 h and 72 h, 1 μmol/L inosine treatment for 48 h, 72 h, 96 h and 120 h, the eyespot larval settlement rate was significantly higher than that of the control group (< 0.01). 10 μmol/L hypoxanthine treatment for 72 h, 96 h and 120 h, the eyespot larvae settlement rate was significantly higher than the control group (< 0.01).【Conclusion】With an appropriate concentration and treatment time, 5-HT, ecdysone, GABA, adenine nucleotides, hypoxanthine nucleotides and hypoxanthine solutions could induce eyespot larvae settlement and a 10-5mol/L 5-HT treatment for 24 h presented the best induction effect on eyespot larvae settlement rate, which showed 6.3 times higher than that of control group.
; eyespot larvae; settlement; chemical cues
S917.4
A
1673-9159(2022)01-0029-06
10.3969/j.issn.1673-9159.2022.01.005
杨创业,章佳斌,曾业涛,等. 化学物质诱导对马氏珠母贝眼点幼虫附着的影响[J]. 广东海洋大学学报,2022,42(1):29-34.
2021-08-22
国家自然科学基金(32102817);广东省基础与应用基础研究基金项目(2019A1515111026);广东省农业农村厅项目(2020KJ146和粤财农[2020]4号);广东省教育厅项目(2019KQNCX043和2020ZDZX1045);大学生创新创业训练计划项目(CXXL2020045)
杨创业(1990-),男,博士,讲师,研究方向为无脊椎动物增养殖及珍珠培育。E-mail:yangcy@gdou.edu.cn
邓岳文,教授,研究方向为珍珠贝养殖与育珠。E-mail:dengyw@gdou.edu.cn
(责任编辑:刘岭)
