细胞衰老在糖尿病肾病进展中的作用
2022-01-18张晓良综述审校
张 颖 张晓良 综述 赵 宇 审校
细胞衰老是一种以细胞周期永久性、不可逆性停滞为特征,受各种压力因素诱导的应激反应,这些因素包括DNA损伤、端粒功能障碍、自噬及氧化应激等。细胞衰老扮演双重角色,不仅对生理反应起关键作用,如胎儿发育、组织修复、肿瘤抑制等,还参与慢性阻塞性肺疾病、椎间盘退变及糖尿病等衰老相关性疾病的调控过程[1]。衰老相关性疾病不仅严重影响患者的生活质量,还给社会带来较为昂贵的医疗成本,因此研究细胞衰老在相关疾病中的机制具有重要意义。
糖尿病肾病(DN)是由糖尿病导致的一种慢性肾脏疾病,其发病机制较为复杂,目前认为遗传因素、氧化应激、炎症反应、自噬、晚期糖基化终产物的过度表达和代谢紊乱等多种致病因素参与DN的疾病进展。越来越多证据表明细胞衰老在DN中的发生发展起着关键作用,引起研究者的广泛关注。本文就DN与细胞衰老的相关性研究进展及潜在治疗靶点做一综述。
细胞衰老
细胞衰老的概念细胞衰老包括复制性衰老和压力诱导性早衰。复制性衰老是指端粒随着DNA复制逐渐缩短,最终达到“Hayflick极限[1]”并引发DNA损伤反应,通过p16/RB或p53/p21途径使细胞周期发生停滞的过程,压力诱导性早衰是指由电离辐射、化疗药物等外界各种刺激引发的衰老。
细胞衰老的标志物
细胞形态 衰老细胞会产生形态变化如细胞变扁平,胞体增大,这种变化与波形蛋白细胞骨架的重组有关。波形蛋白细胞骨架在衰老细胞中呈密集束状,在生长活跃的细胞中则表现为不规则网状结构。衰老细胞中溶酶体和线粒体数量增加,并伴有核纤层蛋白B1(lamin B1)不同程度的丢失。
SA-β-gal 衰老相关-β-半乳糖苷酶(senescence-associated-β-galactosidase,SA-β-gal)是目前使用最广泛的衰老生物指标,主要在溶酶体中表达,由于它作为单一检测指标容易产生假阳性,现在人们大多将其与其他标志物联合标记,如脂褐素。脂褐素是与新陈代谢密切相关的新兴指标,来源于苏丹黑B的生物素化合物,对衰老细胞的鉴定具有高度特异性。
衰老相关分泌表型(SASP) 衰老细胞虽然处于周期永久性停滞状态,但仍具有代谢活性。衰老细胞可以产生多种分泌体包括促炎因子如白细胞介素(IL-8)、IL-6、生长因子、趋化因子、基质金属蛋白酶(MMP)等,来维持自身衰老特征,这些分泌体统称为SASP。SASP具有双向作用,一方面激活衰老细胞的免疫清除系统,促进伤口愈合和组织再生,抑制细胞癌变分化。另一方面介导慢性炎症的发生,促进肿瘤细胞的增殖等。衰老细胞还可以通过旁分泌的方式改变周围细胞的微环境,加速其他细胞的衰老[2]。
基因标志物 P21CIP1/WAF1/SDI1和p16INK4A是两种细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)抑制剂,也是p53和Rb调控肿瘤抑制通路的组成部分,在衰老细胞中高度表达。P21CIP1/WAF1/SDI1和p16INK4A通过不同途径导致细胞周期停滞,参与细胞衰老进展。p16INK4A主要通过抑制CDK4/6激酶活性及Rb磷酸化,阻止细胞从G1期进入S期。P21CIP1/WAF1/SDI1是一种p53依赖性蛋白,在应激因子作用下, p53则可以通过介导p21-pRb通路诱导细胞衰老[2]。
细胞衰老与DN
DN肾脏中的衰老细胞新近研究显示,细胞衰老广泛存在于DN的肾组织中。肾活检发现2型糖尿病患者的衰老细胞主要出现在近端小管中,少部分在足细胞,表现为SA-β-Gal和p16INK4A水平的升高,同时肾小球中p16INK4A表达与蛋白尿水平呈正相关[3]。Kitada等[4]研究显示,高浓度葡萄糖可通过钠-葡萄糖共转运蛋白2(SGLT2)和p21途径诱导肾小管上皮细胞的衰老[4]。经ZDF-fa/fa诱导的糖尿病大鼠的足细胞变化表现为形态肥大、足突数量减少、足突间隙增加,并伴随着p21、p27的高表达[5],提示DN与足细胞衰老密切相关。Cao等[6]研究发现高糖可导致肾小球系膜细胞过早衰老,表现为SA-β-gal阳性细胞率增加,端粒长度缩短,细胞周期阻滞于G1期,p53、p21表达增加。在STZ诱导的高糖模型中观察到小鼠肾小球内皮细胞IL-6、单核细胞趋化蛋白1(MCP-1)等衰老表型水平的升高[7]。上述研究结果提示,细胞衰老可在多种肾脏细胞中发生。有研究报道细胞衰老表型出现在DN早期,因此深入研究细胞衰老在DN发病机制中的作用(图1),可为DN的防治提供新的思路。

图1 细胞衰老在DN中的发生机制mTOR:雷帕霉素靶蛋白;SASP:衰老相关分泌表型;DN:糖尿病肾病;Sirtuins:沉默信息调节因子
DN细胞衰老的机制
端粒损伤 端粒是位于真核细胞染色体末端的重复性DNA片段,其长度反映细胞的增殖能力。由于DNA聚合酶不能作用于单链3’末端,因此端粒会随着每一次复制而缩短。端粒缩短到临界点或者发生功能障碍会导致细胞周期停滞。敲除端粒酶基因EST1可以加速酵母细胞的衰老[8],而将端粒酶重新引入到端粒缺失的细胞中能够使寿命延长,提示端粒缩短是细胞衰老的重要因素。体外研究发现,高糖通过激活端粒p53-p21-Rb和JAK/STAT信号通路诱导肾小球系膜细胞的衰老[9]。除肾细胞外,端粒缩短也发生在DN患者外周血白细胞中,白细胞端粒长度不仅与2型糖尿病患者肾小球滤过率(GFR)呈正相关[10],还能预测DN的全因死亡率[11],提示端粒缩短与DN预后密切相关。
线粒体功能障碍 正常生理条件下,线粒体通过连续融合和裂变保持细胞的氧化和抗氧化平衡,维持细胞稳态。伴随着机体老化,线粒体会出现裂变失衡,释放大量活性氧(ROS),引起线粒体外膜破裂、钙过载、DNA损伤等,最终导致细胞凋亡和坏死。线粒体影响细胞衰老与ROS的过量产生有关。ROS增多会破坏线粒体呼吸链中电子传递,诱发大量超氧化自由基形成,而超氧化自由基是加速衰老的重要因素。过量的ROS还会导致线粒体DNA突变,进一步引起端粒功能障碍。Lee等[12]研究发现,抗衰老蛋白Klotho通过保护肾脏线粒体来改善DN,与单独使用高糖处理的肾小管细胞相比,添加Klotho处理的细胞中存在更多的功能性线粒体,同时ROS水平表达降低,线粒体复合物蛋白表达升高,这表明Klotho直接保护高糖暴露下肾小管细胞中的线粒体。通过调控线粒体氧化应激延缓衰老可能为治疗DN带来新希望。
自噬缺陷 细胞自噬是指细胞利用自噬体或自噬溶酶体分解损伤的细胞器、蛋白质等成分,避免有害物质的积累。细胞自噬与生物的生长发育、疾病、衰老等密切相关,随着衰老的进展,细胞表现出自噬水平的减弱,自噬蛋白Atg5、Atg7表达的下调。缺乏Atg5的近端小管表现出线粒体破坏、脂褐素堆积,提示自噬参与衰老的过程。自噬还可以通过炎症、线粒体氧化应激等调控衰老。DN进展过程中,细胞自噬功能也有一定程度的损伤。2型糖尿病患者的肾活检样本观察到p62蛋白在近端肾小管细胞中沉积,表明人类2型糖尿病患者存在自噬缺陷[13]。此外,线粒体自噬还通过参与肾组织细胞M1/M2表型转化在DN中发挥重要作用[14],提示细胞衰老可能介导线粒体自噬参与DN的发生发展。
炎症因子增加 衰老细胞可以分泌多种促炎因子和趋化因子,其中 IL-6、IL-8及MCP-1是SASP的核心组成部分。核因子κB(NF-κB)相关炎症信号通路在调控衰老过程发挥重要作用,NF-κB亚基p50和p105的消融(使NF-κB激活)可导致小鼠端粒功能障碍,加速衰老[15]。炎症的发生也是DN的发病机制之一,在持续高糖状态下,促炎因子如肿瘤坏死因子α(TNF-α)、IL-6、细胞间黏附分子1(ICAM-1)、MCP-1等通过糖基化终末产物(AGEs)和蛋白激酶C(PKC)等通路激活炎症反应,导致肾小球基底膜增厚,肾小球硬化或间质纤维化,引发DN。
雷帕霉素靶蛋白(mTOR)信号通路激活 mTOR是一种丝氨酸-苏氨酸蛋白激酶,调节细胞的生长、蛋白质合成及细胞周期变化,许多动物实验表明mTOR通过NF-κB、STAT3和Akt等信号通路以及自噬参与细胞衰老。研究表明敲除mTOR基因可以延长秀丽隐杆线虫、酵母及果蝇寿命[16]。mTOR抑制剂雷帕霉素通过抑制IL-1α的翻译来减低NF-κB转录活性,调节细胞衰老。在一项前瞻性临床试验中,雷帕霉素可以降低人类皮肤p16INK4A,局部涂抹使皮肤细纹减少,肤色光亮均匀[17]。mTOR可以调控Akt/mTOR通路参与DN的发病机制,一项研究发现高糖能够上调肾小球系膜细胞Akt和mTORC1复合体,导致系膜细胞肥大,加速DN进展[18]。
沉默信息调节因子(Sirtuins)表达减少 Sirtuins是高度保守的NAD+依赖性脱乙酰基酶和ADP-核糖基转移酶,参与哺乳动物多种细胞和机体的调节过程,包括新陈代谢,免疫应答和衰老。人们发现酵母中Sirtuins2(Sir2)表达的降低与酵母老化相关[19]。SIRT1可能调控线粒体氧化物合成影响细胞衰老。Lim等[20]发现,SIRT1可调控自噬以抑制紫外线照射引起的皮肤成纤维细胞衰老。SIRT1对防治DN也有重要作用,SIRT1基因敲除的糖尿病小鼠出现足细胞数量减少,蛋白尿加重[21]。SIRT1水平的上调也可以抑制糖尿病大鼠肾小管上皮细胞向间质转化,延缓DN进展[22]。
凝血因子释放 衰老细胞可以分泌凝血因子,包括纤溶酶原激活物抑制剂1(PAI-1)、尿激酶型纤溶酶原激活剂受体(uPAR)和血小板凝血酶蛋白1(THBS1)等,这些指标都与DN发病相关。随着DN的进展,PAI-1表达水平逐渐升高;减少PAI-1表达可减轻DN小鼠蛋白尿,抑制肾纤维化[23]。Zhou等[24]发现2型糖尿病患者肾脏uPAR水平升高,血清uPAR、IL-18水平与eGFR呈负相关,提示uPAR可用于评估DN患者肾功能。THBS1在DN早期显著增加,并随着疾病进展进一步升高,提示THBS1参与DN进展。
抗细胞衰老治疗在DN的应用
Senolytics药物Senolytics是一类选择性清除衰老细胞的药物,包括达沙替尼和槲皮素(D+Q组合),ABT-263,FOXO4-DRI等。近期研究发现Senolytics在DN患者中具有明显的治疗作用,Mayo Hickson等[25]对11例DN患者使用100 mg达沙替尼+1 000 mg槲皮素3d,11d后患者脂肪、皮肤中表达p16INK4A、p21CIP1及SA-β-gal+的衰老细胞数量减少,血清中IL-1α、IL-6、MMP-9 等SASP水平也相应降低,表明Senolytics药物短期应用可有较清除衰老细胞。Li等[26]发现D+Q组合还可减少小鼠肾小管上皮细胞衰老标志物SA-β-gal、p16、p21及IL-6、MCP-1等炎性因子的表达,提示Senolytics可能延缓DN的进展。
ABT-263通过抑制抗凋亡蛋白B淋巴细胞瘤2(BCL-2)和BCL-XL的活性, 使衰老细胞发生凋亡,发挥抗衰老效应。FOXO4-DRI是一种能够干扰FOXO4蛋白质功能的肽类,它可以竞争性抑制衰老细胞中FOXO4与p53的结合,促使衰老细胞凋亡。
Senomorphics干预疗法Senomorphics干预疗法主要是通过减少SASP的分泌抑制衰老进展,并能同时保持细胞存活,这一类化合物包括二甲双胍,芹菜素,山奈酚和白藜芦醇等。二甲双胍既是2型糖尿病的一线治疗药物,也具有延缓衰老的作用,二甲双胍通过干扰IκB激酶(IKK)/NF-κB活化抑制IL-6、IL-8、趋化因子5(CXCL-5)等SASP表达。研究发现,二甲双胍通过MBNL1/miR-130a-3p/STAT3途径降低DN肾小管上皮细胞SA-β-gal的水平[27]。一项关于2型糖尿病患者的回顾性研究发现,与非二甲双胍使用者相比,二甲双胍使用者全因死亡率及ESRD 进展发生率显著降低,这提示二甲双胍可能有助于改善DN患者的预后[28]。NAD+代谢与细胞衰老密切相关,芹菜素和白藜芦醇可以升高NAD+水平,激活SIRT,发挥抗炎抗氧化特性延缓衰老。Zhang等[29]发现,白藜芦醇可上调高糖环境中足细胞SIRT1的表达,减轻糖尿病小鼠足细胞的氧化应激与凋亡。
热量限制热量限制是指在不造成机体损害的条件下限制热量摄入,是公认的维持健康和延长寿命的有效策略。热量限制已被证实能够延长酵母细胞,秀丽隐杆线虫及老鼠,猕猴等哺乳动物寿命,同时也能延缓糖尿病,慢性肺部疾病,神经退行性病等慢性疾病的进展。热量限制可减少小鼠不同器官及人类结肠黏膜中衰老标志物表达,还可以通过调控ROS、SIRT及mTOR等信号通路延缓细胞衰老。研究显示,对患有2型糖尿病的病态肥胖患者进行热量限制可有效提高其GFR水平,改善肾功能[30]。
其他药物烟酰胺核苷(NR)和烟酰胺单核苷酸(NMN)是NAD+前体补充剂,NR和NMN已被证明在无脊椎动物和小鼠模型中具有抗衰老作用。动物研究发现,经NMN治疗后,糖尿病小鼠尿白蛋白排泄增加程度减弱,同时肾脏中SIRT1表达增加[31]。非甾体类抗炎药(NSAIDs),包括阿司匹林和布洛芬等,其主要靶点为环氧合酶(COX),通过减轻炎症和抗氧化发挥抗衰老作用。阿司匹林可以延长线虫、果蝇及雄性小鼠的寿命。一项包括 76 名DN患者的随机试验表明,与对照组相比,短期使用大剂量阿司匹林(1000 mg)可使蛋白尿发生率降低15.9%[32]。
小结:DN中细胞衰老相关的发病机制包括端粒缩短、线粒体功能障碍、自噬、炎性反应、mTOR信号及Sirtuins激活、凝血因子释放等。这些因素相互作用,协同促进DN细胞衰老的发生发展。深入研究DN与细胞衰老相关的分子机制,有望提供潜在可行的DN治疗思路,例如Senolytics药物、Senomorphics干预疗法、热量限制、NAD+补充剂、非甾体类抗炎药等(图2),但将其应用于DN患者的治疗还需要大量的动物实验和临床研究来证实。在未来的研究中,期望能够发现更多针对与DN相关的细胞衰老的治疗靶点,进一步促进相关药物的研发与筛选,为DN的防治寻找新的切入点。
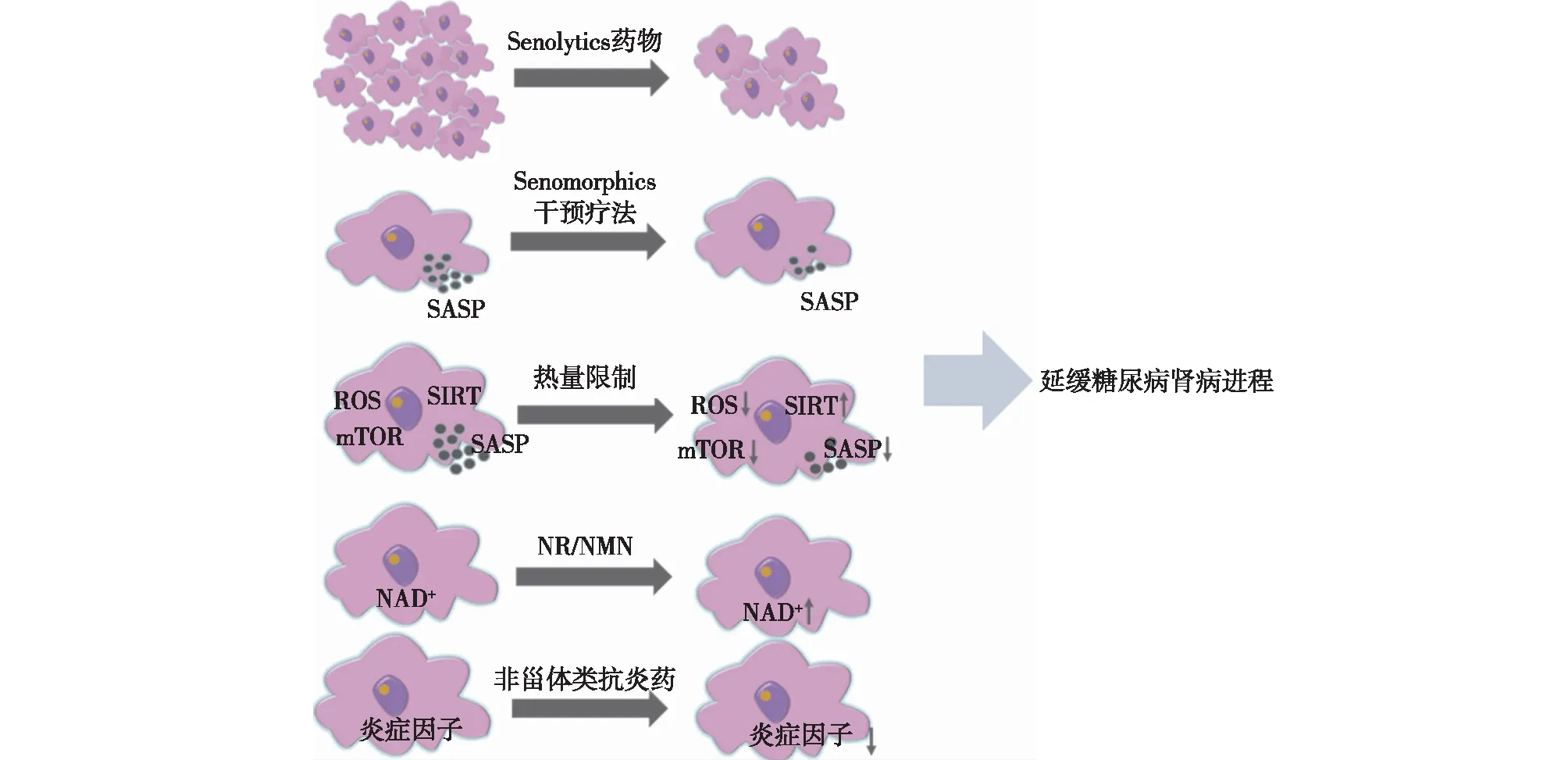
图2 抗细胞衰老治疗在糖尿病肾病中的应用SASP:衰老相关分泌表型;ROS:活性氧;mTOR:雷帕霉素靶蛋白;NR:烟酰胺核苷;NMN:烟酰胺单核苷酸
