沉默血红素加氧酶-1 对急性单核细胞白血病小鼠模型的影响
2022-01-17林晓静赵臻怡陈舒雅王季石
林晓静,赵臻怡,陈舒雅,方 琴,王季石∗
(1.川北医学院附属医院,四川 南充 637000;2.贵州省血液病研究所,贵阳 550004;
3.贵州医科大学附属白云医院,贵阳 550004)
急性髓系白血病(acute myeloid leukemia,AML)是一类造血干/祖细胞恶性克隆性疾病,以血液和骨髓中髓系原始细胞的扩增为特征[1]。 随着化疗及造血干细胞移植的进展,显著提高了AML 的治疗效果,但成人AML 的生存率仍然很低,5 年无病生存率仅为20%~30%[2-4]。 而AML 的预后主要依赖于其细胞遗传学及分子生物学的改变[5],因此寻找AML 标志性分子学研究成为探索靶向治疗的热点之一。
血红素加氧酶-1(heme oxygenase-1,HO-1)是血红素分解代谢过程中的限速酶,是机体重要的氧化调节酶之一。 正常生理条件下,HO-1 主要参与铁的循环利用和维持细胞内环境稳定。 在疾病或应激条件下,HO-1 具有抗凋亡、促增殖及减轻炎症反应的作用[6-7]。 目前已经明确HO-1 在多种实体肿瘤中异常高表达,且与肿瘤发生及发展相关[7]。 在血液疾病肿瘤中,有研究证实,与健康供者CD34+细胞相比,72%的AML 患者CD34+细胞中HO-1 的表达显著升高。 亚组分析发现急性单核细胞白血病(acute monocytic leukemia,French-American-British classification M5)患者中HO-1 的表达水平更高,与正常人相比,其表达可增加8~10 倍[8]。 进一步的研究显示,在AML 患者中,HO-1 的表达与危险分层呈正相关,与生存时间呈负相关[9]。 另外体外实验证实下调HO-1 的表达能够抑制AML 细胞株的增殖、促进其凋亡,且能增强阿糖胞苷等化疗药物的敏感性[8,10-12]。 由此可见,HO-1 有望成为AML 的潜在治疗靶点之一,尤其是M5 亚型,但针对这一亚型,目前尚缺乏体内实验进一步证实。
本研究拟通过慢病毒转染沉默U937 细胞中HO-1 的表达,建立M5 小鼠模型,探索沉默HO-1 的表达对M5 小鼠白血病疾病的影响。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级雌性NOD/SCID 小鼠40 只,体重18~20 g,6~8 周龄,购买于北京华阜康生物科技股份有限公司[SCXK(京)2020-0004],饲养于贵州医科大学动物房SPF 层流柜[SYXK(黔)2018-0001]。 含复合维生素B 的标准颗粒饲料、饮水、垫料及一切与鼠接触的物品经灭菌处理,动物实验室温度保持在25℃左右,相对湿度保持在40%~70%,每日光照12 h,适应性饲养一周。 实验方案符合3R 原则并通过贵州医科大学实验动物伦理委员会(IACUC)审批(2015-046)。
1.1.2 细胞株
人AML 细胞株U937(急性单核细胞白血病,t(10;11)(p13;q14))购买于美国菌种保藏中心。 细胞培养于含10%胎牛血清、100 U/mL 青霉素及100 mg/mL 链霉素的PRMI-1640 培养基中,培养条件为37℃、5% CO2恒温培养箱,细胞悬浮生长,根据生长情况每2~3 d 传代一次。
1.2 主要试剂与仪器
RPMI-1640 培养基、胎牛血清(美国Gibco 公司);青霉素-链霉素双抗、BCA 蛋白浓度试剂盒(碧云天生物技术公司)、anti-human CD13-PE、antihuman CD15-FITC、anti-human CD14-APC、antihuman CD64-FITC 及anti-human CD45-PE-CY(美国eBioscience);HO-1 与β-actin 抗体(美国Cell Signaling Technology 公司);CO2培养箱(美国Forma公司);流式细胞仪(美国Beckman Coulter 公司,型号CytoFLEX);Western bot 电泳仪(美国BIO-RAD公司,型号164-5070)。
1.3 实验方法
1.3.1 重组慢病毒的转染
重组慢病毒包括沉默HO-1 表达的pRNAi-U6.2/Lenti-EGFP-siHO-1 和空载体pRNAi-U6.2/Lenti-EGFP 构建及包装由中国南通百奥迈科公司完成。 将处于对数生长期的细胞以2.5×105个/孔的密度接种于12 孔培养板中,以感染复数(MOI)为10 的标准加入慢病毒上清和聚凝胺(10 μg/mL)。37℃、5% CO2饱和湿度条件下培养24 h,用不含聚凝胺的完全培养基补液。 感染后的72 h,收集部分细胞,荧光显微镜观察绿色荧光。
1.3.2 Western blot 检测蛋白表达
收集不同处理组的U937 细胞,PBS 洗涤2 次,每106个细胞加100 μL 裂解液,冰上裂解30 min,12000 r/min 4℃离心10 min,取上清,BCA 法测定蛋白浓度,按照30 μg/20 μL 的体系加入蛋白及上样缓冲液,沸水浴变性10 min。 SDS-聚丙烯酰胺凝胶电泳法分离蛋白,将分离的蛋白进行电转膜至PVDF 膜上后,5%脱脂奶粉封闭2 h。 然后孵育一抗2 h,回收一抗,TBST 洗涤3 次,每次10 min,室温孵育二抗1 h,TBST 洗膜3 次。 将ECL 试剂盒中的A、B 液按照1 ∶1的比例进行配制,均匀地侵润在PVDF 膜上,在显影仪上显影。
1.3.3 小鼠造模
NOD/SCID 小鼠随机分4 组,每组10 只,将处于对数生长期的不同组U937 细胞(每只小鼠5×106个细胞)经皮下注射到小鼠的腋下。 具体分组如下:空白组—皮下注射生理盐水;U937 组—皮下注射U937 细胞;沉默HO-1 组—皮下注射转染siHO-1慢病毒的U937 细胞;空载体组—皮下注射转染空载体的U937 细胞。
1.3.4 小鼠肿瘤体积的测量
接种处理后,密切观察并记录小鼠皮下包块体积的变化,如出现皮下包块,采用游标卡尺每5 d 检测1 次,计算肿瘤体积,公式为:π/6 长×宽2。
1.3.5 小鼠生存时间的记录
记录小鼠的死亡时间,采用Kaplan-Meier 绘制生存曲线。
1.3.6 小鼠外周血常规及血涂片检测
分别于皮下注射前、注射后的第10、20、30、40、50 天经尾静脉取外周血约100 μL,收集于EDTA 抗凝管中,进行血常规检查计数白细胞、血红蛋白含量和血小板。 另外,若发现白细胞升高,取外周血行吉姆萨-瑞氏染色后,油镜下观察细胞形态,并以空白组小鼠作对照。
1.3.7 流式细胞术检测
取对数生长期的U937 细胞,调整细胞数至(0.5~1)×106/mL,加入人源单克隆抗体,避光15 min 后上机检测。 另外将出现白细胞升高的实验组及同一时间段的空白组小鼠,经过尾静脉取外周血100 μL,并将上述小鼠各处死一只,取其肱骨样本,收集用生理盐水冲出的骨髓液50 μL。 细胞数调至(0.5 ~ 1) ×106/mL,各加入5 μL CD45-PE-CY、CD13-PE、CD14-APC、CD64-FITC,避光15 min 后,流式细胞仪检测。
1.3.8 病理组织学检查
死亡或处死后的各组小鼠,取其皮下包块,生理盐水冲洗,在4%甲醛固定24 h,包埋在石蜡里面做成蜡块,进行切片、铺片和烘片,后采用苏木素-伊红(HE)染色法染色,显微镜下观察结果。
1.4 统计学方法
数据统计分析采用SPSS 23.0 软件。 以平均数±标准差(±s)表示,两组间比较,符合正态分布采用t检验,不符合采用非参数检验。 Kaplan-Meier 绘制生存曲线,并采用log-rank test 分析结果。P<0.05 为差异有统计学意义。
2 结果
2.1 慢病毒转染率及转染效果
Western blot 检测发现U937 细胞中HO-1 在蛋白水平呈高表达,故转染慢病毒沉默HO-1 的表达。转染72 h 后荧光显微镜观察显示U937 细胞的绿色荧光明显增强,阳性转染率在95%以上(图1)。 同时发现转染了siHO-1 慢病毒的U937 细胞中HO-1呈低表达,而空载体组HO-1 的表达无明显变化,从而提示转染成功(图2)。

图1 荧光显微镜观察细胞的慢病毒转染率Note. A, siHO-1 group. B, Vehicle group.Figure 1 Positivity of lentivirus transfections observed by fluorescence microscopy

图2 Western blot 检测细胞转染后HO-1 的表达水平Figure 2 Expression of HO-1 after transfections was detected by Western blot
2.2 M5 小鼠模型的鉴定
与对照组相比,实验组小鼠出现腋下包块(图3),并且白细胞数明显升高(表1),同时外周血涂片查见白血病细胞(图4)。 流式细胞术检测发现U937 细胞表达CD13、CD14、CD64,而与对照组相比,实验组小鼠骨髓液中有一群细胞表达CD13、CD14、CD64(图5)。 上述结果证实成功构建了急性单核细胞白血病小鼠模型。

图3 空白组及实验组腋下包块的比较Note. A, Blank group. B, U937 group. C, siHO-1 group. D,Vehicle group.Figure 3 Comparison of axillary mass between blank group and experimental group

图4 空白组及实验组外周血涂片(吉姆萨-瑞氏染色)Note. A, Blank group. B, U937 group. C, siHO-1 group. D,Vehicle group.Figure 4 Morphology of leukemia cells in the peripheral blood of blank group and experimental group(Wright Giemsa staining)

图5 小鼠骨髓流式细胞图Figure 5 Flow cytometric analysis of the mouse bone marrow cells
2.3 M5 小鼠模型的肿块形成
沉默HO-1 组小鼠出现皮下肿块所需的平均时间明显长于U937 组及空载体组(32.6±4.87 d vs 18.3±2.82 d vs 19.4±2.93 d)(图6)。 在肿块形成后的相同时间点,与U937 组及空载体组相比,沉默HO-1 组小鼠的肿块体积明显缩小(图7)。 形成肿块后第20 天处死小鼠,病理结果证实U937 及空载组小鼠瘤组织重度生长,浸润周围横纹肌,横纹肌重度变性、坏死,而沉默HO-1 组小鼠瘤组织中度生长,浸润周围横纹肌,横纹肌中度变性、坏死(图8)。

图6 M5 小鼠模型成瘤的时间Figure 6 Tumor formation time in M5 xenograft mouse model
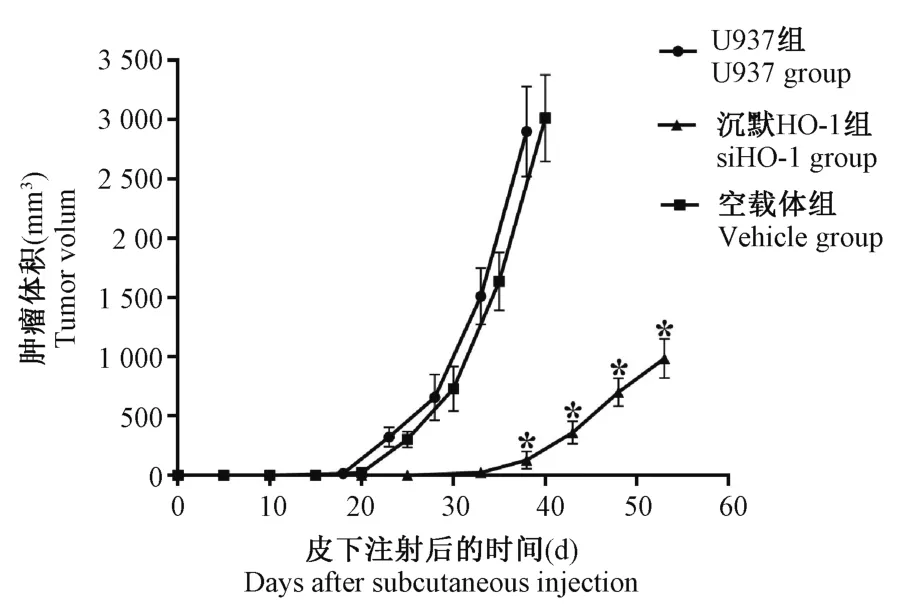
图7 M5 小鼠模型成瘤后的肿瘤体积Note. Compared with the siHO-1 group, ∗P<0.05.Figure 7 Tumor volume after tumor formation in M5 xenograft mouse models
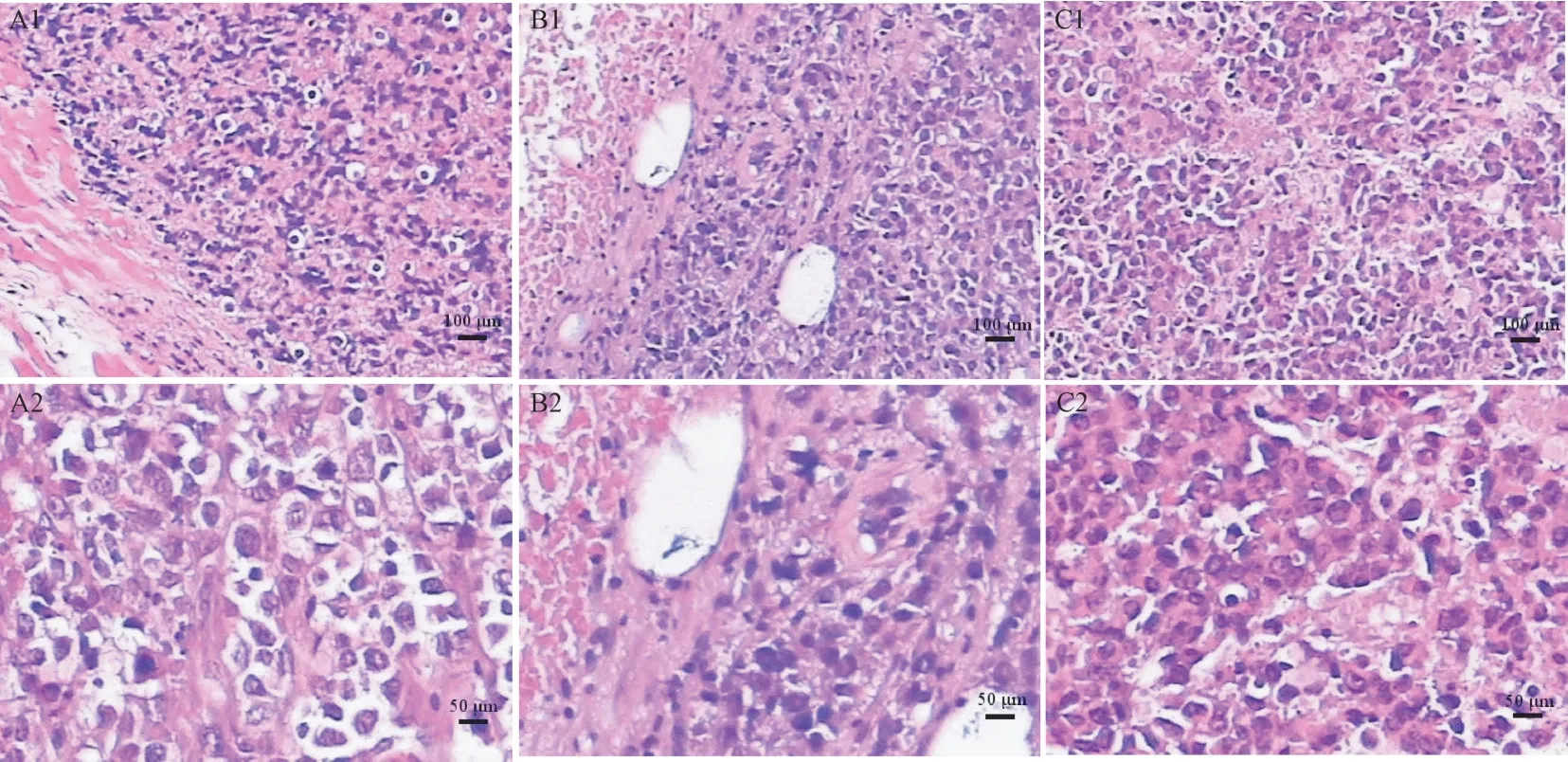
图8 M5 小鼠模型的皮下肿块病理形态Note. A1, U937 group. A2, U937 group. B1, siHO-1 group. B2, siHO-1 group. C1, Vehicle group. C2, Vehicle group.Figure 8 Pathological morphology of subcutaneous mass in M5 xenograft mouse models
2.4 M5 小鼠模型的血细胞计数
与空白组相比,第30 天,U937 组及空载体组小鼠外周血白细胞计数显著升高,且随着时间延长进行性上升,而第50 天,才发现沉默HO-1 组小鼠白细胞数升高(表1)。 相反,第30 天,高表达HO-1 组小鼠外周血血小板计数明显下降,随着时间延长,下降更明显,而沉默HO-1 组却第50 天才下降(表2)。 与空白组相比,第50 天,U937 组及空载体组小鼠外周血血红蛋白的含量明显下降,但沉默HO-1组血红蛋白未见显著变化(表3)。 U937 组及空载体组组间比较,白细胞数、血小板计数及血红蛋白含量差异均无统计学意义(P>0.05)。
表1 各组小鼠外周血白细胞计数的变化(±s,×109/L,n=6)Table 1 Changes in peripheral blood white blood cell counts of mice in each group

表1 各组小鼠外周血白细胞计数的变化(±s,×109/L,n=6)Table 1 Changes in peripheral blood white blood cell counts of mice in each group
注:与空白组比较,∗P<0.05,∗∗P<0.001。Note. Compared with the blank group, ∗P<0.05,∗∗P<0.001.
组别Groups注射前Before第10 天10th day第20 天20th day第30 天30thday第40 天40th day第50 天50th day空白组Blank group 2.94±0.85 2.90±0.53 3.11±0.51 2.95±0.73 3.15±0.61 3.04±0.47 U937 组U937 group 3.07±0.63 2.94±0.55 3.32±0.41 4.56±0.53∗ 9.12±1.09∗∗ 14.31±2.27∗∗沉默HO-1 组siHO-1 group 2.80±0.68 2.98±0.57 2.95±0.79 3.01±0.62 3.09±0.68 4.24±0.71∗空载体组Vehicle group 2.91±0.73 3.06±0.69 2.93±0.73 4.15±0.58∗ 9.51±1.51∗∗ 15.75±1.55∗∗
表2 各组小鼠外周血血小板计数的变化(±s,×109/L,n=6)Table 2 Changes of peripheral blood platelets counts in each group

表2 各组小鼠外周血血小板计数的变化(±s,×109/L,n=6)Table 2 Changes of peripheral blood platelets counts in each group
注:与空白组比较,∗P<0.05,∗∗P<0.001。Note. Compared with the blank group, ∗P<0.05,∗∗P<0.001.
组别Groups注射前Before第10 天10th day第20 天20th day第30 天30thday第40 天40th day第50 天50th day空白组Blank group 509.50±93.65 521.23±69.81 508.34±62.44 514.51±93.14 503.50±76.85 517.17±69.75 U937 组U937 group 504.67±73.71 512.83±78.65 518.68±85.67 333.76±74.15∗ 289.83±57.76∗ 181.17±55.15∗∗沉默HO-1 组siHO-1 group 511.83±73.90 505.01±63.12 499.00±74.09 501.83±60.84 496.10±79.22 376.67±68.38∗空载体组Vehicle group 499.67±70.14 515.33±88.98 495.67±50.84 378.35±67.75∗ 310.41±49.30∗ 173.03±58.59∗∗
表3 各组小鼠外周血血红蛋白的变化(±s,g/L,n=6)Table 3 Changes of peripheral blood hemoglobin in each group
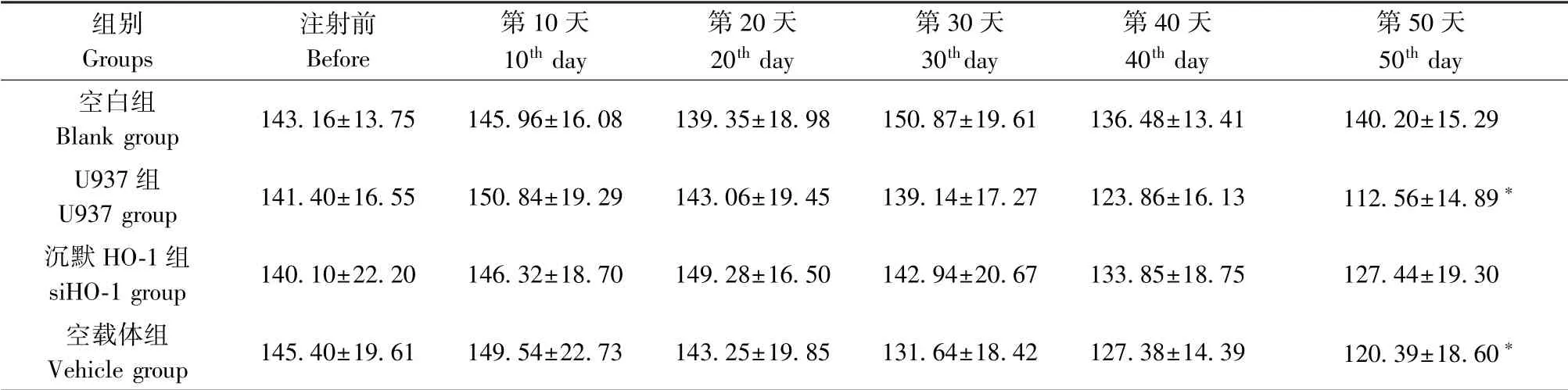
表3 各组小鼠外周血血红蛋白的变化(±s,g/L,n=6)Table 3 Changes of peripheral blood hemoglobin in each group
注:与空白组比较,∗P<0.05。Note. Compared with the blank group, ∗P<0.05.
组别Groups注射前Before第10 天10th day第20 天20th day第30 天30thday第40 天40th day第50 天50th day空白组Blank group 143.16±13.75 145.96±16.08 139.35±18.98 150.87±19.61 136.48±13.41 140.20±15.29 U937 组U937 group 141.40±16.55 150.84±19.29 143.06±19.45 139.14±17.27 123.86±16.13 112.56±14.89∗沉默HO-1 组siHO-1 group 140.10±22.20 146.32±18.70 149.28±16.50 142.94±20.67 133.85±18.75 127.44±19.30空载体组Vehicle group 145.40±19.61 149.54±22.73 143.25±19.85 131.64±18.42 127.38±14.39 120.39±18.60∗
2.5 M5 小鼠模型的生存情况
成瘤后的小鼠逐渐出现翘毛、弓背、萎靡少动等表现,随着时间的延长,出现步态不稳、濒死。 与U937 组及空载体组相比,沉默HO-1 组小鼠的生存时间明显延长(P= 0.004),但U937 组与空载体组相比,两组模型小鼠的生存时间差异无显著学意义(P= 0.1836)(图9)。
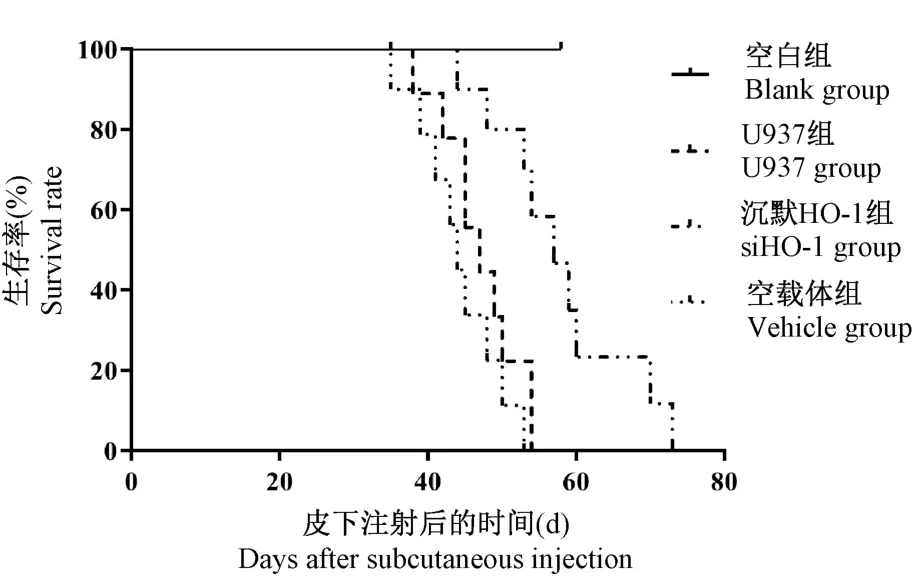
图9 各组小鼠的生存曲线Figure 9 Survival curves of mice in each group
3 讨论
先前的研究表明HO-1 在M5 患者中的表达水平更高[8-9],且我们课题组前期已经证实M5 细胞株U937 及THP-1 中HO-1 在mRNA 及蛋白水平的表达均显著高于Kasumi-1、HL-60 及NB4 等其它AML亚型的细胞株[8,13]。 在体外实验中,已经证实HO-1能够抑制U937 细胞的凋亡及促进其增殖,且与化疗药物耐药有关[8,12]。 但由于体内受细胞因子、生长因子等微环境的影响,HO-1 是否影响M5 疾病的进展,这就需要建立动物模型进一步验证。 故本研究通过慢病毒转染U937 细胞株沉默HO-1 的表达,并采用不同处理组的U937 细胞皮下注射至NOD/SCID 小鼠的腋下,建立M5 小鼠模型,进一步探索沉默HO-1 的表达对M5 小鼠模型白血病疾病的影响。
目前国内大多采用SCID 及NOD/SCID 小鼠建立动物肿瘤模型[14-15],本实验使用NOD/SCID 小鼠进行造模,不但发现接种U937 细胞的NOD/SCID小鼠成瘤率为100%,而且外周血查见白血病细胞,同时小鼠骨髓液中发现一群异常细胞,其抗原表达与U937 细胞相似,证实M5 小鼠模型构建成功,这与之前的报道一致[16]。 NOD/SCID 小鼠成瘤率高,小鼠的发病率稳定,是因为该小鼠既保留了SCID小鼠T、B 淋巴细胞功能缺陷的特点,同时还具有NK 细胞活性很低、无循环补体、巨噬细胞和APC 细胞功能损害的特性,而且这种小鼠很少出现淋巴细胞免疫功能恢复[17-19]。
与U937 及空载体组,也就是高表达HO-1 组相比,沉默HO-1 组的M5 小鼠模型出现皮下肿瘤所需时间明显延长、肿瘤生长较缓慢、肿瘤体积较小、肿瘤对周围组织的浸润程度较轻、外周血白细胞计数升高及血小板下降的速度更慢,且小鼠的生存时间显著延长,这些数据表明沉默HO-1 可抑制M5 小鼠模型白血病的进展,进一步证实了HO-1 在AML 中体外实验的结果[8,13],HO-1 有望成为M5 的潜在治疗靶点之一。 HO-1 药物抑制剂的研发早已成为了热点,其中锌原卟啉-IX(Zinc protoporphyrin-IX,ZnPPIX)的有效性已经在动物模型中得到验证,如能显著抑制肝癌大鼠模型、肉瘤及肺癌小鼠模型的肿瘤生长[20-21]。 由于ZnPPIX 不能被生理盐水溶解,这就需要研发新的水溶性HO-1 抑制剂,如聚乙二醇-共轭ZnPPIX(Polyethyleneglycol-conjugated ZnPPIX,PEG ZnPPIX)。 PEG-ZnPPIX 的血药浓度约为非聚乙二醇化ZnPPIX 的40 倍,更重要的是,它选择性地抑制肿瘤中HO-1 的活性[22]。 更加鼓舞人心的是发现PEG-ZnPPIX 可以抑制CD34+AML 祖细胞的增殖,并在小鼠模型中得到证实[23]。 由此可见,HO-1 抑制剂有望运用于AML 患者中,尤其是M5 这一亚型中。
U937 细胞仅是M5 细胞株的一种,并不能完全代表M5 疾病的发展,这就需要采用多种细胞株建立小鼠模型验证,最好建立人源肿瘤异种移植模型(Patient-Derived tumor Xenograft,PDX)[24],此为本研究的不足之处,拟下一步构建PDX 模型进一步验证,并进行机制研究。
综上所述,体内实验证实HO-1 的高表达加速了M5 小鼠模型的白血病进展,相反沉默HO-1 的表达可减缓白血病疾病的进展,进一步为M5 靶向治疗提供了一定的理论依据。
