糖原贮积症0 型斑马鱼疾病模型的构建及表型分析
2022-01-17姣霍锦倩刘姣陈洁祖尧张庆华任建峰
黄 姣霍锦倩刘 姣陈 洁祖 尧张庆华任建峰∗
(1.上海海洋大学 科技部海洋生物科学国际联合研究中心,上海 201306;2.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;3.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306)
糖原是由葡萄糖结合而成的一种支链动物淀粉多糖,被作为能量代谢葡萄糖单位的储存库[1-2],主要储存在心脏、肌肉和肝。 糖原贮积症(glycogen storage disease, GSD)是一组常染色体遗传疾病,患者糖原合成或分解正常代谢受到影响,而引起的疾病[3],主要表现为肌肉、心脏、脑和肝中糖原代谢异常[4]。 根据缺陷的酶和影响的组织至少可分为16种类型[5]。 GSD 的临床表现缺乏特异性,累及骨骼肌主要表现为肌无力、运动不耐受、肌痛、肌溶解和萎缩,累及心肌表现为心肌病,累及肝主要表现为低血糖和肝肿大[4]。
哺乳动物糖原合酶(glycogen synthase, GYS)有两种亚型,即肌型糖原合酶和肝型糖原合酶,分别由GYS1 和GYS2 基因编码[1],GYS基因表达具有组织特异性,GYS1 主要在骨骼肌和心肌表达,此外还在脑、肾和脂肪组织中表达[6],而GYS2 则在肝中特异性表达[7]。 肌糖原主要作用是为肌肉收缩运动提供能量。 肝糖原主要作用是维持血糖平衡,当没有足够的葡萄糖时,肝糖原转化为葡萄糖,释放到血液中,防止低血糖[8]。 人类GYS2 基因突变会导致肝糖原合成失败,而GYS1 基因突变则会导致肌糖原合成失败,两者突变导致的糖原贮积症疾病分别称为GSD0a 型和GSD0b 型[9]。
GSD0 型疾病自1963 年Lewis 发现以来,临床病例报道不足40 例,主要是GSD0a 型,GSD0b 型病例非常少。 一例GSD0b 型病例报道,三兄妹GYS1基因发生无义突变(R462X),10.5 岁的哥哥在户外运动时死于心脏骤停,尸检报告显示为肥厚性心肌病;2 年后,死者的弟弟出现同哥哥相似的肥厚性心肌病症状、并伴有运动时心率和血压异常等症状[10]。 另一GSD0b 型病例报道,一女儿童患者5岁开始反复发作晕厥,并伴有肌肉无力和疼痛症状,12 岁时死于心脏骤停[2]。
GSD 病由基因突变所致,所以缺乏有效的治愈方法和手段,目前主要通过饮食管理和康复训练等措施干预,缓解疾病症状,避免低血糖、高乳酸血症、高尿酸血症和高脂血症等的发生[9]。 GSD0 疾病模型基础研究上,Pederson 等[1]构建了Gys1 基因敲除小鼠模型,该小鼠肌肉和心脏等组织缺乏糖原储备,90%的小鼠出生后死于心功能受损,其心脏整体变小。 Xirouchaki 等[11]构建了肌肉特异性Gys1基因敲除小鼠,该小鼠肌肉中Gys1 基因mRNA 和蛋白浓度降低85%以上,糖原含量下降70%,餐后高血糖和葡萄糖耐量下降;在胰岛素刺激下,该小鼠的葡萄糖代谢和肌肉葡萄糖摄取下降,运动和耐力也明显下降。 Irimia 等[12]构建了肝特异性Gys2 基因敲除小鼠,该小鼠能够存活,肝糖原合酶发生缺陷,肝糖原含量下降了95%,并出现了轻微的低血糖症状,该模型很好地模拟了GSD0a 病理生理学。
斑马鱼(Danio rerio)具有世代周期短、子代多、胚胎透明、易进行实验操作等优点,已成为继小鼠之后研究器官发育及疾病模型构建等的一种新型模式动物[13]。 本研究利用CRISPR/Cas9 技术成功构建了斑马鱼gys1 和gys2 突变体,期望通过斑马鱼糖原贮积症模型的建立,为进一步研究糖原贮积症的发病机制和详细进程提供材料。
1 材料和方法
1.1 实验动物
斑马鱼野生型AB 品系购自中国科学院分子细胞科学卓越创新中心斑马鱼平台,养殖在循环水系统中,水温26℃~28℃,光照周期为14 h 明/10 h暗。 受精后5 d 的幼鱼开始投喂草履虫,受精后15 d 的幼鱼开始投喂丰年虫。 所有实验均按照上海海洋大学动物伦理委员会的规定(SHOU-DW-2016-001)进行操作。
1.2 主要试剂与仪器
gRNA 骨架体外转录模板pUC19-scaffold 质粒由北京大学熊敬维教授惠赠;MAXIscript® T7 体外转录试剂盒(Ambion, AM1314)购自赛默飞世尔科技公司;NLS-Cas9-NLS 蛋白(GenScript, Z03389-100)购自南京金斯瑞生物科技有限公司;T7EI 内切酶(NEB, M0302L)和Phusion® 高保真PCR 反应预混液(NEB, M0531L)购自NEB(北京)有限公司;PrimeScriptTM反转录试剂盒(TaKaRa, RR047A)购自大连宝生物公司;LightCycler® 480 SYBR Green I荧光定量PCR 反应液(Roche, 04887352001)购自罗氏生命科学公司;糖原PAS 染色液试剂盒(G1281)购自北京索莱宝科技有限公司。
体式显微镜(SteREO Discovery. V8)和正置荧光显微镜(Axio Imager2)均为Zeiss 公司产品;微量注射泵(PLI-100A Plus)为美国Warner Instruments公司产品;实时荧光定量PCR 系统(LightCycler®480II)为罗氏生命科学公司产品。
1.3 实验方法
1.3.1 基因敲除靶点设计和gRNA 合成
从Ensembl 斑马鱼数据库(http:/ /asia.ensembl.org/Danio_rerio/Info/Index)下载gys1 和gys2 基因组序列。 利用zifit 网站(http:/ /zifit.partners.org/ZiFiT/),在尽量靠近起始密码子ATG 的外显子序列上搜索靶点位置,所有靶点序列与斑马鱼基因组序列进行BLAST(https:/ /blast.ncbi.nlm.nih.gov/Blast.cgi)比对,选择序列特异性好的靶点。
利用T7 启动子体外转录合成靶点gRNA。分别利用gys1 上游引物: 5’-TAATACGACTCACT ATAGGGCTTCACGGCCTGGTCTC GTTTTAGAGCTAG AAATAGC-3’,gys2 上游引物: 5 ’-TAATACG ACTCACTATAGGAACCTGGACCGCTGGAAG GTTTTA GAGCTAGAAATAGC-3’;和下游通用引物: 5’-AAAAAAAGCACCGACTCGGTGCCAC-3 ’,扩增pUC19-scaffold 质粒。 然后以PCR 产物作为模板,体外转录合成靶点gRNA。
1.3.2 基因敲除F0嵌合体的制备
进行繁殖的亲本纯合子筛选。 其实验步骤如下,选取性成熟的野生型斑马鱼雌雄各10 尾,利用碱裂解法提取尾鳍组织基因组DNA,利用靶点上下游引物(表1)扩增PCR,扩增产物进行测序分析。所有检测个体序列一致的亲本为纯合子。
在受精卵1 细胞期进行显微注射并进行基因敲除效率的检测。 将1 nL Cas9 蛋白和gRNA 的混合物(800 ng/μL:100 ng/μL)注射入受精卵。 注射组和对照组胚胎置于培养箱中孵化,温度保持在28.5℃。 取2 dpf(days post fertilization)的胚胎(混合5 枚胚胎为1 组,取3 组平行样品),采用碱裂解法提取基因组DNA,利用表1 引物进行PCR扩增,然后进行敲除效率检测。 25 μL PCR 反应体系如下, DNA 模板2.0 μL,上下游引物各1.0 μL,2×Easy Taq® PCR 反应预混液12.5 μL,ddH2O 补齐至25 μL。 PCR 反应程序如下:94℃预变性3 min;94℃30 s,60℃30 s,72℃40 s,共33 个循环,72℃再延伸5 min。

表1 靶点及检测引物序列信息Table 1 Information of target sites and detecting primer sequences
分别采用T7E1 酶切法和Sanger 测序法检测基因敲除效率。 首先,将PCR 产物进行T7E1 酶切,然后进行电泳分析。 根据电泳条带灰度值,参照公式100×(1-sqrt(1-(b+c)/(a+b+c)))估算基因敲除效率,a 为未切开条带灰度值,b 和c 分别为切开条带的灰度值[14]。 通过Sanger 测序法进一步确认基因敲除是否成功,将酶切成功的PCR 产物测序,若靶点处及以后出现套峰,则证明基因敲除成功。
1.3.3 纯合突变体的筛选及表型分析
F1基因突变类型筛选。 将性成熟的F0成鱼与野生型成鱼进行外交获得F1,待F1达到2 月龄时,采用同基因敲除效率检测的流程,进行F1基因突变类型筛选。 提取F1尾鳍基因组DNA,进行PCR 扩增和产物T7E1 酶切,酶切成功的PCR 产物进行TA克隆测序,确定每尾F1基因突变类型,并筛选发生移码突变的个体。
F2纯合突变体筛选。 将具有相同突变类型的F1杂合子成鱼进行内交,获得不同突变类型的F2。采用同基因敲除效率检测的流程,进行F2个体基因型鉴定。 提取F2成鱼尾鳍基因组DNA,进行PCR扩增,并将产物进行T7E1 酶切分析。 产物切开对应的个体为杂合子,产物未切开对应的个体为野生型或纯合突变体,将产物未切开对应的个体通过测序进一步确定其基因型。 F2纯合突变体内交获得F3,仔细观察F2和F3表型。
1.3.4 突变体糖原累积情况检测
通过PAS 染色法检测糖原在组织中的累积情况。 收集野生型和纯合突变体成鱼的心脏、肌肉和肝组织,用10%福尔马林固定24 h 后进行石蜡切片。 按照试剂盒使用说明进行糖原染色操作。 石蜡切片染色后进行逐级乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察并拍照。
1.3.5 不同发育时期和不同组织基因表达分析
对胚胎或幼鱼不同发育时期和成鱼不同组织的gys1 和gys2 基因表达水平进行检测。 选取斑马鱼胚胎或幼鱼早期发育的15 个时期和野生型成鱼的12 个组织,包括脑、眼睛、鳃、心脏、肌肉、皮肤、肝、脾、肠、肾、卵巢和精巢,进行基因表达水平分析,每种样品取3 个生物学重复。 利用TRIzol 法提取所有样本总RNA 备用。
将总RNA 反转录获得cDNA,利用NCBI 网站在线程序设计gys1 和gys2 基因qRT-PCR 引物,引物序列见表2,使用罗氏LightCycler® 480II 荧光定量PCR 进行基因表达量分析。 内参基因选择斑马鱼β-actin,基因相对表达量采用2-ΔΔct法计算,基因表达图利用Graphpad prism5 软件绘制。
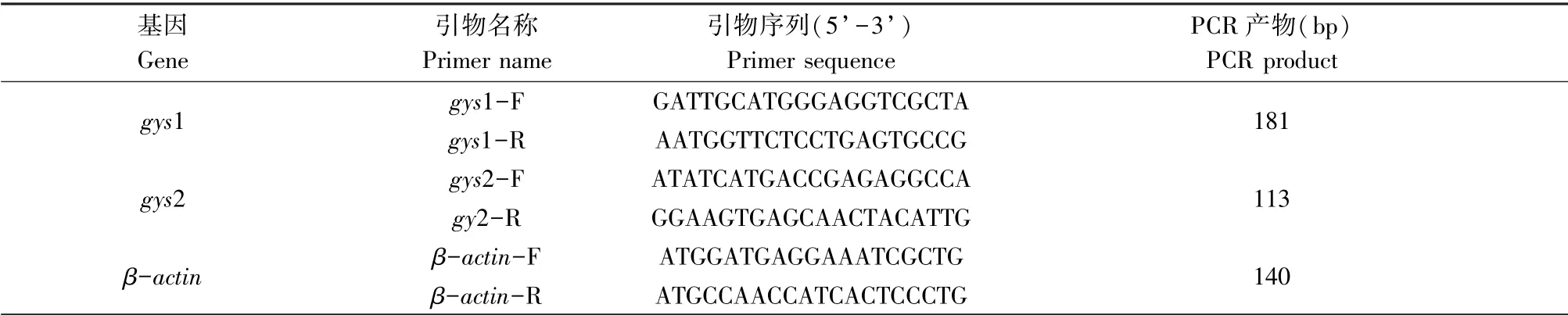
表2 qRT-PCR 引物序列Table 2 Primer sequences for qRT-PCR
2 结果
2.1 基因敲除靶点设计及序列分析
分别在gys1 和gys2 基因外显子上设计一个靶点,gys1 的正向靶点位于基因第4 个外显子上(图1a),gys2 的正向靶点位于基因的第3 个外显子上(图1b)。 将斑马鱼gys1 和gys2 基因编码蛋白序列与小鼠及人类同源基因编码的蛋白序列进行相似性分析。 结果显示,GYS 蛋白序列在人、小鼠和斑马鱼3 物种中高度保守(图1c~1d),斑马鱼Gys1 与小鼠和人蛋白的氨基酸序列一致性达到92%,斑马鱼Gys2 与小鼠和人蛋白氨基酸序列一致性达到89%。

图1 斑马鱼gys1 和gys2 基因敲除靶点示意图及编码蛋白序列相似性分析Note. (a-b), The gene structures of gys1 and gys2 and the sequences and locations of the target sites. The red box indicates the Cas9 protein recognized PAM (protospacer adjacent motif)region. (c-d), The alignment of amino acid sequences of GYS1 and GYS2 between human, mouse, and zebrafish.Figure 1 Schematic diagram of target sites of gys1 and gys2 and the sequence alignment of GYS1 and GYS2 between human, mouse and zebrafish
2.2 F0 嵌合体基因敲除效率检测
混合F0胚胎基因敲除效率T7E1 酶切法检测结果显示,gys1 基因编辑3 组平行实验的敲除效率分别是66%、55%和53%(图2a),gys2 基因编辑3组平行实验的敲除效率分别是0%、56%和63%(图2c)。 酶切成功的PCR 产物进一步通过Sanger 测序法检测,结果显示靶点处及以后出现套峰现象(图2b、2d),表明基因敲除成功。
图2 斑马鱼gys1 和gys2 基因敲除T7E1 酶切检测和Sanger 法测序检测Note.(a), The assay of knockout efficiency for gys1 by T7E1 enzyme digestion.(b),The assay of knockout for gys1 by Sanger sequencing. (c),The assay of knockout efficiency for gys2 by T7E1 enzyme digestion. (d), The assay of knockout for gys2 by Sanger sequencing. The boxes indicate the target sites and PAM sites, respectively.Figure 2 Gene knockout of gys1 and gys2 assayed with T7E1 digestion and Sanger sequencing in zebrafish
2.3 纯合突变体F2 的筛选
将基因编辑引起突变的F0与野生型外交获得F1,在约2 月龄时,通过T7E1 酶切检测的方法筛选F1杂合子。 在54 尾gys1 F1中筛选到28 尾杂合子(图3a),在54 尾gys2 F1中筛选到19 尾杂合子(图3b)。 F1杂合子通过TA 克隆测序的方法筛选有效基因突变类型,gys1 杂合子筛选出4 种有效突变类型(图3c),gys2 杂合子筛选出3种有效突变类型(图3d)。
分别将gys1 两种突变类型(-7 bp 和+13,-2 bp)和gys2 两种突变类型(-4 bp 和+4,+19,+17 bp)F1内交获得F2。 对F2个体基因型和数目进行统计分析,结果显示,野生型、杂合型和纯合型3种基因型存活个体数量比例接近1 ∶2 ∶1,卡方检验分析无显著性差异(表3),符合孟德尔分离定律,表明gys1 和gys2 F2纯合子不存在胚胎致死表型。

表3 gys1 和gys2 不同基因型F2 个体数目卡方检验分析Table 3 Chi-square test of different genotypes of gys1 and gys2 F2
gys1 和gys2 基因分别编码700 和703 个氨基酸。gys1 两种突变类型纯合子基因编码的蛋白分别截短至267 和124 个氨基酸。gys2 两种突变类型纯合子基因编码的蛋白分别截短至164 和194 个氨基酸(图3e~3f)。

图3 斑马鱼gys1 和gys2 突变体F1 和F2 筛选及突变类型Note.(a), T7E1 screening of gys1 F1heterozygotes.(b), T7E1 screening of gys2 F1 heterozygotes.(c-d), The mutation type of gys1 and gys2 detected by Sanger sequencing.(e-f), The schematic diagrams showing the truncated proteins of two mutation type of gys1 and gys2 genes.Figure 3 Screening of heterozygous F1 and homozygous F2 of gys1 and gys2 and the representation of mutation type andtruncated protein sequences
2.4 纯合子F2 及其后代F3 表型分析
与野生型相比,gys1 和gys2 两种突变类型的F2纯合子在生长发育过程中未发现异常表型。gys1-/-F2自交后代F3早期胚胎发育缺陷,48 hpf 内全部死亡,而gys2-/-F2自交后代F3发育正常。 对野生型和gys1-/-F3早期胚胎发育7 个时间点(0、6、12、24、30、36 和48 hpf)胚胎存活和死亡数量进行统计。结果显示,野生型胚胎发育至24 hpf 后不再死亡,而gys1-/-F3胚胎至48 hpf 内全部死亡,且死亡数量主要集中在0 ~ 24 hpf 时间段内(图4a ~ 4b)。 对gys1-/-F3与野生型胚胎24 hpf 内重要发育时期比较发现,与野生型相比,gys1-/-F3胚胎从0.5 hpf 开始发育延迟;8 hpf 时候,相对野生型延迟发育约2 h;24 hpf 时候,相对野生型延迟发育约3 h(图4c)。
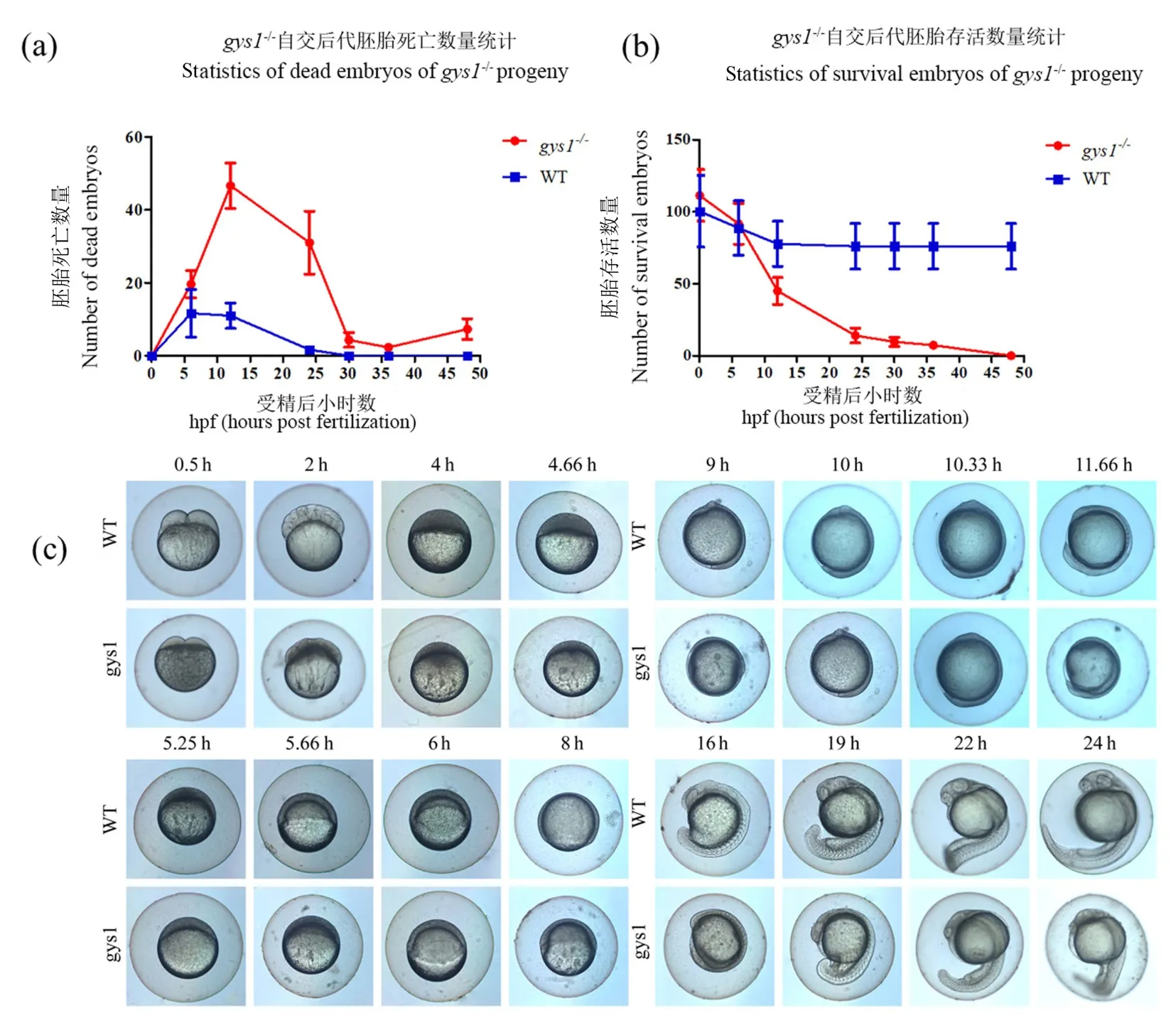
图4 gys1-/-纯合子F2 及其后代F3 表型分析Note.(a), The statistics of dead embryos of gys1-/- F3 and WT during the period from 0 to 48 hpf. (b), The number of survival embryos of gys1-/- F3 and WT during the period from 0 to 48 hpf. (c), Observation of embryonic development of F3 and WT during 0~24 hpf.Figure 4 Phenotypic analysis of gys1-/- F2 and their offspring F3
2.5 gys1 和gys2 早期发育阶段表达模式分析
gys1-/-内交产生的后代胚胎发育异常,推测gys1 基因在斑马鱼胚胎发育中发挥重要的作用。因此,利用qRT-PCR 技术检测了gys1 和gys2 基因早期发育阶段表达情况,结果显示,gys1 基因在早期发育过程中呈现先下降再升高的趋势,且在1细胞期表达量最高,尾芽期(bud stage)和12 hpf降到最低,然后升高,125 hpf 时达到1 细胞期30%(图5a);gys2 与gys1 表达模式相似,但是gys2 的表达量低于gys1 表达量,约为gys1 表达量的一半(图5b)。

图5 gys1 和gys2 基因在野生型斑马鱼早期发育阶段表达模式Figure 5 The expression pattern of gys1 (a)and gys2 (b)during early developmental stages
2.6 gys1 和gys2 组织表达谱和糖原染色分析
对成鱼不同组织gys1 和gys2 基因表达情况进行了定量分析,结果显示gys1 在所有组织中均有表达,其中在肌肉组织中的表达量最高(图6a);而gys2 肝中表达最高,是其它组织表达量的50~100倍(图6b)。
对gys1 和gys2 突变体与野生型的糖原染色分析显示,与野生型相比,gys1-/-心脏和肌肉中没有明显糖原累积,而肝却没有明显差别;gys2-/-肝中糖原累积量显著降低,而心脏和肌肉没有明显变化(图6c)。

图6 gys1 和gys2 基因在野生型成鱼组织表达谱及突变体组织糖原染色Note. (a-b), The expression pattern of gys1 and gys2 in different adult tissues of WT zebrafish. (c), The comparison of glycogen storage in heart,muscle and liver tissues between WT and mutants of gys1-/- and gys2-/- through PAS staining. The red asterisk indicates glycogen storage.Figure 6 Expression pattern of gys1 and gys2 in different adult tissues of WT zebrafish and PAS staining of different mutant tissues
3 讨论
动物疾病模型的构建对于研究人类疾病的发病机理和药物筛选具有重要作用。 基因编辑技术是一种精准、快速的人工基因突变技术手段。 基因编辑技术主要经历了3 个技术发展阶段,分别是锌指核酸酶(ZFNs, zinc-finger nucleases)、转录激活因子样效应物核酸酶( TALENs, transcription activator - like effector nucleases ) 和 CRISPR(Clustered regularly interspaced short palindromic repeats)技术[15]。 其中,CRISPR/Cas9 基因编辑技术因其操作简单,成本低、效率高等特点,现已发展成为应用最广泛的基因编辑技术[16]。 斑马鱼具有繁殖周期短,产卵量大,胚胎透明,基因组与人类基因组相似性高等特点[17],已成为继果蝇、线虫和小鼠之后的又一种重要的模式动物。 通过CRISPR/Cas9 技术构建斑马鱼疾病模型为研究人类疾病发病机理和筛选有效药物提供了有效途径。 糖原贮积症是一组遗传性先天糖代谢酶缺陷导致的代谢障碍疾病,该疾病至少可分为16 种类型[5]。 GSD0a型和GSD0b 型分别由GYS2 和GYS1 突变导致;GYS1 突变表现为运动疲劳、运动不耐受、累及心脏可引起肥厚性心肌症,突发心脏骤停;GYS2 突变表现为餐后高血糖和高脂血症,伴有肝肿大症状[4,18-20]。 肌肉和肝是葡萄糖摄取和转化的主要部位[21],因此,多种类型的糖原贮积症都累及肌肉、心脏和肝[22-24]。 糖原贮积症疾病的类型很多,其中以GSD Ⅴ型最为常见,其疾病动物模型类型也较多,包括了天然突变的牛、羊动物模型和人工构建的小鼠和斑马鱼模型[25-26]。 目前,GSD0 型疾病的临床病例报道很少,其疾病模型也只有小鼠模型。Pederson 等[1]构建的Gys1 敲除小鼠模型显示,90%的小鼠出生后死于心功能受损。 Xirouchaki 等[11]构建的肌肉特异性Gys1 敲除小鼠显示,小鼠糖代谢和运动能力受损。 Irimia 等[12]构建的肝特异性Gys2基因敲除小鼠模型很好地模拟了GSD0a 病理生理学。
与小鼠和人类基因结构一样,斑马鱼gys1 和gys2 基因也包含16 个外显子,且编码蛋白的氨基酸序列一致性分别是92%和89%,因此,斑马鱼gys1和gys2 突变体可能很好得模拟人类GYS1 和GYS2基因突变导致的疾病,为进一步研究GSD0 型疾病的发病进程及详细机制提供材料。 斑马鱼gys1-/-和gys2-/-突变体的表型与人类患者和小鼠模型表型相似,但也存在差异。 基因组织表达分析显示,gys1 和gys2 基因广泛表达于所检测的组织中,但gys1 在肌肉组织中表达最高,gys2 在肝中表达最高;这与人类糖原合酶组织表达模式一致。 糖原染色分析结果进一步显示,斑马鱼gys1-/-突变体心脏和肌肉组织糖原累积明显减少,而gys2-/-突变体出现肝组织糖原累积量显著降低,斑马鱼表型与GSD0 型疾病患者肌肉活检结果相一致。 因此,我们构建的斑马鱼疾病模型能够很好模拟人类糖原贮积症GSD0 型。
与Gys1 敲除小鼠模型F2大部分死亡不同[9],斑马鱼gys1-/-突变体F2正常生长发育,但其自交后代即F3胚胎发育缺陷,48 hpf 内全部死亡。 对gys1-/-F324 hpf 内胚胎发育过程观察发现,相对野生型斑马鱼,gys1-/-F3胚胎发育迟缓(图4c)。 对gys2-/-突变体的观察显示,未发现异常死亡现象。gys2 是肝糖原合成酶,组织qPCR 结果也显示,gys2在肝中显著高表达;因此,gys2 缺失会导致肝糖原累积降低,但是心脏和肌肉中糖原无明显变化。 解剖gys2-/-突变体时,发现突变体肝要比野生型肝体积要小(未做统计分析)。gys2-/-突变体后代能够正常生长发育和繁殖。 基因表达模式分析结果显示,gys1 和gys2 在胚胎发育过程中(1 细胞期至盾形期)高表达,两基因都在1 细胞期的表达量最高,且gys1 表达量高于gys2 表达量。 因此,我们推测gys(糖原)对胚胎早期发育极为重要,可能为胚胎发育提供能量。 斑马鱼卵子受精后,胚胎在早期发育过程中所需要的能量都来源于卵子形成过程中积累的能量。 组织qPCR 结果显示,gys1 在整个机体各个组织都有表达,尤其在肌肉中高表达,同时在卵巢中也有明显表达,可能对卵子糖原的积累非常重要。 当在斑马鱼中敲除gys1,gys1-/-的斑马鱼卵巢可能不能有效的合成糖原,卵子不能有效的积累糖原;因此gys1-/-雌鱼产的卵,受精后,早期胚胎没有足够的糖原为其发育提供能量,所以胚胎在发育过程中死亡,且大多集中在13~14 hpf(图4a)。 对小鼠的研究表明,小鼠1 细胞期可以检测到高的糖原合酶活性,2 细胞期开始大量积累糖原,胚胎早期发育阶段多种器官的糖原水平先升高后降低;胚胎发育过程中糖原水平的变化表明,糖原对胚胎发育可能具有特殊的作用,但很少有研究提供确切证据[1]。 因此,我们推测gys1 完全缺失,导致gys1-/-F2卵子形成过程中只有少量糖原积累(gys2 可能发挥作用),不能为受精卵早期发育持续提供能量,导致胚胎死亡。
gys1-/-纯合子中gys2 是否存在显著代偿作用?从组织和早期发育阶段qPCR 结果来看,gys1 和gys2 的表达位置具有重合现象,提示基因表达可能有冗余现象。 但是从突变体的组织切片(图6c)来看,gys1 不能补偿gys2-/-纯合子肝表型;同样,gys2也不能补偿gys1-/-纯合子心脏和肌肉表型,因此,我们推测gys1-/-纯合子中gys2 可能不存在显著代偿作用。
斑马鱼gys1-/-F2和gys2-/-纯合子能够正常生长发育,后续,我们将通过运动耐受、糖耐受和胰岛素耐受等实验,在细胞和分子水平上阐明GSD0 发病进程和机制,为深入认识人类糖原贮积症GSD0奠定基础。
