慢性阻塞性肺疾病病证结合动物模型研究进展*
2022-01-17陈小娟陆晓珊刘乐平宋厚盼菁1
张 婷 林 也 陈小娟 唐 琳 陆晓珊刘乐平 宋厚盼 廖 菁1, 陈 聪 蔡 雄△
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208;3.湖南中医药大学中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208)
慢性阻塞性肺疾病(COPD)是一种以持续气流受限为特征,严重威胁人类健康的疾病[1]。据2018年流行病学调查显示,我国COPD患者人数高达9 990万,约占全球COPD患者的25%[2]。西医学认为COPD的发生主要与气道炎症、蛋白酶失衡、氧化应激、微生物病原体、自身免疫及细胞凋亡[3]等有关。中医学则根据咳嗽、咳痰、喘息等临床表现,将其归属于“咳嗽”“喘证”“肺胀”“肺痿”等范畴[4],并认为本病的发生与久病肺虚、感受外邪及年老体虚等有关,且涉及肺、脾、肾、心、肝等多脏。
COPD作为一种世界性的常见疾病,其发病机制尚未完全明了。构建病证结合的动物模型是探讨其发病机制及研发相应药物的一种有效途径。笔者梳理当前文献资料,从COPD动物模型和COPD病证结合动物模型两类进行探讨。
1 常见COPD动物模型
COPD具有多种建模方法,目前主要由外源蛋白酶、脂多糖、烟雾刺激以及基因调控诱导。模型复制的思路主要是诱使实验动物产生组织病理学改变,从而使其具有与人类COPD相似的特征。
1.1 蛋白酶诱导型 研究表明,蛋白酶∕抗蛋白酶系统的失衡是引起弹性蛋白过度破坏分解,外周气道扩张,从而产生肺气肿的主要原因[5]。常用的蛋白酶有木瓜蛋白酶、中性粒细胞弹性蛋白酶、基质金属蛋白酶等。Paul等[6]在研究中发现,反复气管内注射木瓜蛋白酶,可使大鼠出现实验性的肺气肿。毛旻等[7]测定支气管内注入木瓜蛋白酶建立猪肺气肿模型的可靠性,取小型猪,支气管镜下左肺叶内注入木瓜蛋白酶,测得其PO2降低,PCO2及气道阻力升高,动态肺顺应性下降,周边肺组织肺纹理减少,肺野透光度增强,呈典型的肺气肿表现。Lynn等[8]研究表明中性粒细胞弹性蛋白酶和基质金属蛋白酶通过破坏细胞外基质和调节炎症的方式参与COPD的病理生理学过程。
α-1抗胰蛋白酶是一种重要的蛋白酶抑制剂,在预防COPD方面具有重要作用。Kolarich等[9]在研究中发现α-1抗胰蛋白酶能中和中性粒细胞弹性蛋白酶,保护肺结缔组织免受伤害。
1.2 烟雾诱导型 吸烟是导致COPD的主要原因,烟雾中含有许多氧化剂和自由基,会破坏细胞功能,引发白细胞聚集,从而形成气道炎症[8]。曹君等[10]为探讨单纯烟雾暴露所致肺气肿小鼠模型,将C57BL∕6J小鼠暴露于烟雾90 d,结果显示小鼠气道阻力增加,动态肺顺应性降低,巨噬细胞和中性粒细胞数量增加,且出现肺特征性的病理改变。Anna等[11]研究香烟烟雾对小鼠铜绿假单胞菌感染后细菌清除率和免疫炎症参数的影响。鼻饲铜绿假单胞菌及烟雾熏吸诱导COPD模型,结果显示,小鼠细菌清除速率有所延迟,炎症反应加强。
烟雾诱导的COPD模型在研究中应用广泛,其较急性伤害性模型能更好地模拟人长期吸烟引发的慢性发病过程。然而烟雾诱导也存在其局限,如无论这些动物暴露多长时间,由此产生的病理改变都是轻微的,相当于COPD的早期,并不会像COPD晚期那样功能丧失。
1.3 脂多糖诱导型 脂多糖(LPS)是一种重要的致炎因子,主要存在于革兰阴性细菌的细胞壁。通过对模型动物气道内反复滴注LPS,可诱发气道炎症,形成COPD。宋小莲等[12]取Wistar大鼠,通过吸烟和气道内滴加脂多糖建立COPD大鼠模型。结果显示,大鼠体重减轻,间歇性咳嗽,呼吸急促,外周血白细胞和中性粒细胞百分比增加,肺组织HE染色有慢性支气管炎和典型的肺气肿病变。王玮等[13]取雄性Wistar大鼠,通过吸烟和气道内输注LPS复制COPD模型。结果显示,模型组大鼠出现摄食、饮水减少,舌下静脉曲张,活动减少,反应迟钝,咳嗽,喷嚏,口鼻分泌物增加等症状及体征。血清中肿瘤坏死因子-α、白细胞介素-1β、干扰素-γ等炎性因子均明显升高。
1.4 基因调控型 COPD的发病也受到基因调控的影响,不少研究者应用基因敲除、转基因技术等复制COPD动物模型。Florie等[14]通过敲除小鼠近亲基因SERPINA1,可使其自发形成肺气肿。Iizuka等[15]研究发现敲除小鼠Nrf2基因,能加速中性粒细胞性肺炎和通透性肺损伤,诱导形成肺气肿。Witusik等[16]研究表明髓过氧化物酶编码基因-463位点的AA基因型能增加COPD的患病风险。基因调控是诱发COPD的一种新型方式,将是未来研究的重点。
2 常见的COPD病证结合动物模型
单纯的疾病模型不能很好地模拟COPD和中医证候之间的关系。因此,在中医药研究领域,许多学者在疾病模型的基础上增加中医的致病因素,以复制COPD中医证候。
使其既具备西医的病理特征,又满足中医的证型。目前常见的病证结合动物模型有肺气虚证动物模型、肺脾气虚证动物模型、肺肾两虚证动物模型、寒饮蕴肺证动物模型、痰热壅肺证动物模型、痰瘀阻肺证动物模型等。
2.1 肺气虚证动物模型 见表1。肺气虚证是指以咳嗽乏力、气短而喘、卫外不固为临床表现的一种证候。其病情较为单一,造模方式多样,是肺病证候模型中研制最早、最为完善的一种动物模型。

表1 常见肺气虚证COPD动物模型
2.2 肺脾气虚证动物模型 见表2。脾在五行属土肺属金,土能生金,故脾为肺之母,肺病日久,则子病及母,形成肺脾气虚之证。目前肺脾气虚证动物模型主要采用烟熏联合脂多糖,并辅以苦寒泻下类中药进行造模。

表2 常见肺脾气虚证COPD动物模型
2.3 肺肾两虚证动物模型 见表3。COPD发展到后期也可影响及肾,形成肺肾两虚之证。杨士瀛在《仁斋直指方论·咳嗽》指出“肺为气之主,肾为气之藏。凡咳嗽暴重,动引百骸,自觉气从脐下逆奔而上者,此肾虚不能收气归元也”。肺肾两虚证病情复杂,目前拥有的造模方式有限。
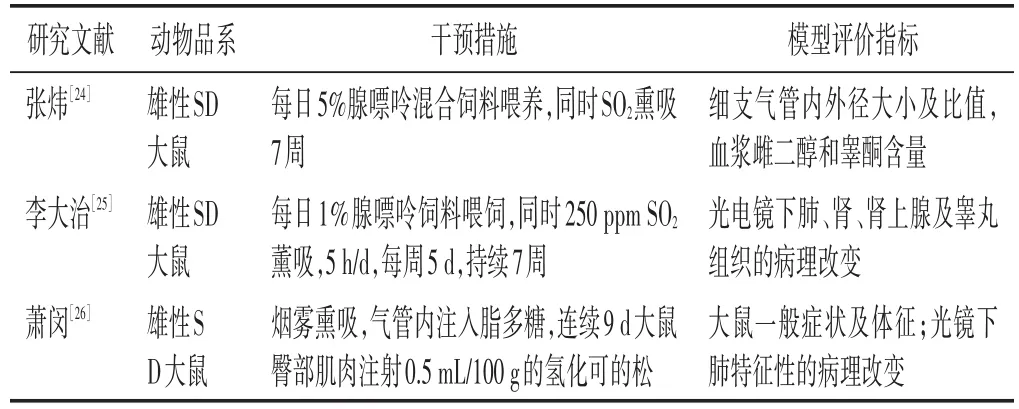
表3 常见肺肾两虚证COPD动物模型
这些模型均能在一定程度上模拟肺肾两虚证,然则与临床实际仍存在一定差距。如临床COPD的肺肾两虚证多呈进行性发展,一般先累及肺,日久及肾。而在造模之时,肾虚证模型与肺气虚证模型多同时进行复制,因而有待进一步完善。
2.4 寒饮蕴肺证动物模型 见表4。寒饮蕴肺证是COPD的一个常见证型,多由肺阳气虚衰,脾失转输,饮邪上犯所致。目前多采用烟熏联合脂多糖或滴加肺炎克雷白杆菌的方法复制COPD模型,再辅以寒凉食物或风寒湿刺激,所谓形寒饮冷皆可伤肺。

表4 常见寒饮蕴肺证COPD动物模型
2.5 痰热阻肺证动物模型 见表5。痰热壅肺证多出现在COPD的急性加重期,具有“痰”和“热”的双重病机[30],二者互为因果,正如宋·杨士瀛《仁斋直指方论·病机赋》中所道“痰因火动,有因火而生痰,有因痰而生火”。其临床可见咳嗽、黄痰、发热、口干、便干便秘、舌红苔黄等证候表现。
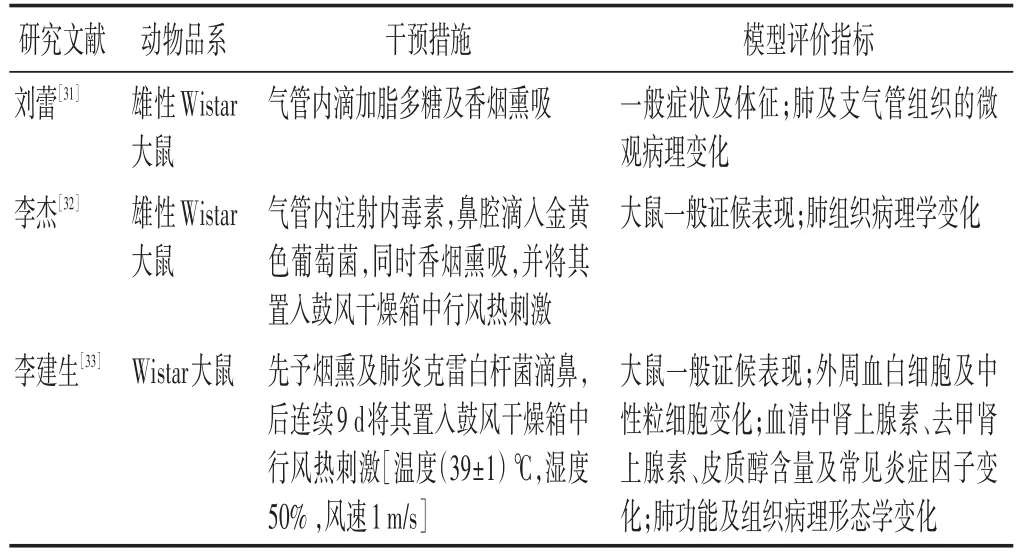
表5 常见痰热阻肺证COPD动物模型
2.6 痰瘀阻肺证动物模型 痰瘀阻肺证多由肺气受损,脾失健运,气血运行失司,阻滞于肺所致。气虚、痰凝、血瘀是其发病的关键,早在《丹溪心法》中便有提及“肺胀而咳,或左或右不得眠,此痰挟瘀血碍气而病”。痰瘀阻肺证临床表现为气喘、胸闷、肢冷面青、舌暗、舌下络脉曲张、脉沉或涩等[34]。目前拥有的造模方法较为单一,主要通过烟熏配合劳累、缺氧等方式。李泽庚等[35]每天强迫大鼠游泳30 min,使其劳伤肺气,而后将其置于熏烟箱内烟熏1 h,最后置入常压低氧装置内以建立COPD痰瘀阻肺证模型。王传博等[34,36-37]参照李泽庚的造模方法构建COPD痰瘀阻肺证大鼠模型,观察到大鼠肺小动脉管壁变薄、管腔变大,管壁面积占血管总面积的百分比明显减少,Rock-1、Rock-2蛋白表达及炎症因子等明显降低。
3 思考与展望
COPD动物模型造模方式多样,是探索其发病机制的一种有效途径。病证结合COPD动物模型更是结合现代医学“病”和中医“证”的优势,在单纯疾病模型基础上模拟气虚、寒饮、痰热、痰瘀、肾虚等多种不同的证候,具有较高的可信度与重复性,大大推动了COPD的研究进展,为探讨其发病机制及开发相应的中医药提供了良好的平台。然而目前还存在些许不足,主要体现在以下几个方面。
3.1 动物选取品类 目前常用的COPD模型动物有豚鼠、大小鼠、狗、猪、兔、羊等,其中大鼠由于基因组与人类基因组非常相近,且饲养成本低,性情温顺,繁殖较快,因而在COPD动物模型中应用普遍。但也存在一些不足,如大鼠的支气管分支较少,左肺叶仅1片,且电镜下无法观察到气管黏膜下的杯状细胞,这均与人类不符[38]。
3.2 造模方法 COPD动物模型制作方法多样,优劣各异。如采用烟熏法时经济实惠,且能很好地模拟人的吸烟过程,但它所造成的病程是轻微的,相当于疾病的早期;采用气管内滴加脂多糖时往往急性起病;采用基因敲除则价格高昂,技术尚未完全成熟。
不仅如此,在制作COPD各证候之时,也存在诸多问题。首先,造证方式不统一,如同为COPD肺气虚证,有采用烟熏联合脂多糖,有采用滴菌配合寒冷疲劳刺激,也有采用烟熏配合木瓜蛋白酶雾化吸入。这些方法均能对肺产生明确、特异的病理损害,然而究竟何种更符合临床实际,尚有待考究。其次,烟熏时所使用材料各异,有香烟,有硫磺粉,有锯末,有刨花,且同一个模型,不同的研究者进行烟熏的时间不一致。再者,在造证之时,往往通过改变外在环境使动物具有与患者相同或相似的表现,以达到模拟“证”的目的。然而,这些单纯的致病因素在实际施加过程中存在着一定程度的不可控性,如在强迫大鼠游泳时,由于大鼠先天个体差异,其游泳所能耐受的强度不一致,最终达到的效果也不一致,因而导致模型的代表性和稳定性均较弱[39]。
3.3 评价标准 在COPD病证结合动物模型的判定中,有通过观察大鼠的症状、体征,有通过检测相关实验室指标,也有通过光镜、电镜等考察肺特征性的病理改变,然而这些均只能说明模型“造病”成功,却无法判断其“造证”成功与否。而模型的“证”主要通过对动物一般症状、体征的观察得到,由人的主观意识进行判定,缺乏一定的科学性。如在肺脾两虚证动物模型制造中,对模型动物灌以苦寒泻下类中药,大鼠出现纳呆,便溏,甚则泄泻,因而判定有脾虚证形成,然而究竟一天饮食多少才算纳呆,大便一天几次才算泄泻,粪质溏稀到何种程度才算便溏,尚没有一个数字化的诊断标准。且不同证之间也会出现相似症候的兼夹,在造模后期更有可能由于疾病的自然演化而形成其他证候,导致模型动物偏离原来的造模证候,造成实验结果的偏差。
总之,COPD病证结合动物模型仍处于发展中,尚有待继续完善,建立一种经济方便、科学全面且符合人类COPD病证表现的造模方法及建立一个完善的病证结合动物模型的评价标准是未来研究工作的方向所在。
