非瑟酮通过Nrf2/HO-1和MAPK信号通路抑制阿霉素诱导的肺动脉内皮细胞衰老*
2022-01-16高雨彤敖启林
高雨彤, 肖 娜, 敖启林
1华中科技大学同济医学院附属协和医院病理科,武汉 430022 2长江大学附属仙桃市第一人民医院病理科,仙桃 433000 3华中科技大学同济医学院附属同济医院病理科,武汉 430030
细胞衰老是指细胞增殖、分化和生理功能逐渐发生衰退的过程,其响应于不同的破坏性刺激,例如DNA损伤、端粒缩短或致癌性应激等[1]。应激性早衰(stress-induced premature senescence,SIPS)是机体遭受各种有害损伤诱发的过早性衰老,其中阿霉素(Doxocubicin,DOX)是体外实验最常见的衰老刺激剂[2-3]。长期使用DOX可能对心血管系统(cardiovascular system,CVS)或肾脏造成损害[4]。大量研究表明,DOX可以引起血管内皮细胞和平滑肌细胞产生大量活性氧(ROS),导致细胞炎症、DNA损伤和线粒体功能障碍,促进细胞分泌衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的细胞因子,从而导致细胞发生应激性早衰[5-6]。由于血管内皮细胞衰老是心血管疾病高死亡率的重要原因,所以研发或寻找延缓内皮细胞衰老的相关药物或靶点是当前科学界研究的热点之一。
肺血管重塑(pulmonary vascular remodel,PVR)是肺动脉高压(pulmonary hypertension,PH)的主要病理改变[7]。人肺动脉内皮细胞(human pulmonary artery endothelial cell,HPAEC)损伤、平滑肌细胞增殖、炎性细胞浸润以及细胞外基质的沉积等多种因素共同参与PVR的病理进展[8-9]。血管内皮细胞是血管与血液物质交换和信号传递的主要效应细胞,对血管稳态的维持发挥主要作用,而HPAEC功能失调被认为是PH发生的起始环节[10-11]。许多研究表明,HPAEC应激性早衰会进一步促进血管衰老,加速PVR的发生发展,是导致PH的重要原因[12]。
非瑟酮(Fisetin,Fis)是从植物果实中提取的一种黄酮类化合物,近年研究表明非瑟酮在抑制炎症反应、抗氧化应激、诱导肿瘤细胞凋亡、延缓衰老等发面发挥重要作用[13-14]。然而,Fisetin在内皮细胞应激性早衰中是否发挥作用仍不清楚。因此本研究拟以HPAEC为研究对象,探讨Fisetin对DOX诱导的HPAEC衰老的影响及相关机制,从而为PH的治疗提供一定的理论依据。
1 材料与方法
1.1 材料
HPAEC购自美国模式培养物集存库(ATCC)。DMEM培养液、胎牛血清(FBS)、胰蛋白酶、青霉素-链霉素双抗购自美国Hyclone公司;Trizol Reagent、荧光定量扩增试剂盒购自美国Invitrogen公司;RNA逆转录试剂盒购自美国Promega公司;活性氧(ROS)检测试剂盒购自碧云天生物试剂公司;衰老相关β-半乳糖苷酶(SA-β-gal)试剂盒购自美国Sigma公司;Fisetin购自美国Selleck公司;Nrf2、HO-1、NQO-1、P53、P16、P21等抗体购自美国Proteintech公司;ERK、p-ERK、P38、p-P38、JNK、p-JNK、P65、p-P65等抗体购自美国CST公司。主要仪器如下:多功能台式冷冻离心机(Heal-Force公司),PCR扩增仪(Bio-Rad),荧光定量PCR仪(Bio-Rad)及显微镜(Nikon),蛋白电泳仪,凝胶成像系统(Bio-Rad)。
1.2 细胞处理和培养
HPAEC在37 ℃,5% CO2培养条件下,用含10%胎牛血清的DMEM高糖培养液于培养瓶中培养。将细胞分为:对照(Control)组,阿霉素刺激组(DOX),不同浓度的Fisetin处理组(5、10、20 μmol/L)。每组设立3个平行样。
1.3 SA-β-gal活性检测
根据SA-β-gal染色试剂盒说明书,先使用多聚甲醛固定液固定细胞,经PBS清洗后,将配制好的含有X-gal底物染液加至24孔板内,随后在37 ℃培养箱内避光孵育12 h。然后取出过夜的细胞,光镜下观察染色情况,拍照并随机选取5个视野计数阳性细胞,胞质出现蓝绿色颗粒即为衰老阳性细胞。
1.4 活性氧活性检测
根据ROS检测试剂盒说明书,将探针装载至细胞内,使其终浓度为10 μmol/L,37 ℃细胞培养箱内孵育20 min,再用无血清细胞培养液洗涤细胞3次,随后用荧光显微镜观察ROS试剂盒情况并拍照。
1.5 流式细胞仪检测细胞周期
用不含EDTA的胰蛋白酶消化收集处理后的HPAEC,PBS重悬细胞达1×106个/mL,1000 r/min离心5 min(4 ℃),弃上清再用1 mL预冷的PBS洗细胞2次,然后再1000 r/min离心5 min得到细胞沉淀,用70%的乙醇重悬细胞,4 ℃固定过夜,取出固定好的细胞,1500 r/min离心5 min,1 mL PBS重悬细胞,1500 r/min离心5 min,200~500 μL PBS重悬,加入100×RNA酶(终浓度为100 μg/mL)室温放置5~10 min,再加入10×溴化乙啶(PI),4 ℃避光孵育30 min后流式上机检测各组细胞周期情况。
1.6 细胞蛋白提取及Western blot检测蛋白
用预冷的PBS润洗细胞3次,去除PBS后加入配制好的含PMSF的RIPA蛋白裂解液100 μL,置于4 ℃冰上充分裂解30 min后用EP管收集细胞裂解液,然后4 ℃低温离心机12000 r/min离心15 min,离心结束后收集上清(小心不要碰到沉淀),使用BCA法检测蛋白浓度;根据Western blot凝胶试剂盒说明书配制好SDS-PAGE分离胶及浓缩胶,经120 V恒压电泳后,根据相应蛋白分子量大小切下目的蛋白以及内参所在区域的凝胶,275 mA恒流电泳湿法转移至PVDF膜,封闭60 min,一抗孵育过夜,用TBST清洗3次后再加入二抗,室温孵育60 min后TBST清洗。最后使用ECL曝光液覆于PVDF膜表面,在凝胶成像系统中进行成像,利用Bio-Rad自带软件对条带进行定量分析。
1.7 实时荧光定量PCR(qPCR)法检测
用PBS润洗细胞后,每孔加入Trizol裂解液1 mL,置于4 ℃冰上充分裂解5 min后收集细胞裂解液,分别用EP管收集,随后按Trizol说明书步骤提取细胞总RNA,逆转录为cDNA。引物由上海生工生物工程有限公司合成,Nrf2上游引物:5′-AGAGCCCAGTCTTCATTGCT-3′,Nrf2下游引物:5′-TCTGGACTTGGAACCATGGT-3′;HO-1上游引物:5′-AAGACTGCGTTCCTGCTCAAC-3′,HO-1下游引物:5′-AAAGCCCTACAGCA-ACTGTCG-3′;NQO-1上游引物:5′-GAAGAGC-ACTGATCGTACTGGC-3′,NQO-1下游引物:5′-GGATACTGAAAGTTCGCAGGG-3′;P21上游引物:5′-TGTCCGGCGTCATCAAGAC-3′,P21下游引物:5′-GGTCCCACGCAAAACCAGAA-3′。首先激活酶活性(95 ℃,10 min),然后按照变性(95 ℃,15 s)、退火和延伸(60 ℃,60 s)程序,共40个循环。用2-ΔΔCt法计算Nrf2,HO-1,NQO-1及P21的相对表达量。
1.8 酶联免疫吸附试验(ELISA)
采用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒检测Fisetin预处理的HPAEC培养液上清中MCP-1、TGF-β等衰老相关分泌表型(SASP)细胞因子的含量,具体操作参照产品说明书。
1.9 统计学方法
2 结果
2.1 Fisetin对HPAEC细胞增殖的影响及DOX刺激的最适浓度
在不同浓度(0、5、10、20、30、50、100 μmol/L)和不同时间(24、48、72 h)作用下,用CCK-8法检测Fisetin对HPAEC细胞增殖的影响。如图1A所示:HPAEC增殖活性在低于20 μmol/L Fisetin作用时无明显下降。因此,选择0~20 μmol/L作为Fisetin的给药浓度。另外,我们检测了不同浓度(0、0.1、0.25、0.5、1 μmol/L)DOX刺激的毒性效应及衰老相关蛋白的表达情况。结果如图1B、1C、1D所示:0.5 μmol/L及1 μmol/L DOX明显抑制了HPAEC的增殖活性,而0.25 μmol/L DOX对细胞无明显毒性且衰老相关蛋白P21表达水平最高,因此在本实验选取DOX的最适浓度为0.25 μmol/L。

A:Fisetin对HPAEC增殖的影响;B:DOX对HPAEC增殖的影响;C、D:DOX对P21蛋白表达的影响;与0 μmol/L组比较,**P<0.01图1 Fisetin对HPAEC增殖的影响及DOX刺激的最适浓度Fig.1 The effect of Fisetin on the proliferation of HPAEC and the optimal concentration of DOX stimulation
2.2 Fisetin对DOX诱导的SA-β-gal活性的抑制效应
SA-β-gal活性检测是目前观察细胞衰老最直观、简便且有效的方法。衰老细胞产生的SA-β-gal在pH值为6.0时可以将底物X-gal催化成深蓝色产物,从而可以用SA-β-gal活性(即蓝染细胞占比)反映细胞衰老情况。在本实验中我们发现:DOX刺激后,HPAEC表达大量的SA-β-gal,说明DOX诱发了细胞衰老;随着Fisetin给药浓度增加,衰老细胞逐渐减少,结果如图2所示。

与Control组比较,**P<0.01图2 Fisetin对DOX诱导的SA-β-gal活性的作用Fig.2 The effect of Fisetin on DOX-induced SA-β-gal activity
2.3 Fisetin对DOX诱导的活性氧产生的抑制效应
氧化应激诱导衰老的过程中,会激活体内ROS的产生。在本实验中我们发现:DOX刺激后,HPAEC产生大量的ROS,说明DOX诱发了细胞氧化应激,而随着Fisetin给药浓度增加,ROS产生量逐渐减少,说明Fisetin抑制了DOX诱导的ROS产生,结果如图3所示。
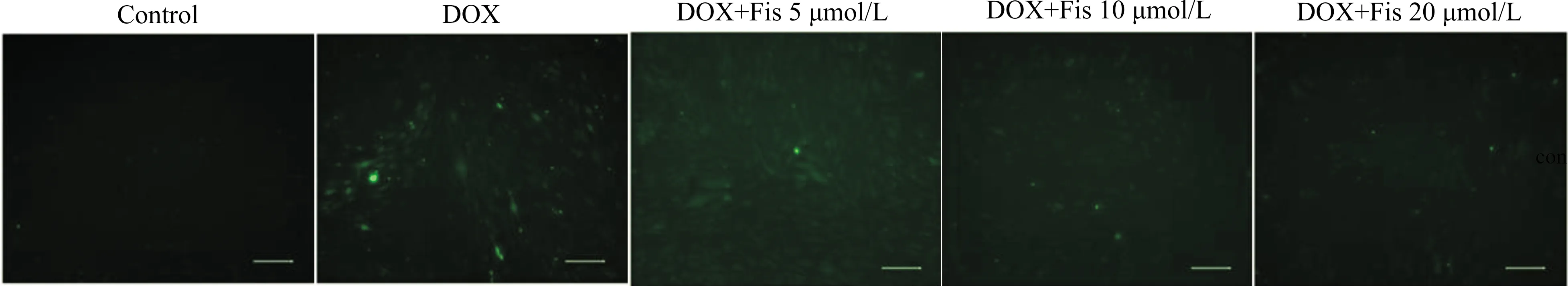
图3 Fisetin对DOX诱导的ROS产生的作用(标尺=100 μm)Fig.3 The effect of Fisetin on DOX-induced ROS expression(scale bar=100 μm)
2.4 Fisetin对DOX诱导的HPAEC细胞周期阻滞的保护作用
接下来探讨不同浓度的Fisetin在DOX诱导HPAEC细胞周期阻滞中的作用,结果如图4所示:DOX组90%以上的细胞被阻滞在DNA合成前期(G0/G1期),Fisetin处理组(5、10、20 μmol/L)细胞在DNA合成期(S期)分别占40%、50%及55%,呈浓度依赖性上升,表明Fisetin对DOX诱导的细胞周期阻滞有一定的抑制效应。
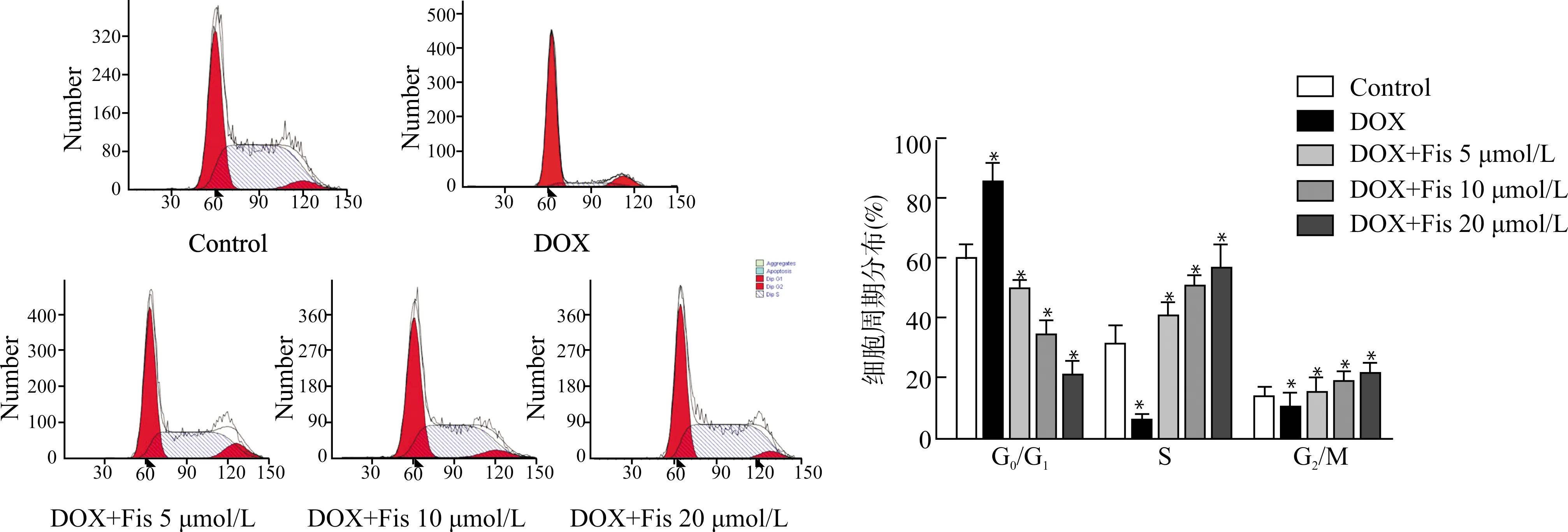
与Control组比较,*P<0.05图4 Fisetin对DOX诱导的HPAEC细胞周期阻滞的作用Fig.4 The effect of Fisetin on DOX-induced HPAEC cell cycle arrest
2.5 Fisetin对衰老相关蛋白表达的抑制作用
P53/P21和P16/RB是细胞衰老信号通路[15]。在本实验中,我们发现衰老蛋白P21在DOX刺激后表达明显上升;而Fisetin处理后,P21蛋白表达明显下降(图5A、5B)。PCR结果同样证实,Fisetin抑制了DOX诱导的P21 mRNA表达,同时促进了Nrf2、HO-1、NQO-1等抗氧化应激蛋白的mRNA表达(图5C)。

A、B:Fisetin对P53、P21蛋白表达的影响;C:Fisetin对Nrf2、HO-1、NQO-1、P21 mRNA表达的影响;1:Control;2:DOX;3:DOX+Fis 5 μmol/L;4:DOX+Fis 10 μmol/L;5:DOX+Fis 20 μmol/L;与Control组比较,#P<0.05;与DOX组比较,*P<0.05图5 Fisetin对DOX诱导的衰老相关蛋白表达的作用Fig.5 The effect of Fisetin on DOX-induced senescence-related protein expression
2.6 Nrf2/HO-1在调节DOX诱导细胞衰老中的作用
Nrf2/HO-1是体内重要的抗氧化信号通路,参与调节体内氧化应激引发的DNA损伤[16]。在本研究中,我们发现Fisetin通过Nrf2/HO-1调控DOX诱导的细胞衰老结果。结果如图6显示:HO-1的表达随着Fisetin浓度增加而逐渐升高,并在16 h达到最大(图6A);Fisetin刺激后Nrf2被激活并逐渐由胞质移入核内,6 h时核内Nrf2明显增加(图6B);HO-1沉默后,衰老相关蛋白P21表达增加(图6C、6D),说明Fisetin通过HO-1参与调节DOX诱导的细胞衰老。
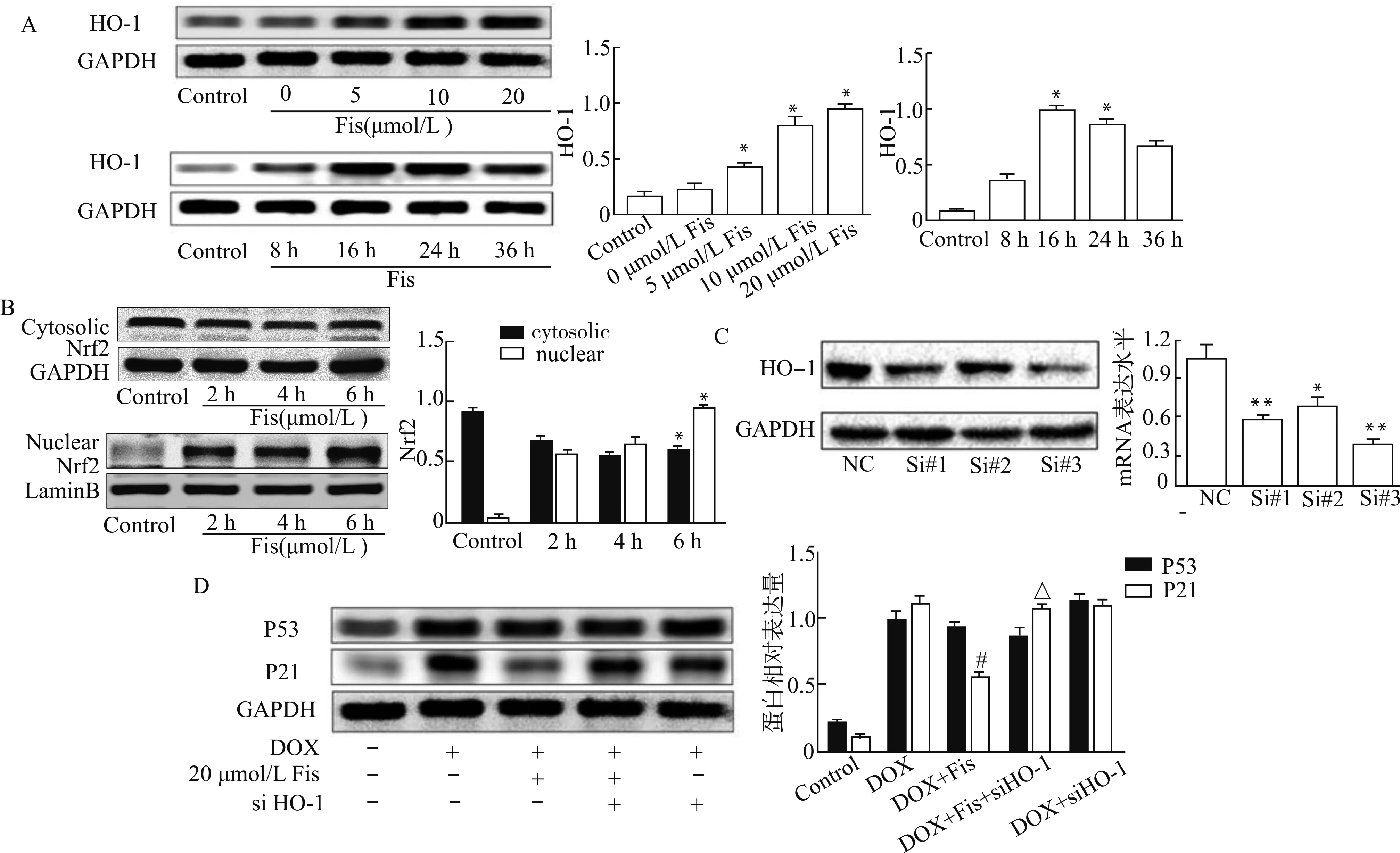
A:Fisetin对HO-1表达的影响;B:Fisetin对Nrf2表达的影响;C:采用siRNA沉默 HO-1表达;D:沉默HO-1对P21表达的影响;与Control组比较,*P<0.05 **P<0.01;与DOX组比较,#P<0.05;与DOX+Fis组比较,△P<0.05图6 Nrf2/HO-1在调节DOX诱导细胞衰老中的作用Fig.6 The role of Nrf2/HO-1 in regulating DOX-induced cell senescence
2.7 MAPK通路在Fisetin调节DOX诱导的细胞衰老中的作用
相关研究表明,Fisetin通过p38 MAPK途径上调HO-1的表达[17]。如图7A所示:Fisetin(20 μmol/L)处理HPAEC后,磷酸化P38表达升高;SB203580是P38抑制剂,如图7B中SB203580下调了Fisetin诱导的HO-1和磷酸化P38的表达;图7C结果显示:SB203580处理组P21的表达升高,部分抵消了Fisetin对DOX诱导衰老的抑制效应。
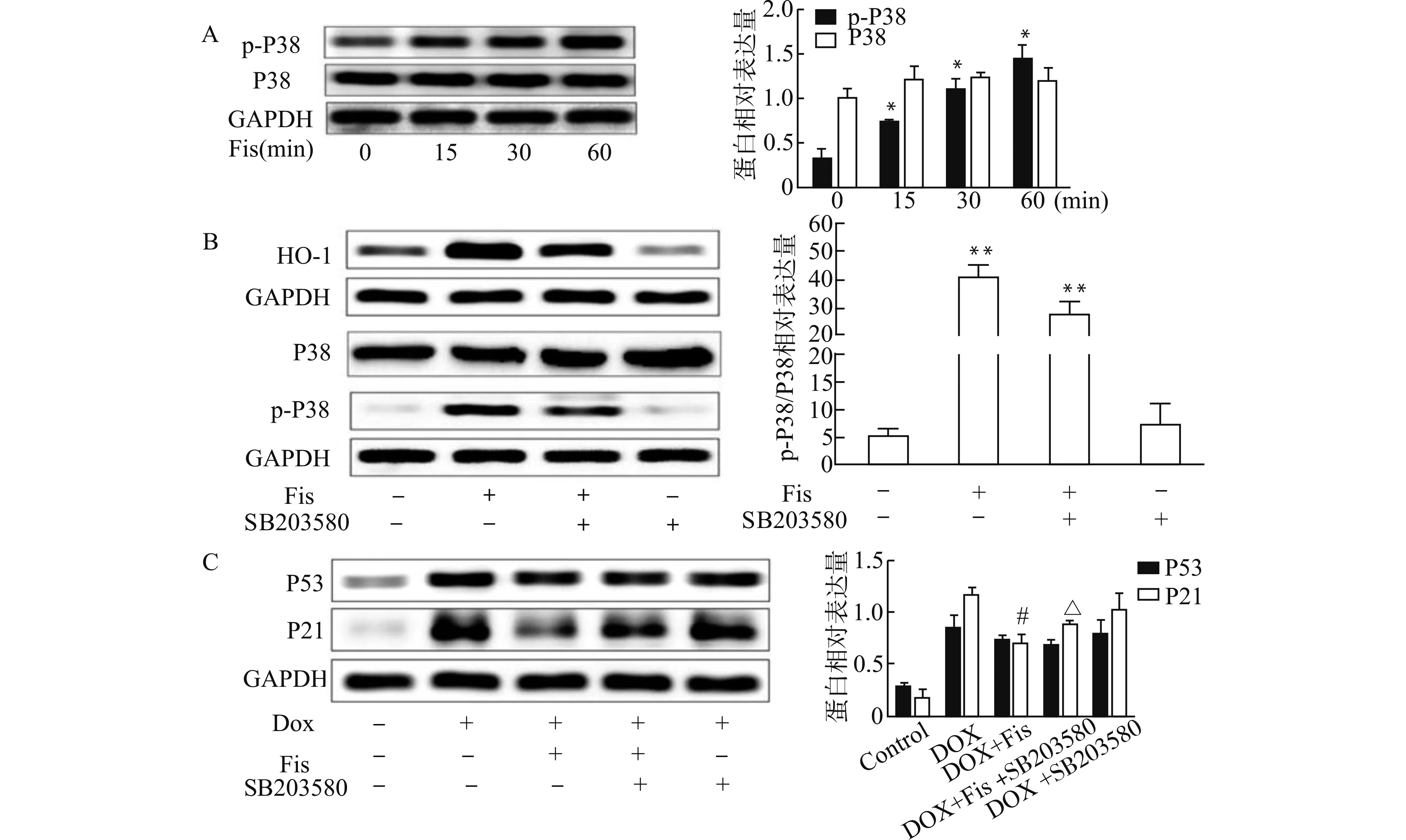
A:Fisetin 上调p-P38的表达;B:SB203580下调Fisetin诱导的p-P38的表达;C:SB203580上调P21的表达;与Control组比较,*P<0.05 **P<0.01;与DOX组比较,#P<0.05;与DOX+Fis组比较,△P<0.05图7 MAPK通路在Fisetin调节DOX诱导的细胞衰老中的作用Fig.7 The role of MAPK pathway in regulation of DOX-induced cell senescence by Fisetin
2.8 Fisetin的抗衰老作用对肺动脉平滑肌细胞(HPASMC)的影响
衰老内皮细胞分泌SASP因子,可作用于HPASMC,使其增殖从而引发PVR[18]。
在本实验中我们发现:Fisetin处理的HPAEC条件培养液上清中MCP-1、TGF-β等SASP细胞因子的表达量逐渐下降;而CCK8结果也表明,与DOX组的条件培养上清相比,Fisetin处理过的HPAEC条件培养上清对HPASMC增殖的促进作用逐渐降低(图8)。

A:HPAEC上清中SASP细胞因子含量;B:HPAEC条件培养上清对HPASMC增殖活力的影响;1:Control;2:DOX;3:DOX+Fis 5 μmol/L;4:DOX+Fis 10 μmol/L;5:DOX+Fis 20 μmol/L;与DOX组比较,*P<0.05 **P<0.01;与Control组比较,#P<0.05图8 Fisetin的抗衰老作用对肺动脉平滑肌细胞(HPASMC)的影响Fig.8 The anti-aging effect of Fisetin on pulmonary artery smooth muscle cells(HPASMC)
3 讨论
在本实验中,我们主要探讨了Fisetin对DOX诱导的HPAEC衰老的影响并探讨其相关机制。Fisetin是一种黄酮类化合物,具有抗氧化、神经保护和抗衰老等作用[19]。我们实验结果表明Fisetin通过P38 MAPK和Nrf2/HO-1信号通路抑制DOX诱导的HPAEC衰老,同时减少了衰老细胞相关分泌表型的表达,从而减弱了对HPASMC的旁分泌和增殖促进作用,延缓了PVR的进程(图9)。

图9 Fisetin影响DOX诱导的HPAEC衰老的机制示意图Fig.9 Mechanism diagram of Fisetin affecting DOX-induced HPAEC senescence
大量研究已经证实DOX可诱导细胞发生应激性早衰,是体外研究中常见的刺激剂[20]。细胞衰老主要表现为细胞周期阻滞、细胞分裂终止、细胞外形发生膨大扁平状改变以及分泌衰老相关表型等一系列生物学变化[21]。本实验证实,Fisetin逆转了DOX诱发的细胞周期阻滞,减轻了β-半乳糖苷酶的表达;同时衰老蛋白P21的表达降低也再次证实了Fisetin对DOX诱发的衰老有抑制作用。相关研究表明,应激因素诱导的早衰可使细胞获得衰老相关分泌表型,主要包括炎症因子和细胞生长因子,而细胞生长因子可以通过旁分泌方式促进周围细胞增殖[22]。图8表明Fisetin的抗衰老效应抑制HPAEC衰老相关分泌表型因子的表达,减轻了对HPASMC的增殖促进作用,从而延缓PVR的进程。
ROS与炎症、衰老、缺血再灌损伤等多种病理生理过程有着密切联系,ROS能够通过调节转录因子、生长因子和细胞因子来调控细胞内多种信号通路。因此,通过减少ROS,改善氧化应激成为缓解或预防衰老的重要机制。在本研究中,我们发现DOX刺激后,HPAEC产生大量的ROS,而随着Fisetin给药浓度增加,ROS产生量逐渐减少,说明Fisetin抑制了DOX诱导的ROS的产生,从而抑制了氧化应激反应。
氧化应激诱导衰老的过程中会激活体内许多细胞保护性蛋白,如Nrf2、HO-1等[23]。游离的Nrf2在受到刺激后由胞质进入胞核,并通过抗氧化反应元件(antioxidant response element,ARE)上调HO-1的表达,从而发挥抗氧化应激作用,延缓衰老进程。图6显示,Fisetin有效地增加了HO-1蛋白的表达,并促进了Nrf2的核转移;而在沉默HO-1后,细胞衰老蛋白P21的表达升高,减弱了Fisetin对衰老蛋白P21的抑制作用,这些结果表明Fisetin抑制HPAEC衰老是通过Nrf2/HO-1信号通路发挥作用的。前期也有研究表明MAPK对抗氧化应激蛋白HO-1的表达起到重要调控作用[24]。黄花苷介导HO-1的表达需要p38 MAPK依赖性Nrf2/ARE途径的激活[25],也有研究报道镉通过p38 MAPK激活诱导了HO-1的表达[26]。同时有研究证实在人脐静脉内皮细胞(HUVECs)中,Fisetin通过PKCδ-p38 MAPK途径上调了HO-1的表达。而在本实验中(图7),Fisetin促进P38的磷酸化,而P38抑制剂SB203580下调了Fisetin介导的HO-1表达,同时也部分抵消了Fisetin对衰老蛋白P21的抑制作用。这一研究结果提示在HPAEC中,Fisetin通过抑制P38 MAPK信号通路诱导HO-1的表达。
本实验初步证实了Fisetin可能通过调节Nrf2/HO-1和P38 MAPK通路的活性来调控DOX诱导的HPAEC衰老,为PVR的防治提供了一定的理论依据。
