微波消融与聚桂醇硬化治疗甲状腺囊实性结节的疗效比较
2022-01-15水苗苗王川予高侃葛月月陈岚蔡建平戴维德
水苗苗,王川予,高侃,葛月月,陈岚,蔡建平,戴维德*
1.北京医院超声科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730;2.北京医院病理科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730;3.北京医院 国家老年医学中心 国家卫生健康委北京老年医学研究所 国家卫生健康委北京老年医学重点实验室 中国医学科学院老年医学研究院,北京 100730;*通信作者 戴维德 Dai.weide@126.com
随着超声仪器分辨率的提升以及人群健康体检意识的加强,甲状腺结节的检出率逐年上升。对于甲状腺结节,首要任务是鉴别良恶性[1]。超声判定或经病理活检证实为良性的甲状腺结节,如结节>2 cm或患者有相关症状可行治疗干预,治疗方法包括手术、微创治疗等。传统手术创伤大、需住院治疗,在全麻下进行手术,且术后颈部瘢痕影响美观[2]。微创治疗包括聚桂醇硬化治疗及微波消融治疗,有效、简便、安全,近年已在临床上广泛应用[3]。然而,目前关于聚桂醇硬化治疗及微波消融治疗对甲状腺囊实性结节的疗效对比研究较少。本研究拟分析两种治疗方法对甲状腺囊实性结节的疗效差异及影响因素。
1 资料与方法
1.1 研究对象 本研究为回顾性队列研究,连续性纳入北京医院超声医学科2019年1月—2021年1月收治的经病理证实的良性甲状腺囊实性结节114例共120个结节,按照随机数字表法分为硬化治疗组54例共60个结节和微波消融组60例共60个结节。纳入标准同时满足(1)~(4),并满足(5)中的1项[4]:(1)超声提示结节最大径>2 cm或位于峡部、突出皮肤表面的囊实性结节(50%<囊性成分<99%);(2)细针穿刺活检细胞学病理FNA-Bethesda报告系统报告为Ⅱ类的良性结节[5];(3)甲状腺结节既往未接受手术、热消融(微波、射频、激光等)或囊内药物注射治疗;(4)实验室检查提示甲状腺功能正常;(5)①患者存在与结节明显相关的自觉症状(如异物感、颈部不适或疼痛等),但拒绝手术治疗;②结节影响美观,造成心理负担,患者主动要求微创治疗。排除标准:(1)巨大胸骨后甲状腺肿或大部分甲状腺结节位于胸骨后方;(2)严重凝血功能障碍;(3)严重心肺功能不全;(4)病历资料不完整、中途失访患者。本研究获得北京医院伦理委员会批准(编号:2021BJYYEC-072-02),患者治疗前均签署知情同意书。
1.2 研究方法
1.2.1 仪器及药物 选用Canon Aplio 500彩色多普勒超声诊断仪(具备超声造影条件),消融治疗采用亿高(京)ECO-100型微波消融治疗仪,ECO-100A13型冷循环消融针。微波频率2 450 MHz,功率20~30 W。硬化剂采用聚桂醇注射液(陕西天宇公司,100 mg/10 ml,国药准字H20080445)。造影剂使用SonoVue,造影微泡为磷脂包裹的六氟化硫(SF6)。
1.2.2 方法 所有患者治疗前完成以下检查,①实验室检查:血常规、凝血相、感染三项(丙肝抗体、艾滋病抗体和梅毒抗体)及甲状腺功能;②超声引导下细针穿刺细胞学检查,取得病理结果;③对病灶行多角度、多切面超声检查,详细评估结节体积、结节内及周边血流情况、囊性成分占比、明确病灶的部位及与重要结构的毗邻关系。
聚桂醇硬化治疗组:患者取仰卧位、保持颈部后屈过伸体位,常规消毒、铺巾,局麻,超声引导下进18G穿刺针至囊性暗区中心,抽取囊液,如囊液黏稠不易抽出,用0.9%氯化钠注射液进行多次置换(具体置换次数根据结节体积计算)后注入约1/5~1/3的聚桂醇注射液留置。
微波消融组:微波消融治疗前均行超声造影,使用前造影剂干粉内注入生理盐水5 ml,振荡混匀后抽取混悬液(2.4±0.2)ml,经肘静脉快速推注,然后注射5 ml生理盐水,观察结节灌注情况。患者颈部常规消毒、铺巾,根据病灶部位,超声引导下以2%利多卡因注射液与0.9%氯化钠注射液等量混合制成1∶1混合液,在甲状腺前包膜与颈前肌群间隙充分进行局部浸润麻醉。将18G穿刺针置入结节内囊性部分,尽可能抽出囊液,如囊液黏稠不易抽出,可用0.9%氯化钠注射液进行多次置换。根据甲状腺结节与周围血管、气管和喉返神经的相对位置,必要时注射适量0.9%氯化钠注射液在局部间隙形成液体隔离带,防止或减少操作过程中对正常组织的热灼伤。随后破皮,将微波消融针按预先设计的穿刺路径插入甲状腺结节,采用连续移动法消融,功率20~30 W,消融顺序由深至浅、由下极到上极,逐层进行,直到消融范围全部覆盖整个结节后停止治疗。即刻行超声造影判断消融灶毁损范围,若发现有增强区域,表示有残存病灶,追加消融后结束治疗。
1.2.3 疗效评价 治疗后第1、3、6个月进行超声随访,观察消融灶大小,根据公式(1)、(2)计算体积及消融灶体积缩小率(volume reduction rate,VRR)。根据治疗后3 个月VRR 将硬化组分为治疗有效组(VRR≥50%)及无效组(VRR<50%),比较有效组与无效组血流、囊壁厚度、囊液性状、病理类型的差异。将病理提示仅可见红细胞或吞噬含铁血黄素的组织细胞的结节定义为单纯出血性结节;病理提示除红细胞、吞噬细胞外,还有滤泡上皮细胞、胶质、钙化等其他成分存在的结节定义为非单纯出血性结节。


1.3 统计学方法 采用SPSS 25.0软件,符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验;不同随访时间结节体积及VRR比较采用重复测量方差分析;计数资料组间比较采用χ2检验,P<0.05表示差异有 统计学意义。
2 结果
2.1 治疗前临床资料 两组患者性别、年龄、治疗前结节体积、结节周边及内部血流情况、结节囊性成分占比差异均无统计学意义(P均>0.05),具有可比性。硬化组治疗前体积为2.79~28.12 ml,平均10.90(5.19,22.50)ml;微波消融组结节治疗前体积为8.82~17.35 ml,平均8.26(3.41,17.88)ml,见表1。
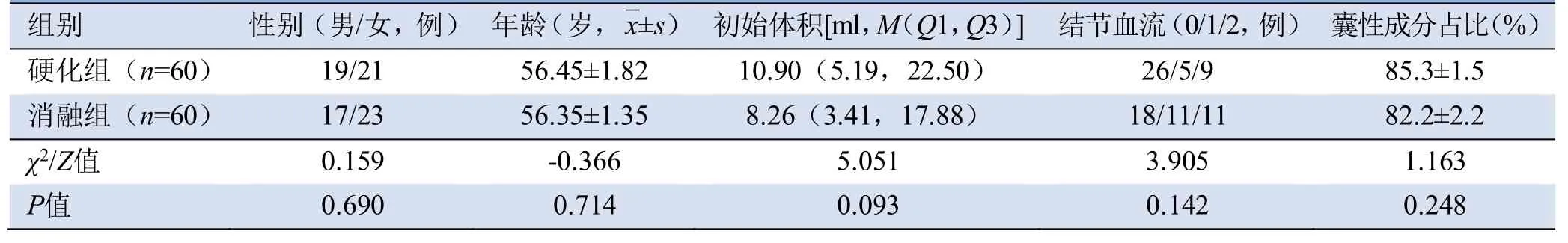
表1 硬化治疗组与微波消融治疗组甲状腺囊实性结节患者基线资料比较
2.2 治疗后结节体积及结节VRR
2.2.1 两组治疗后结节体积比较 各组结节体积随时间变化的趋势采用重复测量方差分析,组内不同随访时间结节体积差异有统计学意义(P<0.001),不同治疗组体积变化差异有统计学意义(P=0.024),随着随访时间延长,两组甲状腺囊实性结节体积均呈缩小趋势(图1、2及表2)。两组治疗后1、3、6个月结节体积见表3,治疗后1个月两组结节体积差异无统计学意义(P>0.05);微波消融组治疗后3个月、6个月结节体积小于硬化组,差异有统计学意义(P均<0.05)。

图1 女,38岁,良性滤泡性甲状腺结节,接受聚桂醇硬化治疗。治疗前结节大小约4.0 cm×2.5 cm(A);彩色多普勒血流显像示周边及内部可见点条状血流信号(B);硬化治疗中对该结节行囊液抽吸(C)聚桂醇注射液囊腔内注射留置,硬化治疗后即刻病灶大小约3.7 cm×2.5 cm(D);硬化治疗后1个月,病灶大小约3.0 cm×2.1 cm,VRR为66.25%(E);硬化治疗后3个月,病灶大小约2.4 cm×1.6 cm,VRR为82.17%(F);VRR:体积缩小率

表2 两组甲状腺囊实性结节不同随访时间结节体积变化趋势及组内差异性分析
2.2.2 两组治疗后结节VRR比较 治疗后1个月两组结节VRR差异无统计学意义(P>0.05),微波消融组治疗后3个月、6个月结节VRR高于硬化组,差异有统计学意义(P均<0.05),见表3。

表3 两组甲状腺囊实性结节不同随访时间结节体积变化及VRR比较[M(Q1,Q3)]
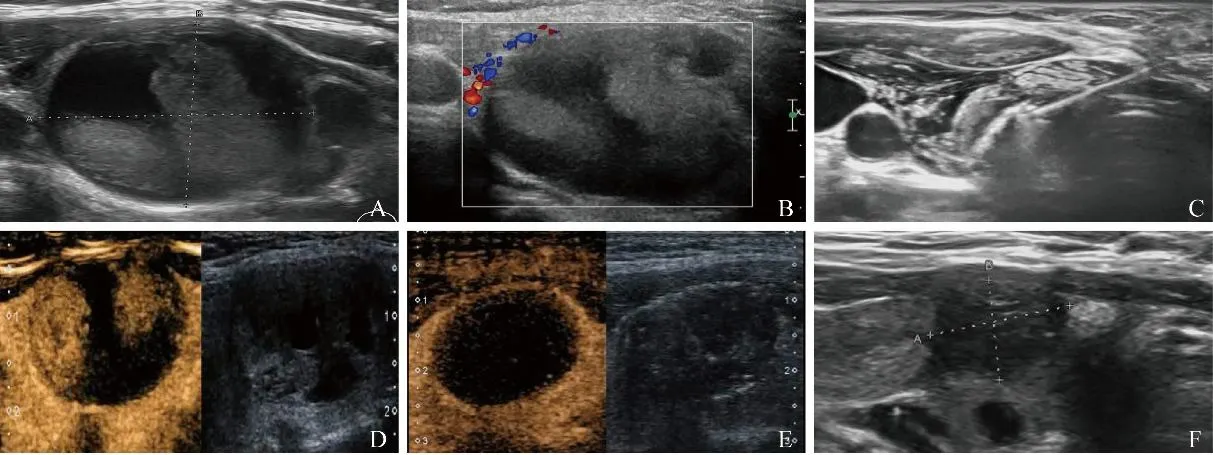
图2 女,64岁,良性滤泡性甲状腺结节,接受微波消融治疗。治疗前结节大小约3.5 cm×2.7 cm(A);彩色多普勒血流显像示周边少量点状血流信号(B);微波消融术中已消融区显示强回声光团(C);囊实性术前及术后造影对比:结节内灌注区域术后无造影剂进入(D、E);微波消融3个月后,消融灶大小约1.5 cm×1.0 cm,VRR为94.27%(F);VRR:体积缩小率
2.3 硬化组治疗后3个月疗效影响因素 硬化治疗有效组及无效组血流、囊壁厚度、囊液性状差异均无统计学意义(P均>0.05),两组病理类型差异有统计学意义,无效组非单纯出血型结节占比高于有效组,差异有统计学意义(P=0.031),见表4。

表4 硬化治疗无效组与有效组甲状腺囊实性结节的基线资料比较(例)
2.4 不良反应 聚桂醇硬化组7例发生不良反应,主要表现为轻至中度体温升高或伴吞咽不适,不良反应发生率为17.5%;多数患者上述症状3 d内自行消失。消融组9例发生不良反应,主要表现为颈部肿胀、疼痛、吞咽不适(5例)、声音嘶哑(4例),发生率为22.5%。
3 讨论
甲状腺囊实性结节是指既有囊性成分又有实性成分的甲状腺结节[6],多由肿瘤或非肿瘤结节(如良性结节性甲状腺肿)的囊性变引起。对于径线>2 cm、经病理证实为良性的甲状腺囊实性结节,若患者出现喘憋、疼痛等症状时可进行治疗。外科手术切除会留下瘢痕,且引起术后甲状腺功能减退;囊液抽吸治疗可迅速缓解症状,但短期复发的风险高达60%~90%[7-8]。超声引导下微创治疗包括微波消融及聚桂醇硬化治疗,因其疗效确切、安全性高、并发症少,在临床工作中得到广泛应用。
本研究的创新之处为单独纳入囊实性结节作为研究对象,并保证两组囊实性结节的囊性成分占比总体无差异;发现两组疗效存在显著差异后,进一步论证病理成分构成是囊实性结节疗效的重要影响因素,既往鲜有相关报道。
本研究纳入120个具有完整病历资料的囊实性结节,行术前评估后随机分为硬化治疗组及微波消融组,并行超声随访评估两组消融灶体积及VRR。随着随访时间延长,两组囊实性结节体积均呈缩小趋势,VRR呈上升趋势。治疗后1个月微波消融组与硬化治疗组结节体积及VRR无显著差异,随着随访时间延长,两组治疗效果有显著差异,与笔者的临床经验一致。无论是硬化治疗还是微波消融,约50%的患者治疗后1个月VRR均<50%,可能是由于两治疗组均纳入部分囊性成分<70%的结节。微创治疗通过灭活组织细胞启动机体的自身纤维化及修复过程,从而使病灶逐步缩小直至消失,因此实性成分占比越高,结节吸收越缓慢,治疗后1个月随访时,机体对于凝固坏死的细胞或组织吸收不充分不足以产生显著疗效,在既往研究中也得到证实[9]。本研究中囊实性结节硬化治疗后3个月、6个月后VRR低于微波消融组,可能由于微波消融与硬化治疗的作用机制不同所致:微波消融属于热消融,通过针尖的加热作用原位灭活囊实性结节内部及囊壁细胞,并可直接熔断供应血管,作用彻底;聚桂醇硬化治疗属于化学消融,通过激活细胞内的信号通路导致靶细胞发生凝固坏死,可以损伤血管内皮,导致无菌性炎症组织纤维化[10],若作用部位聚桂醇未达到有效浓度,很可能造成囊壁细胞灭活不完全及闭塞血管的机化再通,导致结节体积缩小减缓甚至停滞,其整体疗效不及微波消融显著。
进一步根据治疗后3个月VRR将硬化组分为治疗有效组(VRR≥50%)及无效组(VRR<50%),分析两组血流、囊壁厚度、囊液性状(是否黏稠)、病理成分构成之间的差异,结果发现硬化治疗有效组的单纯出血性结节占比更高,提示病理成分构成是硬化疗效的影响因素。单纯出血性结节细胞构成单一囊液容易抽吸,非单纯出血性结节多种细胞成分混杂,黏稠囊液附着于囊壁上易导致硬化不完全,残存的囊壁上皮细胞可以继续分泌囊液,影响治疗效果[11]。但直接根据囊液是否黏稠对硬化治疗结节进行分组时,并未发现硬化治疗有效组与无效组间有显著差异,造成这种结果的原因可能为:①纳入硬化治疗的结节数目较少,不足以产出阳性结果;②囊液黏稠度的改变不是影响聚桂醇疗效的关键因素,结节内不同成分疗效差异可能更重要,推测聚桂醇对于血细胞及吞噬细胞的作用较其他成分(如滤泡上皮细胞)更显著。
聚桂醇硬化治疗既往多用于治疗甲状腺囊性结节,陈肖俊等[8]针对114例囊性成分>90%的甲状腺结节注射聚桂醇,术后结节平均体积从12.5 ml缩小至0.2 ml,术后12个月VRR可达95.6%,该研究随访时间长且患者依从性较好;钱玮等[11]报道15例出血性结节治疗后3个月VRR约为93.2%,提示聚桂醇的作用效果在3个月随访已经趋于相对稳定,随访时间可酌情缩短,上述两项研究存在样本类型单一、样本量少等不足。陈肖俊等[8]分别对61例囊性结节及114例囊实性结节进行聚桂醇硬化治疗,术后3个月两组结节VRR分别为85.9%、66.9%,术后6个月分别为94.8%、79.6%。Dong等[12]以硬化治疗后3个月为节点,对于VRR<50%的结节采取二次硬化治疗或手术,发现囊性结节及囊实性结节的治疗有效率分别为91.7%、75.9%,可能更符合临床工作的需要。
既往研究表明,微波消融治疗甲状腺结节疗效明显,治疗后VRR约为45.9%~88.0%[13-15]。一项针对微波消融安全性研究的Meta分析纳入国内外10项研究共1 845个结节,结果发现治疗后6个月的总体VRR约为73.5%,但该研究并未按照结节类型进行亚组分析[14]。Yue等[15]纳入447例甲状腺结节,随访6个月后甲状腺结节整体VRR为65%,其中实性结节、囊实性结节、囊性结节的VRR分别为58%、83%、88%,证实微波消融治疗甲状腺良性结节的疗效与结节类型有关。王立平等[16]单独对囊实性结节进行微波消融,治疗后6个月VRR为82.3%,与Yue等[15]的研究结果一致,但样本量稍显不足。
囊实性结节在治疗方案选择上尚未达成共识,选择硬化治疗还是微波消融,相关指南并未给出较高等级推荐[4,17-18]。既往研究[19-20]针对囊性成分>80%的甲状腺囊性及囊实性结节进行微波消融与硬化治疗,结果发现微波消融的疗效优于硬化治疗,但该研究并未进一步分析疗效差异的原因。本研究中甲状腺结节VRR较既往研究报道略低,其原因为本研究纳入了部分囊性占比在50%~70%的结节,这些结节实性成分较多。同时,不同研究使用的超声仪器及消融设备具有差异,聚桂醇注射用量及注射方式也不尽相同,也会导致研究结果之间的细微差别。
本研究的局限性为样本量少、随访时间较短、缺乏多中心研究结果,可能会使结局指标出现一定程度的偏差。
在临床工作中我科对硬化治疗3个月VRR<50%的部分病例采用微波消融序贯治疗,1例患者治疗前结节体积约为39.07 ml,硬化治疗后3个月体积增至48.70 ml,追加微波消融治疗后体积缩小至2.70 ml,VRR为93.09%,与Lin等[6]开展的甲状腺结节硬化治疗与射频消融序贯治疗研究结果基本一致。本研究下一步将扩大硬化与微波消融序贯治疗的样本量,分析序贯治疗与单纯微创治疗的疗效差异,尝试为难治性结节提供新的诊疗思路。
总之,超声引导下微波消融治疗良性甲状腺囊实性结节疗效优于聚桂醇硬化治疗,硬化治疗效果受结节病理成分组成的影响。若为单纯出血性结节,可考虑聚桂醇硬化治疗;若结节内同时存在胶质、滤泡上皮细胞等其他成分,采用微波消融能取得满意的疗效。
