湖南油茶根际微生物的群落结构特征
2022-01-14陈隆升陈永忠彭映赫刘彩霞
唐 炜,陈隆升,陈永忠,彭映赫,刘彩霞
(1.湖南省林业科学院,湖南 长沙 410004;2.国家油茶工程技术研究中心,湖南 长沙 410004)
油茶是我国重要的木本食用油料树种,油茶产业的发展对于我国的经济发展、社会稳定、生态文明建设均具有重要的战略意义[1]。油茶广泛分布于我国南方地区,栽培区域土壤较为贫瘠。截至2019年底,湖南省油茶种植面积144.65万hm2,油茶籽产量109.9万t,茶油产量26.3万t,油茶产业年总产值471.6亿元,在扩大油茶林面积和提高产量、产值、科技水平等方面均取得了突出成效。但目前的茶油产量仍无法满足我国的粮油自供需求,所以增加油茶茶果产量、提升茶油品质、提高资源利用率等问题亟待解决[2]。
土壤是油茶生长的物质基础和支撑,而根际微生物是土壤中养分循环、能量转化的最主要组成部分[3]。前人的研究结果表明,土壤环境是调控拟南芥、杨树等林木根际微生物组结构的重要因子;Bonito等[4]对杨树、栎树和松树在3种土壤环境中的根际细菌和真菌群落进行分析,指出土壤性质对根际真菌群落组成的影响较大,宿主类型对根际细菌群落组成的影响较大。土壤pH、水分含量、碳氮含量比值、营养元素含量及土壤肥力等被认为是影响根际微生物组构建的重要因素[5-6],地理位置在决定根际微生物的组成中也发挥着重要作用。Coleman-Derr等[7]研究了在墨西哥和美国的7个地区龙舌兰根际细菌和真菌的群落结构,发现地理位置差异显著影响龙舌兰根际细菌和真菌的群落结构,且真菌受到的影响更大,这可能是真菌的地方扩散限制性造成的。通过比较美国不同气候区域5座城市的玉米根际微生物组,Peiffer等[8]发现美国东北部不同城市的玉米根际微生物群落组成较为相似,中西部不同城市的群落组成差异较大,这说明不能根据地理位置距离来充分解释根际微生物组的形成机制。植物类型也影响了根际微生物群落的构建[8-10]。Costa等[11]经研究发现,在不同土壤环境中,草莓的根际菌Actinobacteria组成相似,说明相较于土壤性质,植物种类在根际微生物组的形成中起着决定作用。Edwards等[12]指出,在控制条件下水稻根际微生物组的构建受土壤类型和宿主植物基因型的共同调控。Uroz等[13]研究了欧洲榉木和挪威云杉根际细菌、真菌和古菌菌群的构建,结果表明,树木品种对真菌和古菌的群落结构影响较大,对细菌的群落结构影响较小。在根际微生物群落的构建中究竟哪个因素起决定性作用尚未有一致的结论。
本研究中以油茶为研究对象,探究其根际微生物群落的特异性,研究不同立地条件、不同良种、不同抚育管理措施条件下油茶根际土壤微生物物种组成、群落结构及多样性的差异,解析油茶土壤微生物群落结构特征,以期为油茶林的地力调控、精准施肥提供参考,为油茶的提质增效提供数据支持。
1 材料与方法
1.1 试验地概况
试验地分别位于长沙市路口镇林场、长沙市天际岭林场和邵阳县七里山场。长沙市路口镇林场(113°11′E,28°22′N)属亚热带季风湿润气候,年平均气温16.8~17.2 ℃,年平均无霜期275 d,年平均降水量1 361.6 mm,土壤为红壤,成土母岩为泥质板岩和第四纪红土。长沙市天际岭林场(113°02′E,28°06′N)属亚热带季风湿润气候,年平均气温16~18 ℃,年平均相对湿度约为80%,年平均降水量1 200~1 700 mm,为低丘岗地地貌,土壤为第四纪红色粘土网纹层母质发育的酸性红壤。邵阳县七里山场(111°35′E,27°08′N)属中亚热带季风湿润气候,年平均气温16.9 ℃,无霜期平均为286.4 d,年平均降水量1 300.5 mm,土壤为红壤。
1.2 试验设计
在3个林场试验区域内选取2009年栽培的XL1号油茶林,研究不同栽培区域油茶根际微生物的群落结构;在长沙市路口镇林场选取2009年栽培的XL1、XL16、XL64和XL210共4个良种油茶林,研究不同油茶无性系根际微生物的群落结构特征;选择邵阳县七里山场抚育油茶林和未抚育管理的油茶林,比较其根际微生物群落结构特征。
每个试验区域选取20 m×40 m的样地,分别设置3个10 m×10 m的小样方。2018年5月,在每个样方(10 m×10 m)中,采集根系抖落土的混合土样,将其储存在-20 ℃的便携式冰箱中。土壤样品运至实验室后过筛(2 mm),筛除植物组织、根和岩石等,提取DNA样品并保存于-80 ℃冰箱中,剩下的土壤在阴凉处风干,用于进一步的化学分析。
1.3 指标测定
土壤pH采用电极法测定[14];土壤有机质含量采用重铬酸钾氧化分光光度法测定[15];土壤全氮含量采用凯氏定氮法测定[16];土壤全磷含量采用微波消解并使用全自动化学分析仪Smartchem 200进行测定[17-18];土壤全钾含量使用微波消解-分光光度法测定[19];土壤铵态氮和硝态氮含量采用分光光度法测定[20-21];土壤速效磷含量使用Mehlich 3浸提全自动化学分析仪测定[22];土壤速效钾含量使用Mehlich 3浸提火焰分光光度计法测定[23]。土壤总DNA使用Powersoil DNA分离试剂盒(MoBio,Carlsbad,CA,USA)进行分离纯化,根际微生物多样性采用Miseq平台高通量测序技术进行测定。
1.4 数据分析
使用Flash和Trimmomatic软件对测序结果进行质量过滤和优质序列拼接,得到有效数据,采用RDP Classifier算法对操作分类单元(OTU)中代表序列进行比对分析,并在各水平注释其群落的物种信息[24]。使用QIIME软件计算样品的α多样性指数(Chao1指数、Shannon指数和Simpson指数);使用QIIME软件计算β多样性距离矩阵。使用R语言vegan软件包对环境因子和土壤菌群群落相对丰度关系进行冗余分析(RAD),并采用LDA Effect Size(LEfSe)分析方法找到组间在丰度上有显著差异的物种[25]。
2 结果与分析
2.1 各栽培区域油茶根际微生物群落结构特征
2.1.1 各栽培区域油茶根际土壤的养分特征
3个栽培区域均位于湖南省内,虽然气候条件相似,但其土壤养分条件存在显著差异(表1)。路口镇油茶林地土壤pH为5.067,有机质、全氮、硝态氮及速效磷的含量显著高于其他样地。
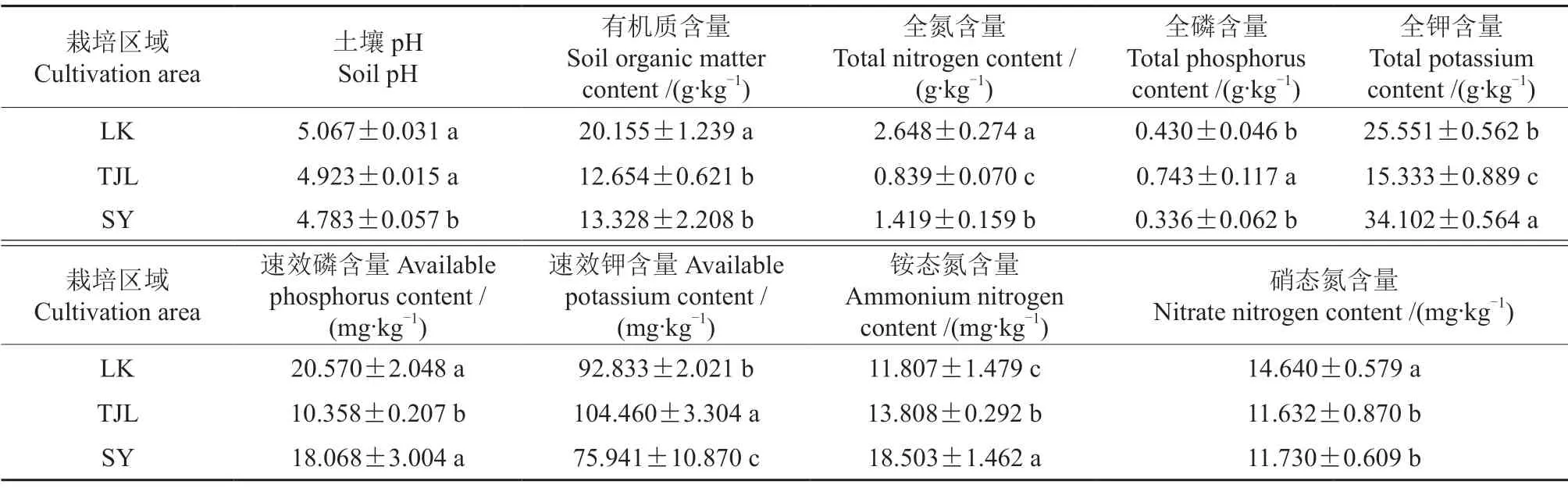
表1 各栽培区域油茶根际土壤的养分特征†Table 1 Nutrients characteristics of C.oleifera rhizosphere in each cultivation area
2.1.2 各栽培区域油茶根际微生物群落的多样性指数
各栽培区域油茶根际微生物群落的多样性指数如图1所示。由图1可以看出,长沙市路口镇林场油茶林地土壤细菌的丰富度和均匀度均最高,但真菌的丰富度和均匀度最低;邵阳县七里山场油茶林地土壤真菌的丰富度和均匀度显著高于其他样地。
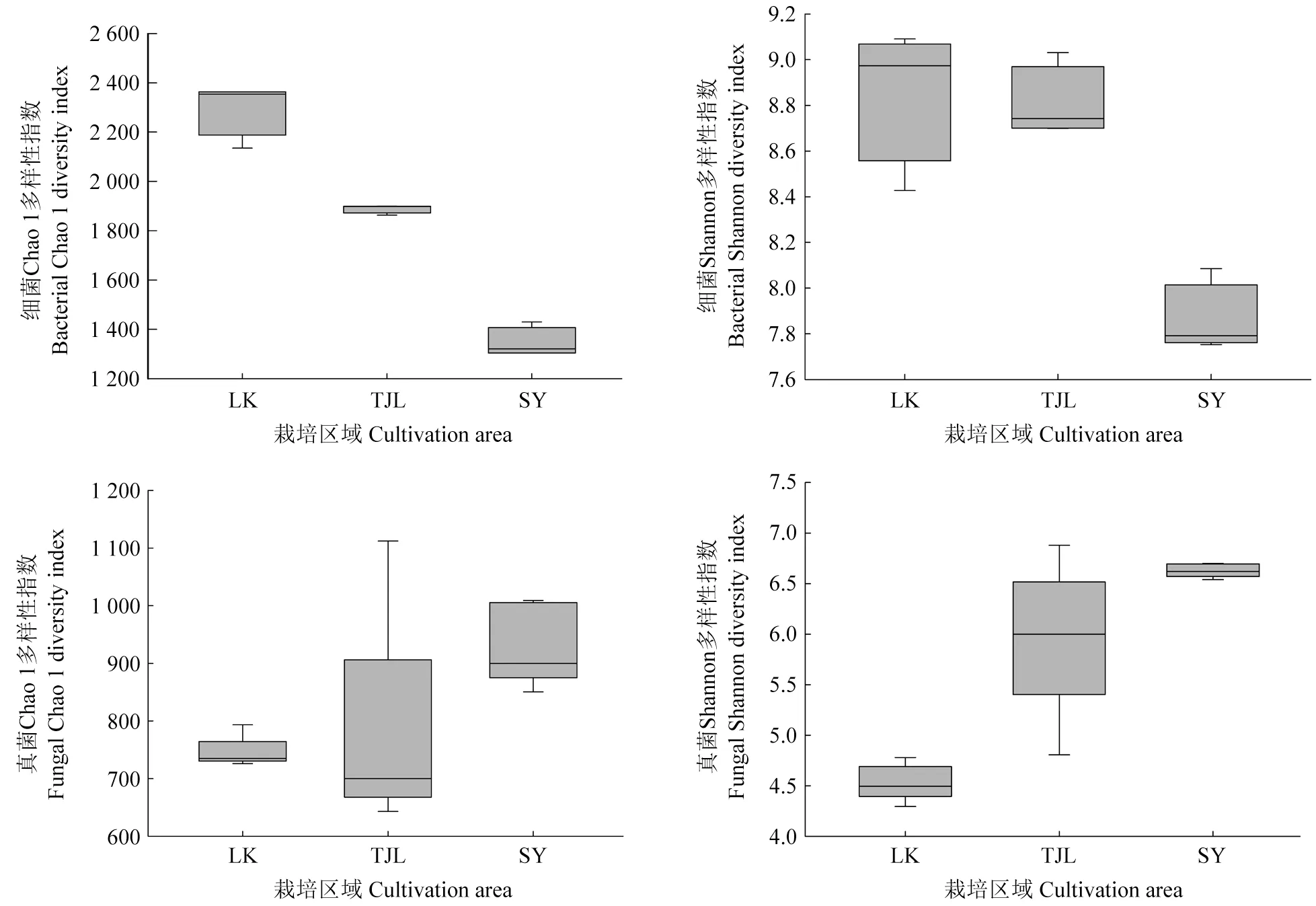
图1 各栽培区域油茶根际微生物群落的多样性指数Fig.1 The Diversity indexes of rhizosphere microbial communities of C.oleifera in each cultivation area
2.1.3 各栽培区域油茶根际微生物群落的结构
不同地理环境下油茶根际微生物群落的结构存在显著差异,除了共有的优势菌门外,邵阳县七里山场油茶根际土壤中AD3菌门占比较高。各样地中共有细菌OTU数量为289个,其中85.12%属于变形菌门、酸杆菌门、绿弯菌门和放线菌门;共有的真菌OTU数量为89,其中74.10%属于子囊菌门。共有细菌菌群中占比排在前20位的菌群有变形菌门的α变形菌纲红螺菌目Rhodospirillales、黄单胞菌目Xanthomonadales、黄色杆菌科Xanthobacteraceae、醋杆菌科Acetobacteraceae、慢生根瘤菌属Bradyrhizobium、不动杆菌属Acidibacter、 根霉菌属Rhizomicrobium、 鞘氨醇单胞菌属Sphingomonas、伯克霍尔德氏菌属Burkholderia、Reyranella属、纤维堆囊菌属Sorangium,绿弯菌门的JG37-AG-4菌纲、纤线杆菌目Ktedonobacterales,酸杆菌门的Subgroup_1和Subgroup_2菌纲、酸杆菌Subgroup_1菌科Acidobacteriaceae,放线菌门的盖勒氏菌目Gaiellales,拟杆菌门的盐碱厌氧菌目Halanaerobiales、热酸菌属Acidothermus,芽单胞菌门的芽单胞菌科Gemmatimonadaceae。共有且在真菌菌群中占比排在前10位的菌群为子囊菌门的古根菌Archaeorhizomycessp.、藤黄镰刀菌Fusarium guttiforme、织球壳菌Plectosphaerella cucumerina、Penicillium terrigenum、Coniosporiumsp.、黑酵母菌Herpotrichiellaceaesp.、无绒毛青霉菌Penicillium laeve、杜鹃花类菌根真菌Oidiodendron maius、淡紫拟青霉Purpureocillium lilacinum,担子菌门的糙孢菌Trechispora_sp.。
2.1.4 各栽培区域土壤因子对油茶根际微生物群落结构的影响
各栽培区域土壤因子对油茶林土壤中细菌群落结构影响的冗余分析结果如图2所示。由图2可以看出,3个地理区域内油茶根际土壤中微生物群落的分布存在显著差异,其中土壤中铵态氮和全钾含量对细菌群落结构的影响最为显著,全氮和速效磷含量对真菌群落结构的影响最为显著。
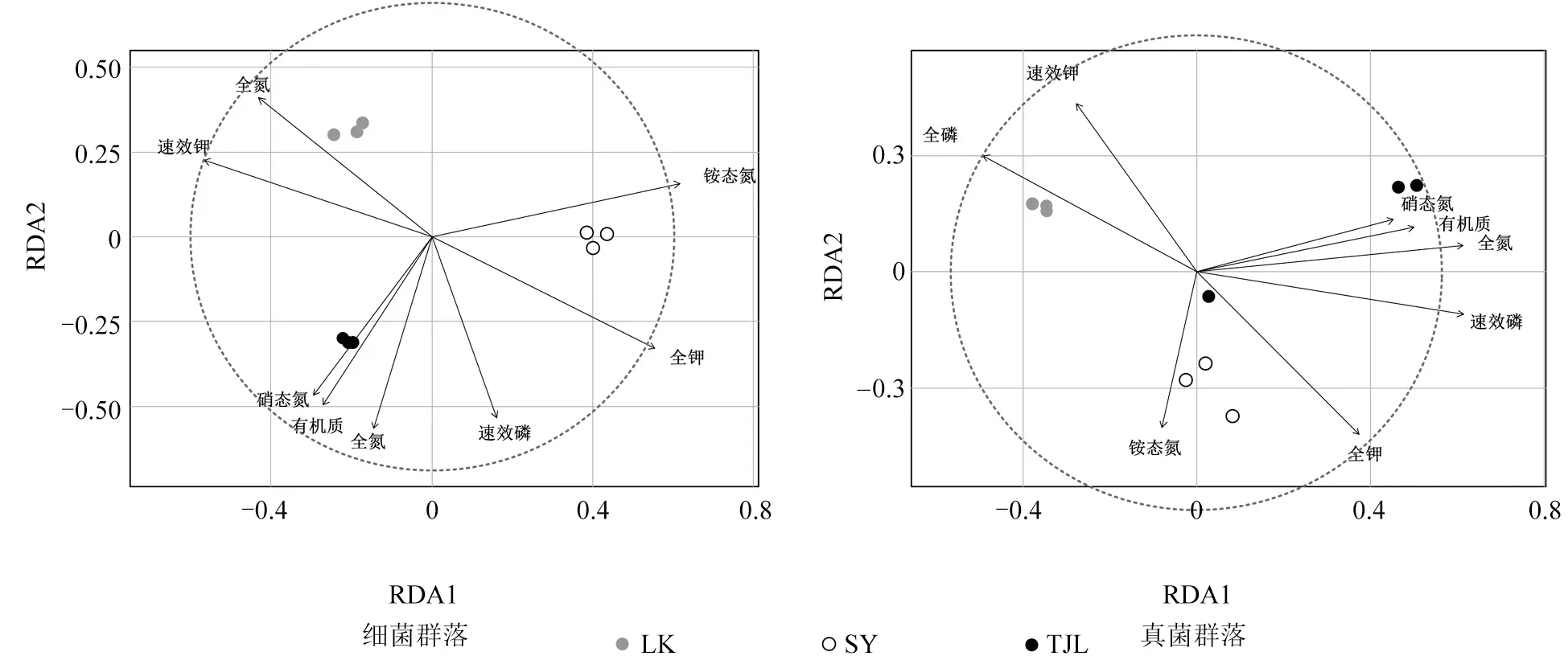
图2 各栽培区域土壤因子对油茶根际微生物群落结构影响的冗余分析(RAD)结果Fig.2 Redundancy analysis (RAD) result of the effect of soil factors on C.oleifera rhizosphere bacterial community structure in each cultivation area
2.2 同一栽培区域各油茶良种根际微生物群落结构特征
2.2.1 同一栽培区域各油茶良种根际微生物群落的多样性指数
长沙市路口镇林场各油茶良种根际微生物群落的多样性指数如图3所示。由图3可以看出,同一栽培区域不同油茶良种根际微生物的群落均匀度存在显著差异,细菌群落的丰富度差异显著,但真菌群落丰富度差异不显著。XL1根际土壤中细菌OTU总量、细菌群落物种丰富度及均匀度均最高,XL64根际土壤中真菌OTU总量、真菌群落物种丰富度及均匀度指数最高。
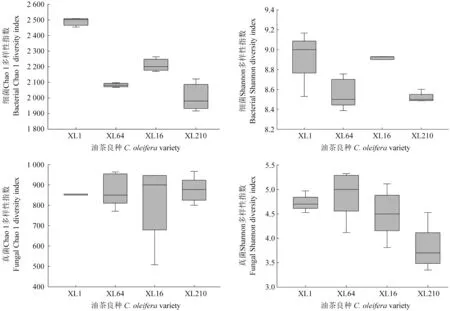
图3 长沙市路口镇林场各油茶良种根际微生物群落的多样性指数Fig.3 Diversity indexes of rhizosphere microbial community of different C.oleifera varieties in Lukou town forest farm of Changsha City
2.2.2 同一栽培区域各油茶良种根际微生物群落的结构
在同一栽培区域所有油茶良种根际微生物群落中,共有的细菌OTU比例为39.2%,共有的真菌OTU比例为46.1%。长沙市路口镇林场各油茶良种根际细菌群落门水平的结构如图4所示。由图4可以看出,构成不同油茶良种根际细菌群落占比排在前10位的菌门相同,优势菌门均为变形菌门Proteobacteria、酸杆菌门Acidobacteria和绿弯菌门Chloroflexi,群落结构中除优势菌门占比略有差异外,其他主要菌门的占比差异不显著。构成不同良种油茶林根际真菌群落的优势真菌均为子囊菌门Ascomycotap,且子囊菌门Ascomycotap和担子菌门Basidiomycotap的总和均占真菌群落总量的95%以上。
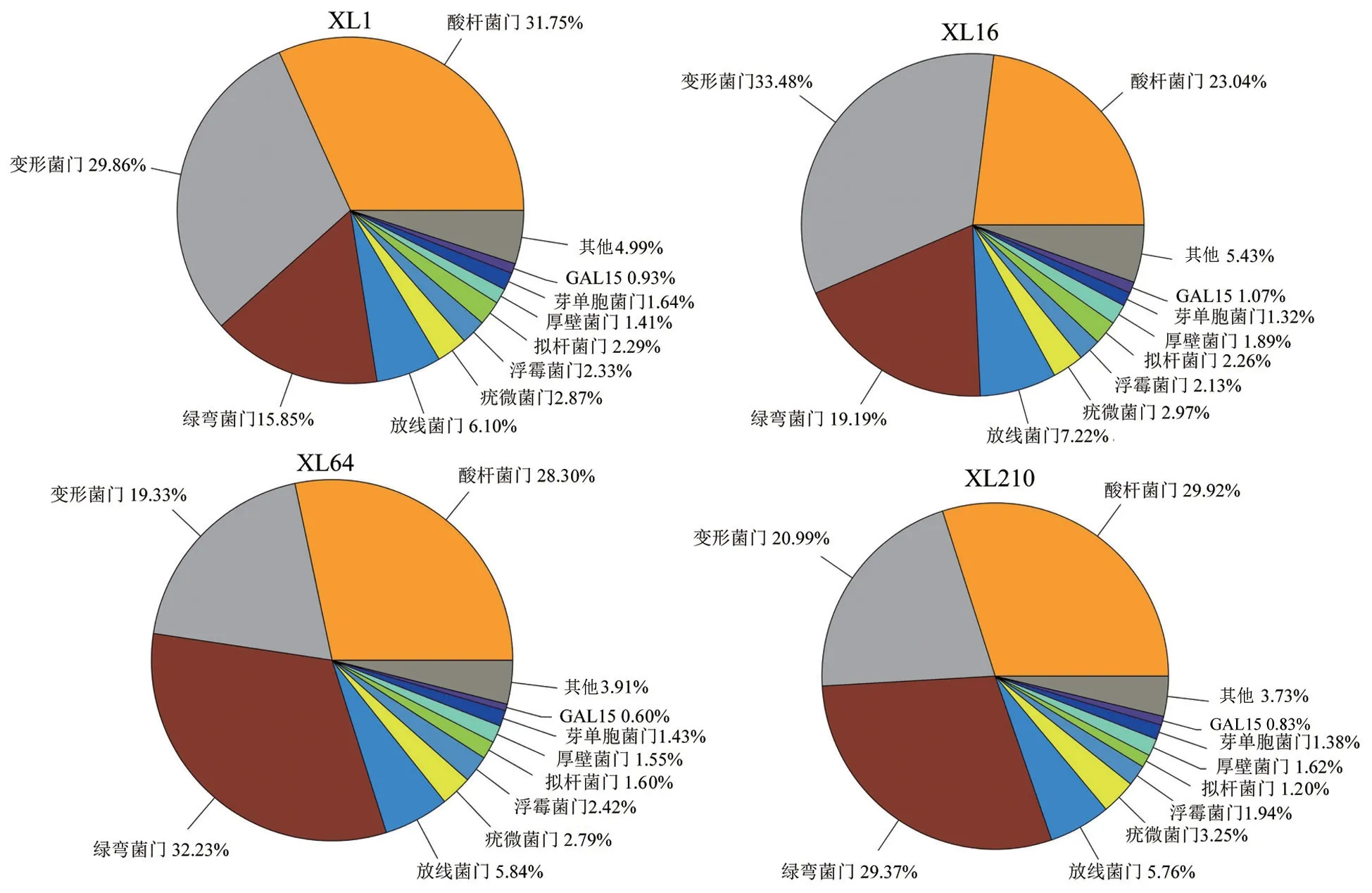
图4 长沙市路口镇林场各油茶良种根际细菌群落门水平的结构Fig.4 Community structure of rhizosphere bacterial phylum of different C.oleifera varieties in Lukou town forest farm of Changsha City
2.3 同一栽培区域不同抚育管理条件下油茶根际微生物群落结构特征
同一栽培区域的抚育人工油茶林与未抚育油茶林样地的根际细菌、真菌的OTU总量均无显著差异,但多样性指数存在显著差异。未抚育油茶林根际细菌和真菌群落的菌种丰富度指数较高,但抚育人工油茶林根际的真菌群落均匀度指数较高。邵阳县七里山场不同抚育管理条件下油茶根际微生物群落门水平的结构如图5所示。由图5可以看出,抚育人工林根际土壤中绿弯菌门为细菌优势菌群,占比约为55.72%,子囊菌门为真菌优势菌门,占比为57.77%。未抚育油茶林根际土壤中,酸杆菌门为细菌优势菌群,占比为35.81%,子囊菌门为真菌优势菌门,占比为48.86%。除优势菌群外,抚育人工油茶林与未抚育油茶林样地的根际细菌群落中疣微菌门Verrucomicrobia差异最为显著,在未抚育油茶林根际中占比显著高于抚育人工油茶林。
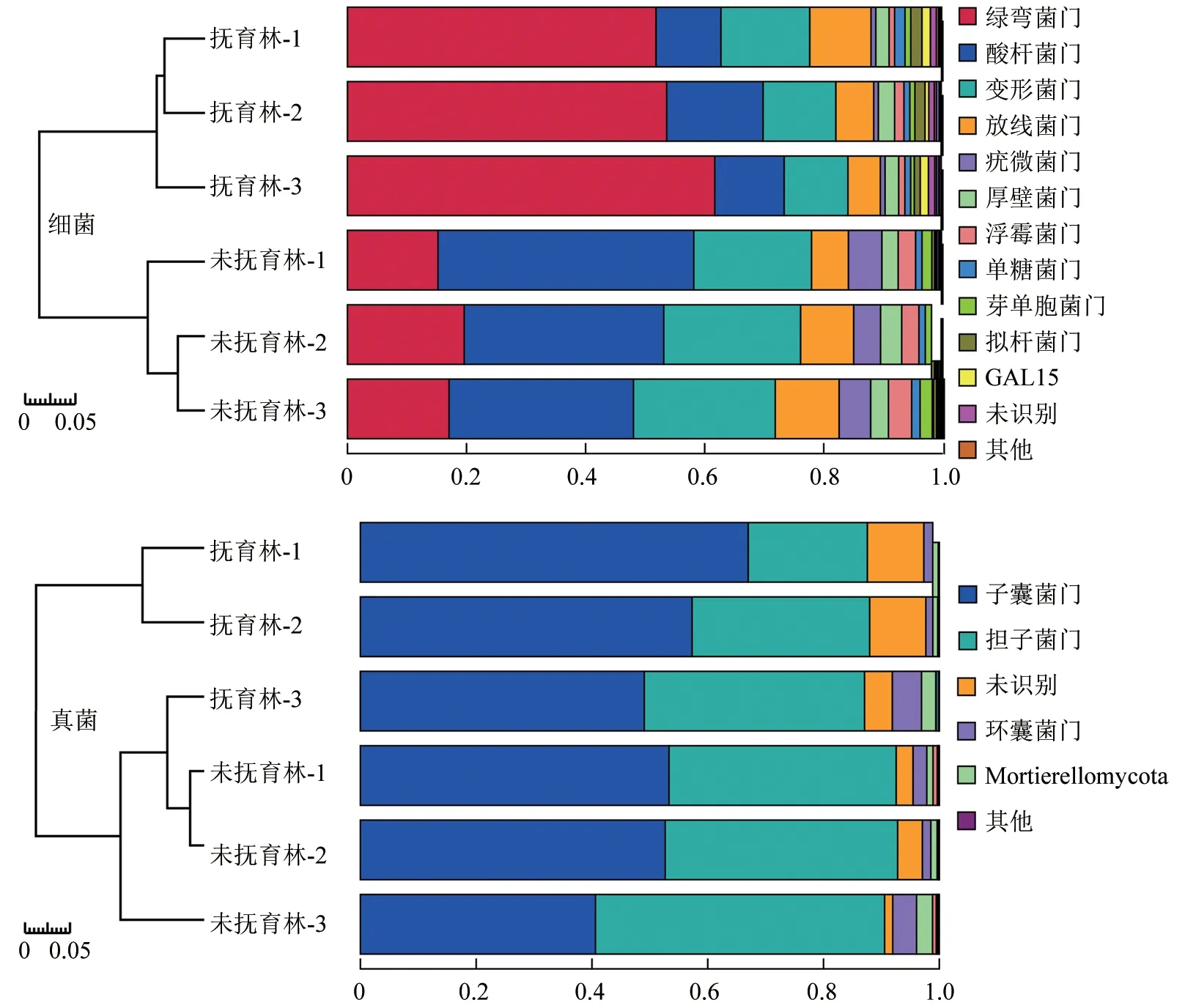
图5 邵阳县七里山场不同抚育管理条件下油茶根际微生物群落门水平的结构Fig.5 Rhizosphere community structure in phylum level under different tending management measures in Qilishan farm of Shaoyang County
2.4 油茶根际共有微生物群落的结构特征
虽然立地条件、油茶良种以及抚育管理措施均对油茶根际微生物群落结构产生影响,但在各种影响因素下油茶根际仍存在共有微生物群落。采用spearman检验方法,选取所有样本绝对丰度排在前20位的共有细菌OTU与门水平注释结果相互关联,结果如图6所示。图6中圆点的大小代表OTU丰度,线的粗细代表相关性。
由图6可以看出,油茶根际共有的主要细菌菌群包含6个酸杆菌门Acidobacteria酸杆菌科的第1亚 群Acidobacteriaceae Subgroup 1(OTU8、OTU10、OTU14、OTU35、OTU53、OTU98),3个酸杆菌门的第2亚纲Acidobacteria Subgroup 2(OTU1、OTU5、OTU9),1个酸杆菌门索利氏菌科solibacteraceae的Candidatussolibacter属(OTU41),5个绿弯菌门Chloroflexi的JG37-AG-4纲(OTU7、OTU12、OTU13、OTU3、OTU2788),1个绿弯菌门纤线杆菌目Ktedonobacterales的HSB_OF53-F07科(OTU16),1个变形菌门Proteobacteria的黄色杆菌科Xanthobacteraceae(OTU37),1个 变形菌门Xanthomonadales_Incertae_Sedis科的不动杆菌属Acidibacter(OTU18),1个变形菌门慢生型大豆根瘤菌Bradyrhizobium(OTU6),1个放线菌门的酸热菌科Acidothermaceae的酸热菌属Acidothermus(OTU45)。油茶根际真菌群落中子囊菌属Archaeorhizomyces的丰度值显著高于其他菌群,为绝对优势菌群,革菌科下革菌Thelephora-Tomentella(OTU11)与其他10个菌群均存在显著的正相关关系,为主要的伴生、促生菌群。

图6 油茶根际微生物群落的共线网络Fig.6 Bacterial community structure co-occurrence network
3 结论与讨论
本研究结果表明,不同栽培区域的油茶根际土壤养分特征和微生物群落结构存在差异。土壤中铵态氮含量和全钾含量对细菌群落结构的影响最为显著,这可能是不同栽培区域的油茶根际微生物群落结构存在差异的主要原因。金章利等[26]在山地草地的土壤研究中发现土壤微生物群落多样性与土壤养分含量呈正相关。大量研究结果表明,土壤中养分的高度可利用性是造成土壤微生物生物量增加的主要因素[27-28]。但本研究中所选择的栽培区域较少,为了探明不同栽培区域油茶根际土壤微生物群落结构的差异,后续将对湖南省内具有代表性的栽培区域开展持续性调查研究。
XL1号等4个油茶主栽品种栽培10年后油茶林根际细菌群落丰富度的差异较为显著,但真菌群落丰富度差异不显著。Nicole等[29]采用基因芯片技术分析了3个马铃薯品种的根际微生物群落结构,发现4%~9%的OTU相对丰度变化与植物宿主品种相关,其中,链霉菌科Streptomycetaceae表现出强烈的宿主相关性。Peiffer等[8]的研究结果表明,27种携带不同母本基因的玉米根际具有不同的微生物群落结构。转基因土豆Solanum tuberosum和水稻Oryza sativa具有与母本植物不同的根圈微生物群落结构[30-32]。本研究结果表明,在未进行抚育管理的油茶林中,油茶根际细菌和真菌的菌种丰富度指数均较高,且除优势菌群外,疣微菌门Verrucomicrobia群落差异最为显著。未抚育管理的油茶林中虽然土壤养分含量较低,但因为油茶生长周期长且林分无人为扰动,微生物的群落结构相对丰富,寡营养型细菌生长良好。疣微菌门是一种寡营养型细菌,具有固氮作用和反硝化作用,在油茶的氮循环中起重要作用[32]。
植物对土壤微生物群落和功能有极为重要的生物化学影响。植物在整个生命周期(生长期和凋亡期)不断向其立地土壤输入植物源有机物(根际沉积和凋落物),为土壤微生物提供了丰富的碳源和营养物质,对土壤微生物群落组成和功能产生巨大影响,这也是根际土壤微生物群落结构和功能具有植物群落特异性假设的基础[33-36]。本研究结果表明油茶存在特异性的根际微生物群落,其主要组成为酸杆菌门的酸杆菌科、索利氏菌科Candidatussolibacter属等,绿弯菌门的JG37-AG-4纲、纤线杆菌目等,变形菌门的黄色杆菌科、不动杆菌属、慢生型大豆根瘤菌等,放线菌门的酸热菌属等,子囊菌门的子囊菌属,担子菌门的革菌科下革菌等。根据基于微生物绝对丰度提出的植物根际微生物群落“扩增-选择”组装的新模型[37],认为变形菌门、拟杆菌门和放线菌门是根际富集的主要菌群,酸杆菌门是根际排斥的主要菌群,放线菌门、γ-变形菌门及Δ-变形菌门从根际土进入根内的比例最大。在后续研究中将进一步验证酸杆菌门由于相对丰度和绝对丰度引起的根系富集或排斥的结论。革菌科下革菌为重要的植物外生菌根真菌,油茶的菌根真菌以外生菌根为主,所以后续的菌肥研究中将注重革菌科下革菌的分离、培养及应用等。
