珍稀植物华木莲SRK基因的克隆与亚细胞定位
2022-01-14邱珊姗邓凌帆刘苗苗张建强王颜波刘齐元王建革
邱珊姗,邓凌帆,刘苗苗,张建强,王颜波,刘齐元,王建革*
(1.江西农业大学 林学院,江西 南昌 330045;2.南昌工程学院 水利与生态工程学院,江西 南昌 330029;3.江西农业大学 农学院,江西 南昌 330045)
【研究意义】植物杂交育种重要的目的之一是充分利用杂种优势。作为促进异交防止近交的繁育机制,自交不亲和(self-incompatibility,SI)是开花植物中广泛存在的现象,但对于专性自交不亲和植物来讲,虽然后代均为杂交种,但由于亲本杂合,很难获得最大杂种优势。自交不亲和与自交亲和相互转换在自交不亲和植物中非常普遍[1-4],如果专性自交不亲和植物能够从自交不亲和转变成自交亲和,则可以通过自交育种途径获取最大杂种优势,从而为自交不亲和物种育种开辟新的途径,因此,研究自交不亲和机理对于专性自交不亲和植物育种方式转变具有重要意义。珍稀木兰科(Magnoliaceae)植物华木莲(Sinomanglietia glauca)为迟发性自交不亲和(late-acting SI,LSI)物种,研究发现其存在孢子体自交不亲和(sporophytic SI,SSI)决定基因S 位点受体激酶(S_locus receptor kinase,SRK)基因高度同源的基因。研究该基因在华木莲自交不亲和中的作用,不仅为揭示华木莲自交不亲和机理研究提供理论资料,对华木莲育种方式改变也具有重要意义。【前人研究进展】基于表型遗传控制模式,通常将植物自交不亲和分为配子体自交不亲和(gametophytic SI,GSI)及孢子体自交不亲和(SSI)两类,后来,又分出了迟发性自交不亲和(LSI)类型[5-6]。研究表明,自交不亲和由一个S位点控制,其上包含2个紧密连锁的S基因:花粉S决定基因和雌蕊S 决定基因,它们以单倍型形式出现,连锁被打破则会造成自交不亲和向自交亲和的转换[2]。在具有配子体自交不亲和特性的车前科(Plantaginaceae)、茄科(Solanaceae)和蔷薇科(Rosaceae)植物中,雌蕊S 决定因子为柱头S 核糖核酸酶(S-ribonuclease,S-RNase),花粉S 决定因子为花粉S 位点Fbox(S-locus F-box,SLF)或S 单倍型特有F-box(S-haplotype-specific F-box,SFB)。罂粟科(Papaveraceae)植物中自交不亲和虽然也为配子体自交不亲和,但雌蕊决定因子为柱头乳头细胞分泌蛋白(stigmaexpressed secreted protein,PrsS),花粉决定因子为花粉表达跨膜受体蛋白(pollen-expressed transmembrane protein,PrpS)[7]。十字花科(Brassicaceae)植物中自交不亲和为孢子体自交不亲和类型,雌蕊决定因子为柱头S位点受体激酶(SRK),花粉决定因子为花粉外壳S位点富半胱氨酸蛋白(S-locus cysteine-rich protein,SCR)或S 位点蛋白11(S-locus protein 11,SP11)[8]。相对于上述两种自交不亲和,迟发性自交不亲和研究相对滞后,遗传机制并不清楚。研究表明,迟发性自交不亲和通常分布于同科或同属物种中[6],在木兰科(Magnoliaceae),除华木莲(S.glauca)外,白玉兰(Magnolia denudata)自花授粉后花粉管生长与异花花粉管生长相同,但胚珠发育停滞在鱼雷期,也表现迟发性自交不亲和[9]。迟发性自交不亲和在被子植物基部类群中发现较多,这些物种在系统发生上聚集成簇,但详细研究仅限于基部类群中的五味子科(Schisandraceae),不过木兰分支自交不亲和物种中尚未发现配子体自交不亲和与孢子体自交不亲和类型[6]。值得关注的是,虽然迟发性自交不亲和分子机制并不清楚,但在具有迟发性自交不亲的特性的山茶科茶树(Camellia sinensis)中发现了与孢子体自交不亲和雌性决定基因SRK基因高度同源基因[10-11]。SRK同源基因是目前迟发性自交不亲和中发现的唯一一类与已知自交不亲和基因高度同源的基因,这引发了以下问题:1)SRK基因是否在迟发性自交不亲和反应中起作用?2)如果起作用,其功能是什么?在什么部位、在何时起作用?3)如果SRK基因在迟发性自交不亲和中无作用,如此保守的SRK基因的功能是什么?华木莲(S.glauca),又名落叶木莲(Manglietia decidua),是木兰科珍稀植物,形似木莲,落叶特性上又与木兰相似,进化上处于木莲属和木兰属连接位置,在被子植物起源和演化方面具有重要科研价值[12-13]。华木莲花果、干形均具观赏价值,在园林应用上也极具应用前景。目前华木莲分布在江西宜春明月山和湖南永顺个别地区,分布区呈狭岛状,面积不足36 km2,被列入国家保护和拯救物种[13-14]。华木莲生存竞争力弱,种群天然更新能力差,扦插、组培均未成功,目前只能靠种子繁殖。细胞学和胚胎学研究表明,华木莲大小孢子正常、胚胎发育也正常[15-16]。传粉生物学表明,华木莲虽然数量不多,且具自交不亲和特性,但野生70 年生植株仍有单株产果约45 kg、产籽45 000 粒的能力,人工繁育表明,经过低温沙藏的种子萌发率在90%以上[17]。以上结果表明生殖保障并非是华木莲濒危的原因,濒危原因在于生存竞争力弱。华木莲为专性自交不亲和植物,如果能改变华木莲繁育方式,通过人工培育,充分利用杂种优势,提高华木莲生存竞争力,则将为华木莲育种带来新局面。华木莲自花和异花花粉管生长6 h并无差别,未授粉心皮在7 d 左右脱落,自花授粉心皮在15 d 左右脱落,表现迟发性自交不亲和特征,转录组分析鉴定出了SRK高度同源基因SgSRK。为了揭示SgSRK基因在华木莲迟发性自交不亲和中的作用,本研究对该基因进行了克隆和亚细胞定位研究,研究结果表明SgSRK基因具有典型的SRK结构域和理化性质,拥有信号肽和跨膜结构,具备磷酸化功能,亚细胞定位观察支持该基因编码蛋白定位在细胞膜和细胞质中。
【本研究切入点】鉴于到目前为止,SRK同源基因是目前迟发性自交不亲和中发现的唯一一类与已知自交不亲和基因高度同源的基因,因此,研究华木莲SRK同源基因在迟发性自交不亲和中的作用成为揭示华木莲自交不亲和机制的着手点。【拟解决的关键问题】SgSRK克隆及亚细胞定位观察可为研究该基因在华木莲自交不亲和中的功能及如何发挥功能的提供依据,进而为揭示华木莲自交不亲和机理提供数据。
1 材料和方法
1.1 试验材料
华木莲栽植于江西农业大学校园中。花期取授粉后3 h 自花授粉心皮用液氮固定,后置于-80 ℃贮存,用于总RNA提取。瞬时表达供试材料为烟草品种K326,将种子用蒸馏水冲洗后,置于培养皿中室温催芽1~2 d,后置于人工气候箱培养,条件为光/暗时间为16 h/8 h,光/暗温度为24 ℃/18 ℃,湿度为85%条件下培养,60 d后至5~6片真叶展露后用于农杆菌介导的瞬时表达。
1.2 华木莲SgSRK 基因克隆
TaKaRa MiniBEST Plant RNA Extraction Kit 和PrimeScriptTM1st Strand cDNA Synthesis Kit 购自TAKARA公司,pGME-T Easy 载体购自PROMEGA 公司,大肠杆菌DH5α购自擎科生物公司。RNA提取和反转录参照试剂盒程序进行。以冻存心皮为材料提取总RNA,然后用Oligo dT和随机6-mer引物为反转录成cDNA。根据前期转录组测序结果设计引物,SgSRK基因全长扩增引物为:Forward primer:5′-ATGGCTTTTCACATTTCATTCC-3′,Reverse primer:5′-CTATCGAGCTTCCAGCTCA-3′。反应体系为25 μL,包括2×T5 Super PCR Mix for PAGE 12.5 μL,正向引物1 μL,反引物各1μL,模板1 μL,Nuclease-Free Water 9.5 μL。扩增程序:98 ℃3 min 变性,然后98 ℃30 s,59.8 ℃30 s,72 ℃50 s,共40 个循环,最后72 ℃2 min,4 ℃保存。PCR 产物进行琼脂糖电泳,目的产物用低熔点琼脂糖凝胶回收。将回收产物连接到pGME-T Easy 载体上,然后通过热激法转化至大肠杆菌DH5α,用PCR 扩增挑取阳性克隆,送擎科公司测序。
1.3 序列生信分析
为了明确克隆基因编码蛋白的理化性质,测序后序列编码蛋白氨基酸组成用BioXM 2.6 进行了推测;利用Pfam 数据库(http://pfam.xfam.org/)对编码蛋白结构域进行了分析,hmmer(https://www.ebi.ac.uk/Tools/hmmer)验证,用ExPASy(https://web.expasy.org/protscale/)对编码蛋白疏水性进行了预测,用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对编码蛋白跨膜区进行了推断,用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)对编码蛋白信号肽进行了确认。最后用Cell-PLoc 对编码蛋白的亚细胞定位进行了预测。
1.4 进化分析
为了探讨SgSRK基因与已知物种SRK基因间的系统发育关系,基于SRK 同源蛋白序列构建了系统发育树。从NCBI(https://www.ncbi.nlm.nih.gov/)搜索已报道的不同物种SRK蛋白序列,去除不完整序列,同一物种蛋白取最长序列。所得到的序列然后用hmmer(https://www.ebi.ac.uk/Tools/hmmer)加以鉴定,最后使用IQ-TREE 软件基于最大似然法构建系统发育树,Bootstrap 1 000 次,进化树用Evolview(https://www.evolgenius.info/evolview)展示。
1.5 表达载体构建
表达载体pCAMBIA1302和NcoI酶、KpnI酶和SpeI酶购自擎科生物公司,程序参照试剂盒说明进行。对含有目的基因片段的DH5α 用LB 液体培养基(Tryptone 10g/L,Yeast extract 5 g/L,NaCl 10 g/L)培养6 h后,用质粒提取试剂盒提取质粒。对含目的片段pGME-T Easy 克隆载体用NcoI 酶切,回收目的片段,同时对表达载体pCAMBIA1302 也用NcoI 酶切,在表达载体多克隆位点NcoI-SpeI 处切开,然后将目的基因片段与之相连。将重组表达载体转化DH5α 感受态细胞扩增,然后提取质粒对构建好的重组载体用KpnI/SpeI酶切验证连接正确性。
1.6 SgSRK基因亚细胞定位
感受态农杆菌GV3101购自上海唯地生物技术有限公司,农杆菌转化参照唯地公司程序进行。提取含有目的基因片段的表达载体质粒后,通过热激法导入农杆菌GV3101 中,于28 ℃下振荡培养2~3 h,然后于含卡那霉素和潮霉素抗性的LB 固体培养基上28 ℃下进行培养2~3 d,对生长出的克隆用PCR 进一步验证。挑选出的阳性克隆用含卡那霉素和潮霉素抗性的LB 液体培养基上28 ℃下振荡培养,菌液OD600=1.0时,通过注射法侵染烟草叶片,黑暗条件下放置12 h后置于正常条件下生长36 h,用Olympus荧光显微镜检测,共检测6个叶片,每个叶片3个视野。
2 结果与分析
2.1 SgSRK基因克隆及序列分析
根据前期转录组结果设计引物,利用RACE 方法,克隆到的基因片段共计2 463 bp,命名为SgSRK(GenBank登录号:MW139903),编码蛋白820个氨基酸,分子量92.218 ku,等电点7.15(图1)。
2.2 SgSRK结构分析
SgSRK 结构分析如图2 所示。Pfam 分析表明,SgSRK 含有4 个结构域:B_lectin(PF01453)、S_locus_glycop(PF00954)、PAN-2(PF08276)、Pkinase Tyr(PF07714)(图2a)。B_lectin结构域位于73~174 aa处,主要功能可能为结合单糖,结合D-甘露糖凝集素。S_locus_glycop结构域,即S 位点糖蛋白结构域,位于206~315 aa处。十字花科植物中,S位点糖蛋白及S位点受体激酶与多个S等位基因相互连锁在一起,构成S位点。PAN-2结构域位于336~402 aa处,包含3个二硫键的保守核心,是触发蛋白互作的关键。Pkinase Tyr结构域位于505~774 aa 处,催化特异酪氨酸磷酸化反应。酪氨酸激酶是一种能将磷酸基团从ATP 转移到细胞蛋白的酶,导致蛋白构象发生变化,在许多细胞功能中,充当开关功能。ExPASy ProtScale 分析表明,编码蛋白存在疏水区(图2b),TMHMM 分析支持上述结果,蛋白跨膜区域位于430~452 aa 处(图2c)。SignalP-5.0 分析表明,编码蛋白存在一个信号肽,切点在23~24 aa 处(图2d)。Cell-PLoc 2.0进行亚细胞定位分析表明,其定位于细胞膜与细胞质中。
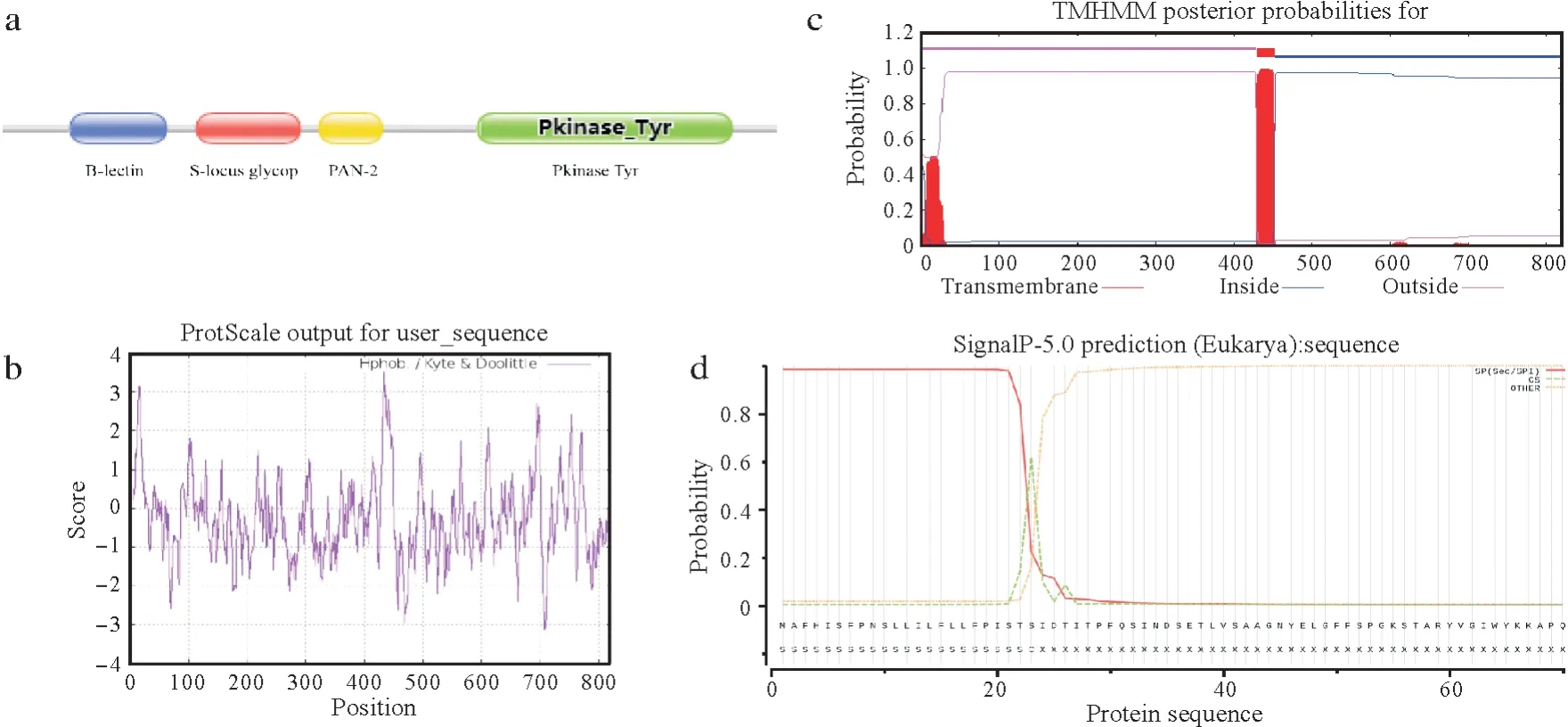
图2 SgSRK结构分析Fig.2 Structure analysis of SgSRK
上述分析表明,SgSRK 具有胞外域,跨膜域、激酶域,存在信号肽,具有磷酸化功能,是一个跨膜蛋白,与孢子体自交不亲和雌性决定因子SRK结构特征一致。
2.3 系统进化分析
在NCBI 上搜索已报道存在自交不亲和物种SRK 蛋白,加上SgSRK,最终得到18 个序列。经过hmmer鉴定,所有序列不仅存在4个共同结构域:B_lectin、S_locus_glycop、PAN_2、Pkinase Tyr,而且顺序也一致。利用这18 个物种SRK 构建系统发育树,最佳模型为JTTDCMut+F+I+G4,构建的发育树如图3 所示。根据系统树,基部类群、木兰分支、单子叶植物、真双子叶植物类群各自然分开。基部类群无油樟(Amborella trichopoda)在最外侧,其次是木兰类华木莲,接着是单子叶植物菠萝(Ananas comosus)。在真双子叶植物中,所有十字花科SRK聚为一支,同属物种聚在一起。木兰分支的华木莲SgSRK与基部类群无油樟SRK距离较近,处于单子叶和真双子叶植物外,距离真双子叶超蔷薇类顶端的十字花科SRK较远。虽然是基因树,但SRK基因树大致与物种进化地位相应。
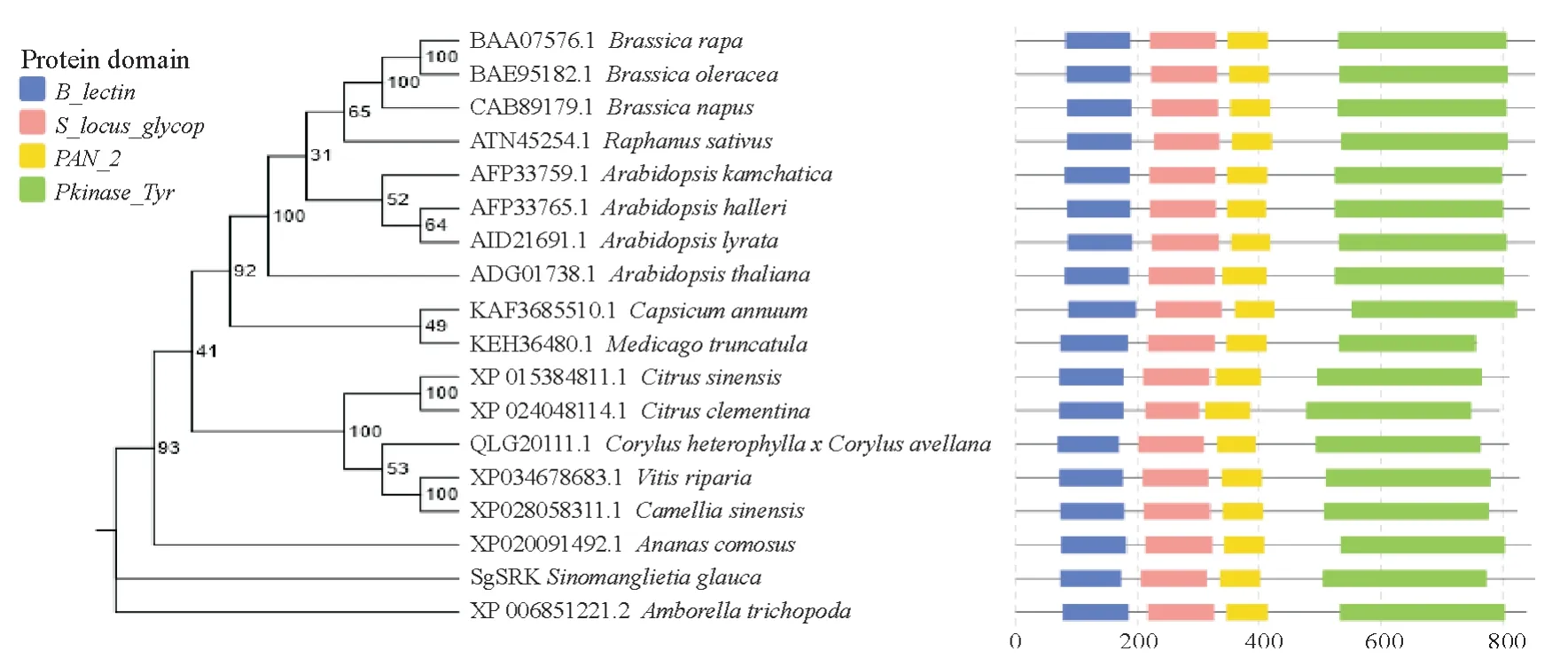
图3 SRK系统进化树Fig.3 Phylogenetic tree of SRK
2.4 华木莲SgSRK基因的表达载体构建
构建的表达重组载体如图4a 所示。表达载体pCAMBIA1302 具有35S 强启动子和GFP 荧光蛋白基因,并携带卡那霉素抗性基因和潮霉素抗性基因。从克隆载体回收的SgSRK基因,连接在表达载体的NcoI-SpeI 多克隆位点。重组载体构建后,插入位点处酶切识别位点变化,不能从插入点通过酶切回收SgSRK基因,但可通过PCR 扩增获得。对构建好的载体用KpnI/SpeI 进行酶切。图谱中质粒有开环和闭环两种形式,呈现两条带(图4b)。用于侵染的农杆菌菌株摇菌后进行PCR 验证(图4c),以保证含有目的基因片段。检测结果如图4所示。结果表明,载体构建成功。
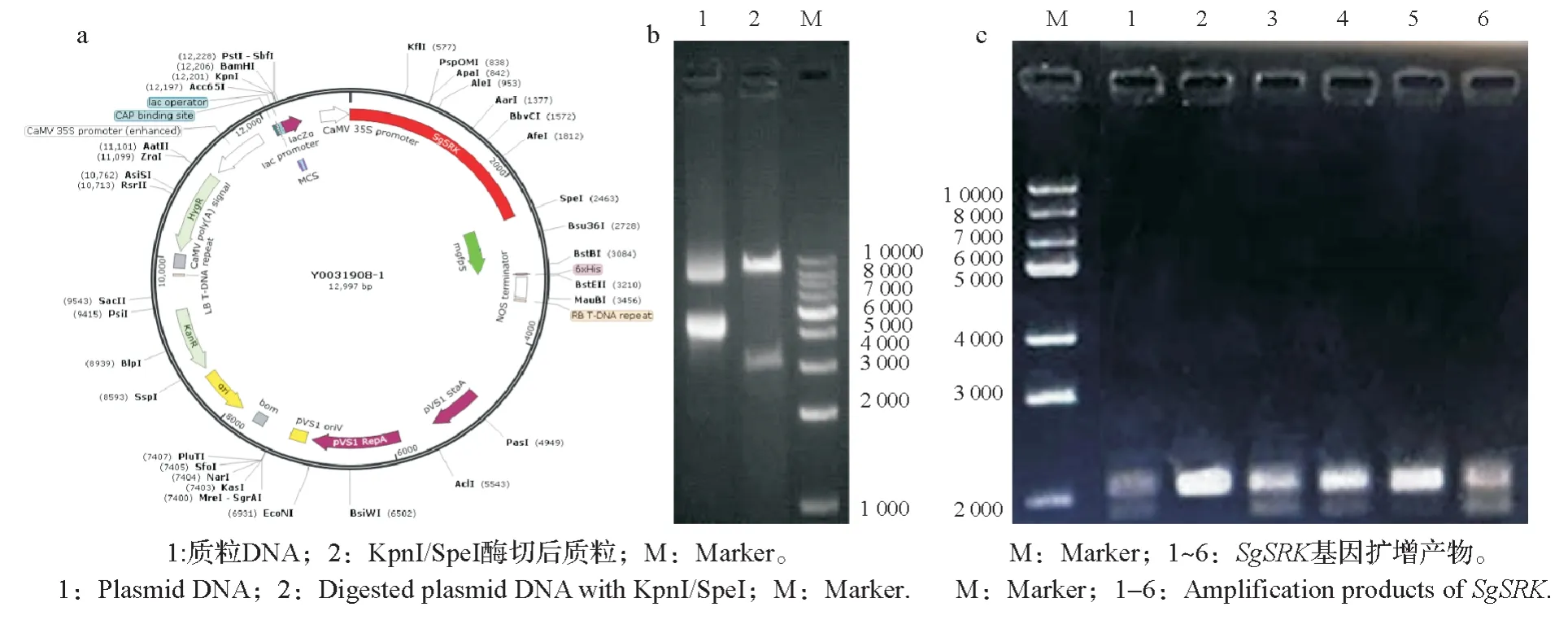
图4 a:含SgSRK的重组表达载体;b:重组表达载体酶切验证;c:重组表达载体PCR验证Fig.4 a:Recombinant expression vector containing SgSRK;b:Validation of recombinant expression vector by restriction enzyme digestion;c:Validation of recombinant expression vector by PCR
2.5 SgSRK基因的瞬时表达和亚细胞定位
为了验证GFP 蛋白和目的基因在烟草中表达情况,使用荧光显微镜观察了含目的基因的农杆菌浸染的烟草叶片。荧光显微镜观察结果如图5所示。对烟草叶片直接注射含目的基因的农杆菌,36 h后叶肉细胞质和细胞膜处呈现较强荧光,表明外源基因可以在烟草中正常表达,SgSRK基因得到成功表达。对基因表达情况进行进一步观察,可以发现绿色荧光在细胞质和细胞膜上均有分布,但细胞膜上信号明显较强,表明SgSRK定位于细胞质中和细胞膜上,但细胞膜上更多,与生信分析结果相符。
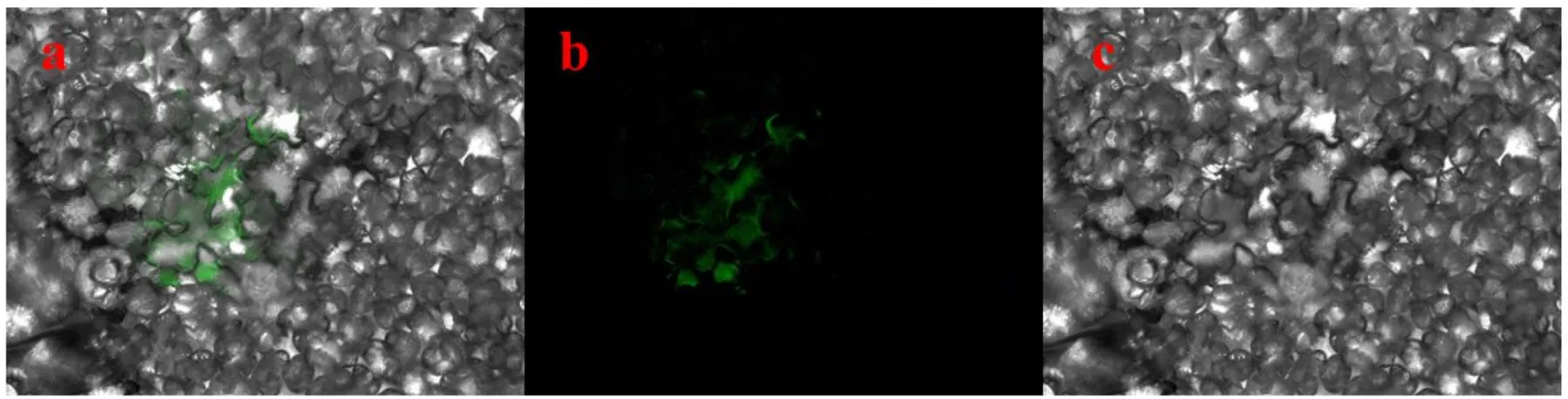
图5 SgSRK的亚细胞定位Fig.5 Subcellular localization of SgSRK
3 讨论与结论
借助转录组生信分析,本研究从华木莲中克隆出了SgSRK基因,其编码820 个氨基酸。编码蛋白具有B_lectin、S_locus_glycop、PAN-2、Pkinase Tyr等4 个结构域构成,存在一个信号肽,有跨膜结构域,为跨膜蛋白,具备磷酸化功能。共聚焦荧光显微镜观察证实该基因蛋白产物定位在细胞质中和细胞膜上,因此SgSRK具有典型SRK特征。
SRK基因在迟发性自交不亲和中的作用是一个值得探讨的问题。从自交不亲和特征来看,孢子体不亲和与迟发性自交不亲和是两类截然不同的类型,孢子体不亲和反应表现为自花花粉不萌发或萌发但不能进入柱头,迟发性自交不亲和则是自花花管粉可以穿过珠孔或完成受精,但仍然表现自交不亲和[5-6],这说明这两类自交不亲和的遗传机制有所不同。到目前为止,许多植物具有孢子体自交不亲和特性,但在分子水平深入研究局限于十字花科中,SRK基因为孢子体自交不亲和的雌性决定基因[6]。SRK定于于柱头乳突细胞表面,为柱头乳突细胞分泌的一种多态性Ser/Thr 受体激酶。当自花花粉与柱头接触时,花粉中的SP11/SCR 与SRK 发生反应,使SRK 构象发生变化,磷酸化下游因子[2,8],启动自交不亲和反应。因此,自花花粉并不能萌发形成花粉管或形成花粉管不能进入花柱[2]。相对于配子体自交不亲和和孢子体不亲和,迟发性自交不亲和研究较为落后,遗传机制尚不清楚。一个有趣的现象是在许多表现迟发性自交不亲和的植物中发现了SRK基因。表现迟发性自交不亲和特征茶树转录组研究中也发现存在SRK基因[10-11],同样,在华木莲中也发现了SRK同源基因SgSRK。这自然就会引发一个问题,这些SRK同源基因在迟发性自交不亲和中会起作用吗?
现在有一点非常明确,这些基因也与SRK在孢子体自交不亲和中的作用不同,因为至少它并未阻止花粉萌发,因此,这些SRK同源基因很可能在迟发性自交不亲和不起作用或作用不同。在孢子体不亲和植物中,一个S位点包含2个相互连锁的雌性决定基因SRK和花粉决定基因SCR,如果连锁被打破,则会发生自交不亲和向自交亲和的转换。目前迟发性自交和植物中尚未发现与孢子体自交不亲和花粉决定因子SCR同源的基因,这也许可以作为SRK同源基因在迟发性自交不亲和反应中不参与或作用不同的一种解释。如果这些基因在迟发性自交不亲和中起作用,它的功能是什么?在何时起作用?如果起作用的话,它们在迟发性自交不亲和中可能不是决定基因,应该还有其它基因参与自交不亲和反应。
即使SRK同源基因不参与迟发性自交不亲和反应,它们的作用也值得探讨,因为这些SRK同源基因是目前在迟发性自交不亲和研究中唯一一类与已知自交不亲和基因高度同源的基因,也可能成为研究迟发性自交不亲和的切入点。不同物种SRK 比较表明,这些基因具有保守的结构域。这些物种涉及被子植物基部类群的无油樟,也有单子叶植物菠萝,也有多种真双子叶植物,这些植物在进化上亲缘关系较远,SRK同源基因的保守性说明它们受到了强烈的自然选择作用。虽然同源基因功能不一定相同,但从另一方面说明这些基因的功能应该比较重要,所以才受到选择作用。
基因过表达是验证基因功能的主要手段之一,克隆目的基因和构建表达载体是必须的前提。通过基因瞬时表达技术观察基因表达产物的亚细胞定位可以给基因的初步作用提供指引。实验结果表明,SgSRK 具有典型SRK 结构域,它具有信号肽,跨膜区,是一个可以接受胞外信号的跨膜蛋白。激光共聚焦显微镜观察结果表明,它定于于细胞质和细胞膜上。实验结果支持SgSRK与SRK相似,但最终华木莲SgSRK基因在自交不亲和中的作用需要进一步通过转基因证实。
SgSRK基因具有SRK基因典型特征。
致谢:江西农业大学理学院王义华教授,江西农业大学农学院边建民教授,南昌大学医学院罗时文教授,南昌大学第一附属医院陈丽敏博士,中国林科院林研所张冰玉研究员对研究给予了帮助,谨致谢意!
