饲料棕榈酸/(EPA+DHA)对大黄鱼抗氧化能力和肌肉品质的影响*
2022-01-14申雅雯孙云霞张文兵麦康森
孟 伟 王 琦 牟 华 巩 雨 申雅雯 孙云霞 张文兵 麦康森
(农业农村部水产动物营养与饲料重点实验室 海水养殖教育部重点实验室中国海洋大学水产学院 山东 青岛 266003)
鱼油因富含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等必需脂肪酸,并具有良好的适口性而被广泛用作海水养殖鱼类饲料的重要脂肪源。随着集约化养殖对鱼油的大规模需求,野生渔业资源的减少及环保意识的增强,用于生产鱼油的原料供给紧张,致使鱼油价格持续上涨。因此,产量大、价格低的植物油越来越受到人们的重视(FAO, 2019)。棕榈油是世界产量最大的食用植物油源,2018年全球棕榈油产量为7 499.8万 t (USDA, 2019)。棕榈油含有饱和脂肪酸(SFA)和不饱和脂肪酸(UFA)的比例接近1∶1,其主要成分为棕榈酸(C16:0)(Edem, 2002)。Bell等(2002)和 Fonseca-Madrigal等(2005)研究表明,棕榈油分别替代0、25%、50%和100% 饲料鱼油,对大西洋鲑(Salmosalar)和虹鳟(Oncorhynchusmykiss)的生长性能无显著影响,并且饲料棕榈油最高含量分别可达24%与20%。
饲料脂肪源的改变会对养殖鱼类肌肉品质产生影响。植物油完全替代饲料鱼油显著降低了大西洋鲑的肌肉质地、持水力和肉色(Regost et al, 2004)。鱼肉口感是消费者评价鱼类品质的常用标准,很大程度上决定其市场接受度。李百安(2015)、张殿福等(2020)从大西洋鲑和罗非鱼(Oreochromismossambicus)等鱼类的研究发现,肌肉的化学物质组成对衡量品质会产生重要影响。其中,肌肉中多不饱和脂肪酸(PUFA)易被氧化出现瘦背肌症,进而造成肌肉品质下降(苏小凤等, 2002)。鱼体过多的活性氧(ROS)造成机体氧化损伤,而氧化损伤的减弱与机体抗氧化能力的提升有关(Chen et al, 2013)。同时,ROS水平升高导致肌肉纤维直径减小,增加肌肉硬度,对肌肉质构有调节作用(Yu et al, 2020)。程民杰(2014)研究表明,饲料中32%~40%的棕榈油替代鱼油可以提高半滑舌鳎(Cynoglossussemilaevis)抗氧化能力并促进其生长,而饲料棕榈油完全替代鱼油则显著降低抗氧化酶的活力,鱼体合成能力降低,蛋白质效率降低。在虹鳟和大西洋鲑研究中发现,饲料中超过50%的鱼油被棕榈油替代会显著降低鱼体 n-3 PUFA 的含量(Fonseca-Madrigal et al, 2005)。
大黄鱼(Larmichthys crocea)是我国最大规模的海水网箱养殖鱼类。随着养殖规模的扩大和养殖密度的增加,养殖大黄鱼的品质备受关注。与野生大黄鱼相比,养殖大黄鱼出现肌肉松散、体色退化等品质问题(孟玉琼等, 2016; Mu et al, 2017)。大黄鱼养殖过程中,以投喂冰鲜杂鱼为主,其来源不详,品质不一,容易造成资源浪费、水环境污染和品质下降等问题(胡兵,2015),这也促进了大黄鱼环境友好型高效配合饲料的研发和应用。本研究以棕榈酸替代饲料中不同水平的EPA+DHA,探究其对大黄鱼肌肉品质和抗氧化能力的影响,为大黄鱼配合饲料配方的优化提供基础数据。
1 材料与方法
1.1 实验饲料
以鱼粉和豆粕为主要蛋白源,DHA富含油、EPA富含油、棕榈酸以及卵磷脂为主要脂肪源,配制棕榈酸/(EPA+DHA)比例分别为 1∶5、1∶1和 5∶1的 3种等氮(约 43%粗蛋白)、等脂(约11%粗脂肪)饲料,并分别命名为 P0、P50和 P100 (表 1)。
1.2 摄食生长实验
实验所用同一批大黄鱼购于福建宁德市富发水产有限公司。在正式实验开始前,先将大黄鱼在4.0 m×4.0 m×4.0 m 的海水浮式网箱中驯养 14 d,以适应实验饲料和养殖环境。暂养结束后,将鱼饥饿24 h后,挑选体格健壮、大小相近的大黄鱼[初始体重为(30.51±0.16) g]随机分配到9个网箱(1.0 m×1.0 m×2.0 m)中,每个网箱 50尾。每种饲料随机投喂3个网箱,每天饱食投喂2次(05:00和17:00)。养殖实验周期为70 d。养殖期间,水温为21℃~28℃,盐度为 28~32,溶解氧(DO)≥6.5 mg/L。
养殖实验结束后,大黄鱼饥饿24 h,并使用丁香酚(1∶10 000)(纯度为99%)对实验鱼进行麻醉。对每个网箱中的鱼称重和计数,分别记录其体重和体长。在每个网箱随机取9尾鱼,收集肌肉样本。为了避免肌肉的异质性,对特定的肌肉部位进行不同品质指标的测定[图1,引自孟玉琼等(2016)]。解剖后于48 h内完成测定肌肉质地、持水力和pH,其他肌肉样品放入-80℃冰箱中冷冻保存。

图1 大黄鱼肌肉品质指标测定部位分布Fig. 1 Sampling segments for measurements of the quality parameters in muscle of large yellow croaker
1.3 样品分析
1.3.1 肌肉脂肪酸的测定 称取约 10 g 大黄鱼肌肉D区(图1)的样品,切碎混匀之后,在冷冻干燥机(ALPHA1-4LD,Christ,德国)中冻干。脂肪酸甲酯化前处理后(孟玉琼等, 2016),采用气相-质谱联用仪进行检测(GCMS-QP2010,岛津,日本)(Muet al, 2018)。对色谱数据进行定性处理,通过NIST08.LIB谱库进行检索,确定脂肪酸组成(匹配度高于80%)。
1.3.2 肌肉质地、pH和持水力的测定 在肌肉 A区(图1)选取3个点,采用质构仪(TMS-PRO,FTC,美国)中的TPA模式进行肌肉质地的测定,包括硬度、弹性、内聚性、粘附性和咀嚼性。相关参数:直径为8 mm的圆柱形探头;量程为25 N的力量感应元;检测速度为 30 mm/min;形变量为 30%;起始力为 0.1 N。
采用Gómez-Guillén等(2000)的方法测定大黄鱼肌肉B区(图1)的持水力。使用便携式pH计(Testo 205,德国)对大黄鱼肌肉特定部位的3个点进行pH测定。
1.3.3 抗氧化相关基因的表达量分析 使用Trizol试剂(Invitrogen, Carlsbad, CA, 美国)提取肌肉组织RNA。采用 NanoDrop 2000分光光度计(Thermo fisher scientific, 美国)和1.2%琼脂糖凝胶电泳检测RNA浓度和质量。按照说明书步骤操作,采用PrimeScriPtTMRT试剂盒(TaKaRa)将提取的RNA反转录成cDNA。
引物设计与合成:在NCBI上搜索已报道的大黄鱼中相关目的基因的蛋白编码的序列;对所找到的序列进行多重序列比对并确定合适的保守区;基于研究,选用β-actin为内参基因,应用Primer 5.0软件设计、分析引物,并对引物进行修饰(降低简并度),然后由生工生物工程(上海)股份有限公司负责合成并测试引物序列(表2)。

表2 抗氧化相关基因引物序列Tab. 2 Primer sequences of anti-oxidation related genes
PCR扩增反应:RT-PCR扩增反应体系试剂2 × EsTaqMasterMix 为 7.5 μL,上游引物(F, 10 μmol/L) 为0.3 μL,下游引物(R, 10 μmol/L)为 0.3 μL,dH2O 为5.9 μL,模板cDNA为1.0 μL。PCR反应均在Eppendorf Mastercycler gradient PCR 仪(德国)中进行。
数据处理:Nrf2、SOD和CAT表达量采用2-ΔΔCt法计算(Livaket al, 2001)。
1.3.4 抗氧化酶活性、总抗氧化力和丙二醛含量的测定 制备肌肉组织匀浆液后(Muet al, 2018),采用南京建成生物工程研究所提供的试剂盒分别测定总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性、总抗氧化能力(T-AOC)和丙二醛(MDA)含量,采用比色法测定上述参数,使用紫外分光光度计(UV2401PC,岛津,日本)测定吸光度。
1.4 统计分析
使用SPSS 17.0软件对所得数据进行统计分析。所有数据均进行单因素方差分析(one-way ANOVA)后,若组间存在显著差异则采用Duncan’s检验进行多重比较,P<0.05为差异显著。
2 实验结果
2.1 生长性能
从图2可以看出,P0、P50和P100组之间在大黄鱼终末体重(Final body weight)无显著差异(P>0.05)。

图2 不同饲料棕榈酸/(EPA+DHA)比例对大黄鱼终末体重的影响Fig. 2 Effects of different ratios of dietary palmitic acid to EPA+DHA on the final body weight of large yellow croaker
2.2 肌肉脂肪酸组成
从表3可以看出,随着饲料中棕榈酸含量的增加,大黄鱼肌肉SFA水平显著提高(P<0.05)。P100组大黄鱼肌肉的C16∶0含量显著高于P0组,P100与P50组、P0与P50组之间无显著差异(P>0.05)。与P50组相比,P0和P100组大黄鱼肌肉的C12:0水平显著提高(P<0.05),P0和P100组相比差异不显著(P>0.05)。与P0组相比,P50和P100组大黄鱼肌肉的C14:0和C18:0水平显著提高(P<0.05),P50和P100组相比差异不显著(P>0.05)。大黄鱼肌肉的 C20:0含量在各处理组间相比无显著差异(P>0.05)。

表3 不同饲料棕榈酸/(EPA+DHA)比例对大黄鱼肌肉脂肪酸组成的影响(mg/g湿重,平均值±标准误,n=9)1Tab. 3 Effects of different ratios of dietary palmitic acid to EPA+DHA on fatty acid compositions in muscle of large yellow croaker (mg/g, wet basis, Mean±SE, n=9)1
随着饲料棕榈酸含量的增加,大黄鱼肌肉的单不饱和脂肪酸(MUFA)水平显著提高(P<0.05)。P100组大黄鱼肌肉的C16:1含量显著高于P0组,P100与P50组、P0与 P50组相比无显著差异(P>0.05)。P100组的大黄鱼肌肉C18:1n-9水平显著提高,P0组含量最低(P<0.05)。与P50组相比,P0和P100组大黄鱼肌肉的C20:1水平显著提高(P<0.05),P0组和P100组相比差异不显著(P>0.05)。大黄鱼肌肉的C18:1n-7含量在各处理组间相比无显著差异(P>0.05)。
随着饲料棕榈酸含量的增加,大黄鱼肌肉的n-3 PUFA水平显著降低(P<0.05),而肌肉的n-6 PUFA水平各处理组相比无显著差异(P>0.05)。P100组的大黄鱼肌肉的棕榈酸/(EPA+ DHA)水平显著提高,其次是P50组,P0组含量最低(P<0.05)。P0组大黄鱼肌肉的C20:5n-3、C22:6n-3和EPA+DHA水平显著提高,其次是P50组,P100组含量最低(P<0.05)。与P50组相比,P0和P100组大黄鱼肌肉的C18:3n-3水平显著提高(P<0.05),P0和P100组相比差异不显著(P>0.05)。P50组大黄鱼肌肉的C20:4n-6含量显著高于P100组,P50与P0组、P100与P0组相比无显著差异(P>0.05)。大黄鱼肌肉的 C18:2n-6、DHA/EPA含量在各处理组间相比无显著差异(P>0.05)。
2.3 肌肉质地、pH和持水力
从表4可以看出,P0和P50组大黄鱼肌肉硬度、粘附性、内聚性、咀嚼性显著高于 P100组(P<0.05),而 P0和P50组相比无显著差异(P>0.05)。P0、P50和P100组在大黄鱼肌肉pH和持水力相比无显著差异(P>0.05)。

表4 不同饲料棕榈酸/(EPA+DHA)比例对大黄鱼肌肉质构特性的影响(平均值±标准误, n=9)Tab. 4 Effects of different ratios of dietary palmitic acid to EPA+DHA on the flesh texture of large yellow croaker (Mean±SE, n=9)
2.4 肌肉抗氧化能力
大黄鱼肌肉抗氧化相关基因表达水平的影响见图3。从图3可以看出,P0组大黄鱼肌肉的SOD2基因表达水平显著低于P50和P100组(P<0.05),P50和P100组相比无显著差异。随着饲料棕榈酸替代水平的增加,大黄鱼肌肉的CAT基因表达水平显著提高(P<0.05)。P0组大黄鱼肌肉的 Nrf2基因表达水平显著高于P50组(P<0.05),P0和P100组、P50和P100组之间相比无显著差异(P>0.05)。大黄鱼肌肉SOD1基因表达水平在各处理组间相比无显著差异(P>0.05)。

图3 不同饲料棕榈酸/(EPA+DHA)比例对大黄鱼肌肉抗氧化相关基因表达水平的影响(平均值±标准误, n=3)Fig. 3 Effects of different ratios of dietary palmitic acid to EPA+DHA on the expression level of anti-oxidation-related gene in muscle of large yellow croaker (Mean±SE, n=3)
大黄鱼肌肉抗氧化酶活性及T-AOC和MDA含量结果见图4。从图4可以看出,P50组大黄鱼肌肉T-AOC含量显著降低(P<0.05),P0和P100组含量相比无显著差异(P>0.05)。大黄鱼肌肉SOD和CAT的活性及MDA含量在3个处理组相比均无显著差异(P>0.05)。
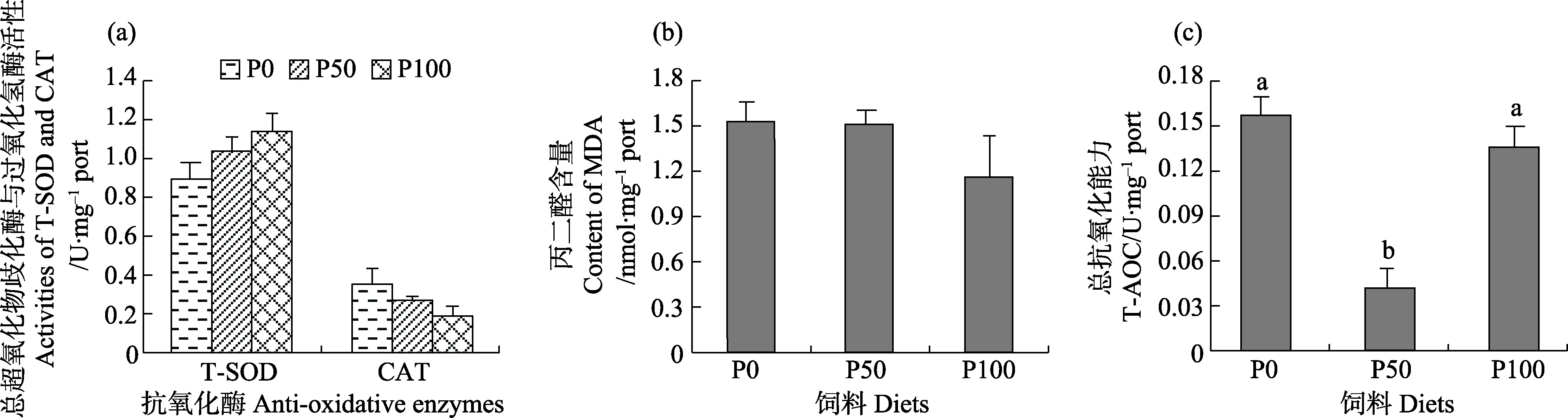
图4 不同饲料棕榈酸/(EPA+DHA)比例对大黄鱼肌肉抗氧化酶活(a)及MDA(b)和T-AOC(c)含量的影响(平均值±标准误, n=3)Fig. 4 Effects of different ratios of dietary palmitic acid to EPA+DHA on the activities of anti-oxidative enzymes (a),MDA content (b) and T-AOC (c) in muscle of large yellow croaker (Mean±SE, n=3)
3 讨论
3.1 饲料棕榈酸/(EPA+DHA)对大黄鱼肌肉脂肪酸组成的影响
一方面,相比于P0组,P100组大黄鱼肌肉SFA含量显著增加,MUFA和n-3 PUFA含量显著降低。这与鱼类肌肉脂肪酸组成与饲料脂肪酸存在高度相关性有关(Bahurmiz et al, 2007);另一方面,P100组的EPA+DHA含量显著降低,而C18脂肪酸(C18:0和C18:ln-9)含量增加。这和斜带石斑鱼(Epinephelus coioides) (何凌云, 2019)及大西洋鲑(Bell et al, 2002)的研究结果相一致,也表明海水鱼类利用脂肪酸的去饱和反应及碳链延长反应合成PUFA的能力有限(Cai et al, 1989)。同时,大黄鱼生长性能无显著差异可能与饲料鱼粉提供的必需脂肪酸可以满足大黄鱼的基础生长需要有关。
随着饲料中棕榈酸/(EPA+DHA)比例的增加,大黄鱼肌肉脂肪酸组成发生改变,可能是肌肉脂肪酸组成反映饲料脂肪酸组成并呈现正相关(Olsen et al,2000);大黄鱼利用脂肪酸去饱和反应和碳链延长反应合成PUFA的能力不足(李桑等, 2015)。饲料中均衡的n-3/n-6 PUFA比例对于海水鱼类非常重要(郑建明等, 2019),在减少饲料氧化基础上需要提供足够的EPA+DHA 来满足鱼类必需脂肪酸的需求(柳学周等,2017)。
3.2 饲料棕榈酸/(EPA+DHA)对大黄鱼肌肉品质的影响
本研究中,P0和P50组大黄鱼的肌肉硬度、内聚性、粘附性和咀嚼性显著高于P100组。饲料中不添加或添加少量棕榈酸保证鱼肉较高的n-3 PUFA含量,而n-6 PUFA含量在各处理组相比无显著差异。肌肉中较高含量的PUFA显著增加香味并提升肌肉的多汁性,改善鱼的肌肉品质(Menoyo et al, 2004; 邴旭文等, 2005)。Duan 等(2014)研究表明,饲料中鱼粉含量为70%时,棕榈油完全替代鱼油并提升大黄鱼肌肉的持水力和整体风味,进而改善鱼肉品质。而本研究中,饲料棕榈酸的添加对大黄鱼鱼肉持水力无显著变化,可能与大黄鱼规格及鱼体自身的调控有关。
本研究中,饲料棕榈酸完全替代EPA和DHA,降低了大黄鱼肌肉质构,对肌肉持水力和pH则无显著影响。持水力是衡量肌肉品质的重要指标(张玉伟等, 2012),肌肉质构与肌肉持水力有关(Periago et al,2005)。本研究中,3个处理组肌肉持水力相比虽无显著差异,但饲料中添加棕榈酸降低了大黄鱼肌肉的持水力。毛轲(2014)研究表明,棕榈酸会促使肌细胞凋亡,破坏成肌细胞肌管形态。因此,饲料棕榈酸替代EPA和DHA通过降低持水力影响肌肉质构,加上棕榈酸可能对大黄鱼肌细胞产生负面作用来共同导致肌肉品质的下降。
3.3 饲料棕榈酸/(EPA+DHA)对大黄鱼肌肉抗氧化能力的影响
饲料中棕榈酸/(EPA+DHA)比例不同造成饲料脂肪酸组成和含量的变化,其对鱼的抗氧化能力产生一定影响(Mu et al, 2018)。本研究中,P0组大黄鱼肌肉的SOD1与CAT表达水平显著低于P50和P100组。这与饲料中植物油替代鱼油降低鱼体的抗氧化基因表达水平不一致(Yu et al, 2016)。P50和 P100组大黄鱼肌肉抗氧化基因表达水平较高,可能与棕榈酸在鱼体代谢中刺激细胞产生活性ROS诱导Nrf2的表达,促进抗氧化酶基因转录有关(Joshi-Barve et al, 2007)。同时,饲料中适宜的棕榈酸可以提高饲料的抗氧化性能,从而被鱼类有效地吸收利用(韩雨哲等, 2010)。Nrf2受到机体中ROS氧化应激因子刺激后,启动下游相应抗氧化相关基因(SOD、CAT等)的转录,影响机体抗氧化能力(Xu et al, 2015; 胡流芳等,2016)。而P50组大黄鱼肌肉的Nrf2基因表达量显著低于P0组,P100组与 P0、P50组相比无显著差异,这可能与组内数据差异较大有关,需进一步探究。
Nrf2相关信号转导对抗氧化酶活性有关键调控作用(Gan et al, 2014)。本研究各处理组之间,大黄鱼肌肉Nrf2表达水平与T-AOC的变化趋势相一致。本研究中,P0组饲料EPA+DHA提升肌肉总抗氧化力,饲料中适宜 EPA+DHA可以促进机体产生氧自由基进而增加酶活性保护机体(吉红等, 2011);而 P50组大黄鱼肌肉 T-AOC显著降低,说明机体抗氧化能力有所下降。本研究中,P50组大黄鱼肌肉MDA含量低于P0和 P100组,可能是因为鱼肉 n-3/n-6 PUFA比例不平衡使鱼肉脂质沉淀,从而导致MDA含量增加(Yu et al, 2016)。
3.4 饲料棕榈酸/(EPA+DHA)投喂下,大黄鱼肌肉品质与抗氧化能力的关系
Wu等(2015)研究表明,ROS引起机体脂质和蛋白质的氧化损伤是造成鱼肉品质下降的主要原因,而鱼类通过提高抗氧化酶活性和非酶抗氧化物质含量来抵御 ROS,防止氧化损伤(Tang et al, 2013)。棕榈酸可以引起细胞脂毒性促进 ROS产生,机体抗氧化酶活性和非酶抗氧化物质含量受到影响,从而降低鱼的肌肉品质(Gan et al, 2014; 郝丽红等, 2016)。因此,抗氧化酶活性和非酶抗氧化物质含量,即鱼的抗氧化能力对鱼肉质量比较重要。
本研究中,饲料棕榈酸完全替代EPA+DHA,导致大黄鱼肌肉硬度、内聚性、粘附性和咀嚼性显著下降,对弹性、pH和持水力无显著影响。而从肌肉的T-AOC和MDA含量以及SOD和CAT活性等反应抗氧化和氧化状态的指标来看,纯EPA+DHA组(P0)与纯棕榈酸组(P100)相比无显著差异。由此可见,本研究中,大黄鱼肌肉的质构特性与体内氧化-抗氧化状态的相关性并不强,就其原因与本研究的棕榈酸或者EPA+DHA的梯度设计数量不够多,有些趋势性现象未表现出有关。因此,关于饲料棕榈酸/(EPA+DHA)比例所引起的大黄鱼肌肉质构特性的变化与抗氧化之间的关系,还需要做进一步的研究。
4 结论
大黄鱼肌肉脂肪酸组成的变化反映了饲料棕榈酸/(EPA+DHA)比例的变化。较高含量的饲料棕榈酸显著降低了大黄鱼肌肉的硬度、内聚性、粘附性和咀嚼性。饲料棕榈酸/(EPA+DHA)比例显著影响大黄鱼肌肉的总抗氧化力。但大黄鱼肌肉质构特性的变化与肌肉抗氧化能力的变化未表现出较高相关性,这二者之间的关系还需要进一步研究。
