食源性沙门氏菌在人体胃肠道中耐受及致病机制研究进展
2022-01-13董晓璐秦晓杰刘阳泰孙天妹刘弘王翔李卓思董庆利
董晓璐,秦晓杰,刘阳泰,孙天妹,刘弘,王翔,李卓思,董庆利*
1(上海理工大学 健康科学与工程学院,上海,200093)2(上海市疾病预防控制中心,上海,200336)
沙门氏菌是一种革兰氏阴性肠道菌,在自然界中分布广泛、种类繁多,目前已检测出2 600多种血清型,其中部分血清型可导致人患病[1]。沙门氏菌主要通过受污染的食物、水和粪便进行传播,其引发沙门氏菌病(salmonellosis)的特征性临床症状主要有急性胃肠炎、败血症、伤寒和副伤寒等[2]。据我国食源性疾病监测系统显示,2003—2017年全国共报告899起与沙门氏菌有关的食品安全事件,最终导致21 881人患病,11 351 人住院,4人死亡[3]。因此,沙门氏菌是一种重要的食源性致病菌,会对人体健康构成严重威胁。
食源性沙门氏菌一般由受污染食物进入人体,通过侵染小肠上皮细胞,再利用自身携带的多种毒力因子作用导致人罹患沙门氏菌病[4]。沙门氏菌在胃肠道内会面临一系列对其生长和生存不利的逆境条件,如胃酸、高渗透压、高浓度胆盐、金属离子、营养限制和肠道菌群的竞争作用[4-5]。然而,沙门氏菌能够通过调节自身基因的表达来应对这些逆境,进一步黏附、定殖和入侵宿主细胞,最终导致人患病[6]。明确沙门氏菌对人体内压力因子的耐受性及其致病机制对于有效控制沙门氏菌感染有重要参考价值。
近年来,关于食源性沙门氏菌在逆境条件下的生长、失活和毒力表达研究已广泛开展,但主要集中关注食品加工、贮藏、流通等体外环节。本文则着眼于食源性沙门氏菌的体内存活及侵袭过程,对其在人体胃肠道环境中的应激耐受机制和致病机制进行概述,以期为食源性沙门氏菌的体内研究提供参考。
1 人体胃肠道中沙门氏菌的应激耐受机制
沙门氏菌在人体胃肠道内会经受多种应激条件(图1)[6-7]。其中,胃酸、胆盐和高渗透压是最主要的胁迫因子[4, 6]。沙门氏菌通常能够抵御和适应这些逆境,进而在人体胃肠道内存活。以下将对沙门氏菌在这3种应激条件下的耐受机制进行概述。

图1 沙门氏菌在人体胃肠道内受到的应激条件Fig.1 Stress conditions encountered by Salmonella in the human gastrointestinal tract
1.1 胃酸应激下沙门氏菌的耐受机制
沙门氏菌通过食物被人体摄入后首先要承受pH值为1~5的胃酸应激[7]。人体每天产生约1~2 L胃液,盐酸含量为5 475~5 840 mg/L[8]。研究表明胃酸过少会导致沙门氏菌感染风险增加,例如,对于急性沙门氏菌病患者,接受过胃切除术患者的发病率和死亡率较高[8]。GAWANDE等[9]研究发现将沙门氏菌接种于农产品表面进行酸处理可提高沙门氏菌在酸中的存活时间,该结果说明人食用食物后胃环境pH值的暂时升高可能有助于沙门氏菌在胃中生存。此外,有研究指出,一些富含脂肪或高蛋白的固体食物来源可以保护沙门氏菌免受胃酸的影响[10]。这些因素都会增加沙门氏菌在人体胃环境内存活的可能性。
除了上述胃酸不足和食物基质的保护外,沙门氏菌已进化出多种应答机制来增强自身在酸环境下的生存能力。其中,沙门氏菌主要抗酸机制是酸耐受应答(acid tolerance response,ATR)反应,也就是沙门氏菌经弱酸适应后,在致死酸性条件下存活能力增强的反应[2]。如图2所示,沙门氏菌的酸耐受应答机制主要包括3个方面,分别是酸休克蛋白(acid shock proteins,ASPs)、pH稳态系统和细胞膜脂肪酸组成[11]。
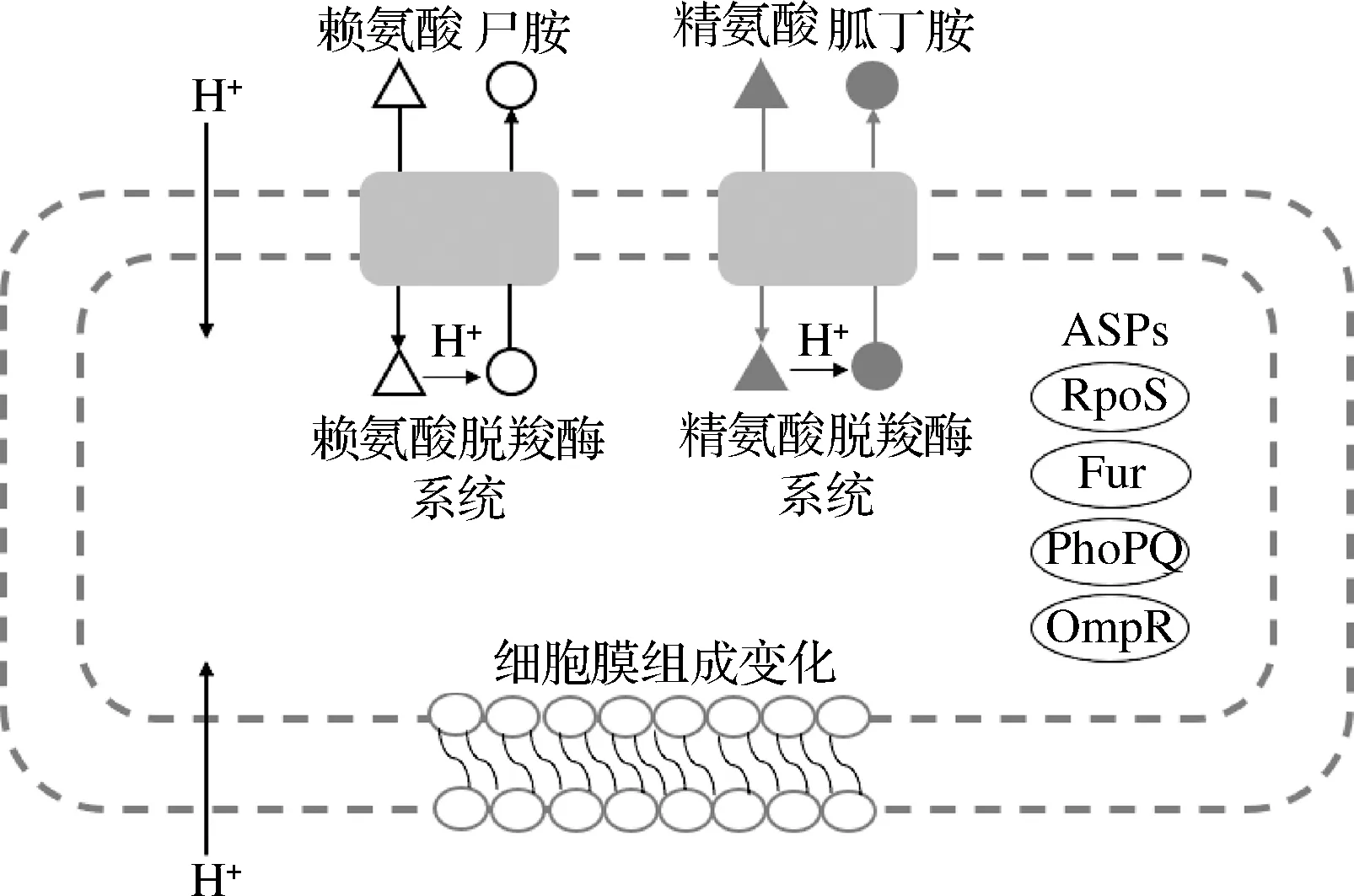
图2 沙门氏菌主要的耐酸机制Fig.2 The main acid tolerance mechanism of Salmonella
ASPs可预防或修复沙门氏菌由酸应激引起的大分子损伤,目前已发现的ASPs包括RpoS、铁调节系统Fur、双组分系统PhoP/PhoQ和OmpR反应调节子[12]。ASPs的表达有助于沙门氏菌在低pH值的酸性条件下生存[13],有研究通过蛋白质组学分析表明鼠伤寒沙门氏菌酸适应诱导了其60个ASPs的表达,该菌经低酸适应后与未经酸适应相比在随后的酸应激中存活能力显著增强[14]。沙门氏菌胞内pH稳态主要通过赖氨酸脱羧酶系统和精氨酸脱羧酶系统维持,其中赖氨酸脱羧酶系统由转录调节因子、赖氨酸脱羧酶和赖氨酸-尸胺反向转运蛋白组成,赖氨酸脱羧酶消耗细胞内H+将赖氨酸转化为尸胺,再由赖氨酸-尸胺反向转运蛋白排出尸胺以换取胞外的赖氨酸;精氨酸脱羧酶系统通过消耗H+,将精氨酸转化为胍丁胺排出细胞以换取外部精氨酸,使整个过程得以持续进行[15]。除此之外,细胞膜组成中不饱和脂肪酸与饱和脂肪酸比率的降低以及环丙烷脂肪酸含量的增加也会导致沙门氏菌存活能力和耐酸性增强[11]。尽管沙门氏菌酸耐受机制的相关研究已很全面,但是仍有部分具体机制如RpoS在酸胁迫过程中的表达程度以及OmpR调节哪些基因参与耐酸反应等需要进一步阐明。
1.2 胆汁应激下沙门氏菌的耐受机制
食物中的沙门氏菌在经过胃酸的抑杀作用后,会受到另一逆境条件——胆汁的应激。胆汁由胆固醇在肝脏中合成并在胆囊中贮存和浓缩,在人体摄入食物后释放到十二指肠,可参与膳食脂肪和脂溶性维生素的消化和吸收[16]。胆汁由多种化合物组成,以钠(145 mmol/L)、氯(90 mmol/L)和各种胆盐(40 mmol/L)为主要成分[17]。胆盐可作用于沙门氏菌细胞膜并破坏其完整性和通透性、诱导RNA二级结构的形成、DNA损伤、改变蛋白质构象致其错误折叠或变形以及通过产生氧自由基引起氧化应激等[18]。因此胆汁也是抑制沙门氏菌存活的重要因素之一。
现有研究证实,沙门氏菌通过脂多糖转运、双组分系统和外排泵来抵抗胆汁应激[5, 9]。沙门氏菌细胞膜中含有脂多糖,脂多糖中O抗原的缺失会导致沙门氏菌对胆汁的耐受性降低[19]。HERNANDEZ等[20]通过对沙门氏菌耐胆汁突变株进行全基因组测序发现这些菌株中脂多糖转运基因的突变率很高,证实了脂多糖结构在沙门氏菌胆汁耐受机制中的作用。PhoP/PhoQ是一种重要的双组分系统,VELKINBURGH等[21]的研究表明,在较低的胆汁浓度下,缺乏PhoP/PhoQ系统的沙门氏菌突变株与野生沙门氏菌相比更容易受到胆汁的抑杀作用,而具有PhoP/PhoQ系统活性的菌株在60%的胆汁浓度下也能够存活较长时间。PROUTY等[22]对鼠伤寒沙门氏菌中AcrAB外排泵进行分析,发现胆汁存在时AcrAB的转录活性是无胆汁时的8倍。除了以上所述几种调节机制外,沙门氏菌还可能在胆结石表面形成生物膜或入侵胆囊上皮细胞来避开高浓度胆汁[23]。由此可知,沙门氏菌作为肠道细菌已经进化出较为完善的胆汁耐受机制,可确保其在肠道中的存活和定殖。
1.3 肠渗透压应激下沙门氏菌的耐受机制
沙门氏菌在肠道内面临的主要逆境条件除了胆汁外还有小肠内的高渗透压。小肠对各种营养的吸收受多种因素的制约,而肠道内容物的渗透压是制约肠吸收的重要因素之一。在一定浓度范围内,肠内容物浓度越大,肠吸收越慢;浓度过高时,肠壁会出现反渗透现象,使内容物的渗透压降至一定程度后再被吸收[24]。一般情况下,沙门氏菌需要维持高于生长介质的胞内渗透压,才能产生细胞膨压,而细胞膨压可以促进沙门氏菌生长和分裂[25]。肠道中的高渗环境会引起沙门氏菌细胞内水分流失,导致细胞内代谢不平衡,从而影响沙门氏菌营养吸收、DNA复制、细胞分裂等各种生理过程[26]。因此,沙门氏菌适应肠道高渗透压应激的能力对于其生存和生长至关重要,需要通过自身的渗透压耐受机制来适应肠渗透压的变化。
沙门氏菌主要通过K+转运系统和渗透保护剂系统的调控适应肠道中的高渗透压应激[11]。Trk和Kdp两个转运系统可对细胞内K+浓度的升高进行调节,其中Trk系统由TrkA、TrkE和TrkG三类蛋白质组成,Kdp系统由KdpA、KdpB和KdpC三类蛋白质组成[7]。如图3所示,沙门氏菌的操纵子otsAB会促进海藻糖合成,并且使甜菜碱、脯氨酸和胆碱等渗透保护剂通过特定的转运体(丙氨酸、ProP、ProU和OsmU等)进入细胞,使细胞内外溶质发生被动扩散[27]。除此之外,ompC编码OmpR/EnvZ双组分系统的孔蛋白OmpC,能为可溶性物质进出细胞提供通道[11]。高渗透压应激可能导致沙门氏菌孔蛋白OmpF的表达水平降低、OmpC的表达水平增加,而孔蛋白OmpC尺寸较小,只允许小分子通过,故可作为通道促进亲水性小分子的扩散[26]。以上所述调控系统在沙门氏菌耐受肠道高渗透压的过程中均发挥了重要作用。

图3 沙门氏菌对高渗透压的应激反应Fig.3 The stress responses of Salmonella to high osmotic pressure
综上可知,虽然人体胃肠道内存在很多不利于沙门氏菌存活及生长的逆境条件,但是沙门氏菌已经进化出多种耐受机制来适应这些逆境,从而为后续在肠道中的定殖创造机会。然而,人体胃肠道是一个复杂的抑菌体系,沙门氏菌并非面临单一应激条件,而是会受到各类应激条件连续作用的影响,因此还需对沙门氏菌在体内应激条件连续或协同作用下的存活及耐受行为进行深入研究。
2 人体胃肠道中沙门氏菌的致病机制
沙门氏菌侵袭宿主细胞的过程如图4所示。沙门氏菌在穿过肠黏膜层之前首先要黏附肠上皮细胞,肠黏膜表面派尔集合淋巴结(Peyer′s patches,PPs)上的滤泡上皮细胞是沙门氏菌入侵的最佳起始部位。滤泡上皮中稀疏分布着捕获抗原的微皱褶细胞(microfold cell,M细胞),当沙门氏菌黏附到M细胞后,利用Ⅲ型分泌系统(type three secretion system,T3SS)将效应蛋白分泌到胞外并迁移到宿主细胞,从而引起宿主细胞肌动蛋白骨架的重排,诱导膜褶皱的形成。该膜皱褶可以将黏附的沙门氏菌吞噬到一个大囊泡里,即 SCVs(salmonella containing vacuoles)。SCVs是沙门氏菌可以在宿主细胞内生存和繁殖的唯一场所。此时,肠上皮层启动促分泌应答,促使吞噬细胞从黏膜下层移至肠腔,沙门氏菌随吞噬细胞迁移从肠系膜淋巴结进入并扩散至其他部位,入侵肝脏、脾脏等不同器官或组织,从而引起人体各种临床症状[13, 28]。
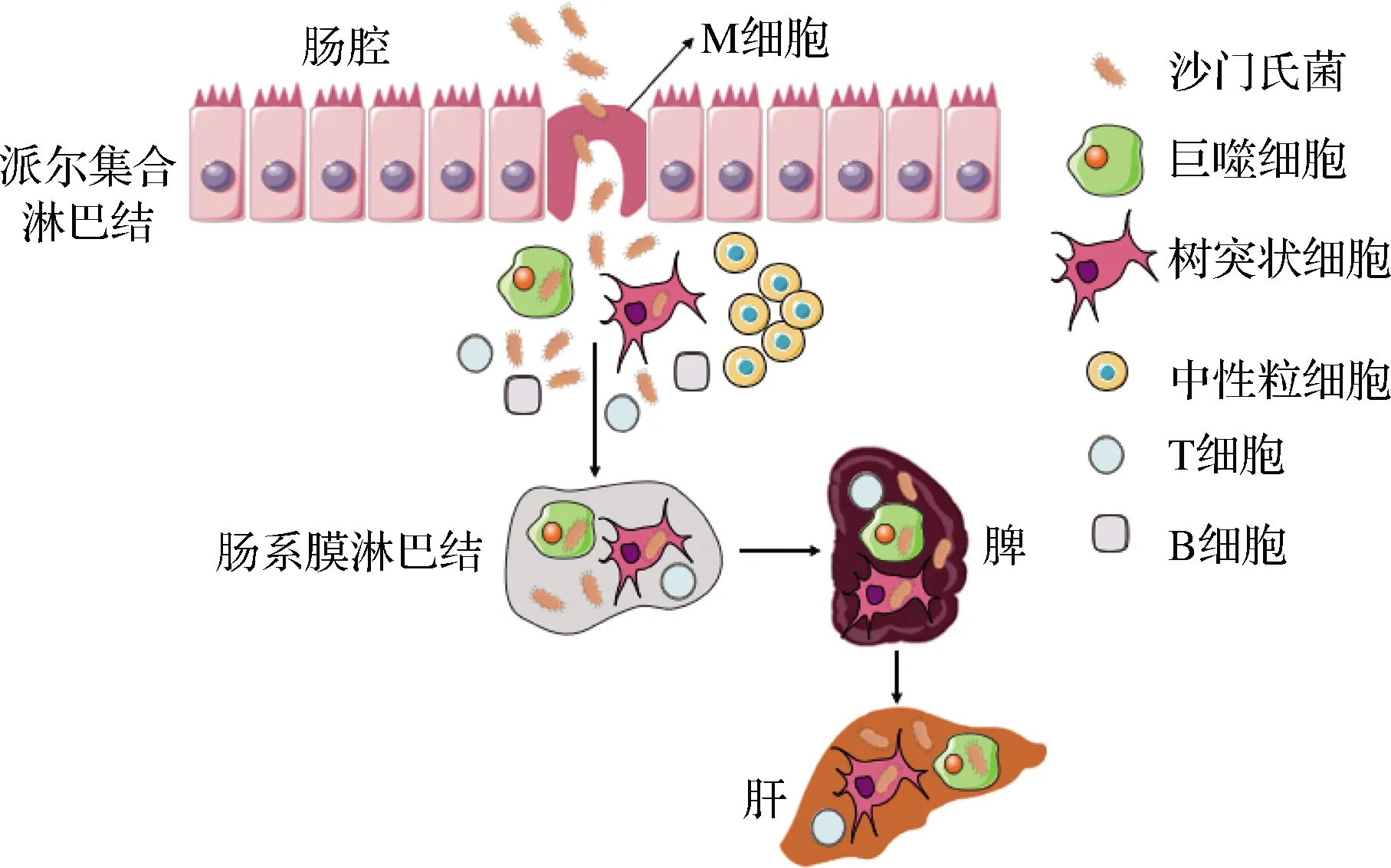
图4 沙门氏菌致病的基本步骤Fig.4 Basic steps in Salmonella pathogenesis
沙门氏菌在黏附和入侵肠上皮细胞直至最终扩散到其他器官的过程中,有很多毒力因子在发挥作用,如毒力岛、毒力质粒、菌毛和脂多糖等[4]。以下将对这几种毒力因子进行概述。
2.1 毒力岛
沙门氏菌的毒力岛(Salmonellapathogenicity island,SPIs)是其进化过程中通过水平基因转移(horizontal gene transfer,HGT)获得的,位于细菌的染色体或质粒上,在沙门氏菌感染、黏附、入侵、传播以及细胞内生存中起着重要作用[29]。其中SPI-1和SPI-2是沙门氏菌较为重要的毒力决定因子。
SPI-1几乎存在于沙门氏菌所有血清型中,在沙门氏菌侵袭非吞噬细胞过程中起关键作用,并参与宿主细胞诱变和诱导巨噬细胞凋亡的过程[30]。SPI-1编码与沙门氏菌侵袭力相关的Ⅲ型分泌系统,该系统能够对若干个环境和生理信号做出应答反应,同时这些应答反应又控制着 SPI-1 编码区内外效应蛋白的分泌[31]。VALDEZ等[32]研究结果显示SPI-1不仅促进了沙门氏菌对上皮细胞的入侵,还促进了沙门氏菌在吞噬细胞内的生存和复制。该发现表明,SPI-1在沙门氏菌侵袭肠上皮非吞噬细胞和侵袭后于上皮细胞内快速增殖两个环节都起了关键作用。
SPI-2是由沙门氏菌致病性相关毒力基因组成的一个基因簇,是沙门氏菌在胞内存活和发挥毒力的重要毒力岛[33]。SPI-2与沙门氏菌在宿主吞噬细胞内的生存和传播相关,并使沙门氏菌逃避巨噬细胞的杀伤作用[34]。双组分系统BarA/SirA可与SPI-2相关基因的启动子结合,调控沙门氏菌的运动性和生物膜形成[35]。有研究显示,SPI-2基因突变会导致SPI-1中sipC、prgK和hilA基因(编码SPI-1基因的转录激活因子)的表达降低,说明SPI-2和SPI-1之间存在着交互作用[36]。
除了SPI-1和SPI-2,沙门氏菌中常见的毒力岛还有以下几种:SPI-3可编码巨噬细胞生存蛋白MgtC和转运蛋白MgtB;SPI-4可诱导沙门氏菌对肠上皮细胞的黏附作用;SPI-5可编码SopB(由SPI-1的T3SS分泌)、PipB(由SPI-2的T3SS迁移到SCV);并可诱导牛促炎免疫反应[37]。综上,SPI-1主要在沙门氏菌入侵肠上皮细胞过程中起主要作用,而SPI-2、3、4则主要负责沙门氏菌在宿主细胞内的生存和增殖。
2.2 毒力质粒
沙门氏菌黏附及入侵肠上皮细胞还与其携带的毒力质粒有关。大多数沙门氏菌都具有血清型特异性毒力质粒,大小约50~90 kb,与沙门氏菌的致病能力密切相关[38]。毒力质粒包括5个开放阅读框(open reading frame,ORF),即spv(Salmonellaplasmid virulence)操纵子[39],spv操纵子由5个基因组成,其中spvR是第一个被转录的基因,它编码的效应蛋白SpvR可调节其他4个基因(spvA、spvB、spvC和spvD)的表达[40]。SpvB是一种细胞毒蛋白,具有避免肌动蛋白聚合的功能[41];SpvC是一种抗炎效应因子,可抑制免疫信号传导,在宿主的促炎反应中发挥着重要作用[39]。ROLHION等[42]证明了SpvD在抑制免疫应答中的重要性。但是,SpvA的调控机制及其在毒力中的作用尚未完全阐明,故需要对spv操纵子进行更全面的研究。
2.3 菌毛
沙门氏菌表面的菌毛在细菌生物膜形成、肠道定殖和入侵中起重要作用[29]。FBREGA等[39]通过对鼠伤寒沙门氏菌基因组进行测序,发现了13个操纵子(agf、fim、lpf、pef、bcf、stb、stc、std、stf、sth、sti、saf和stj)与菌毛合成基因具有同源性。BUMLER等[43]通过遗传方法研究了3种菌毛操纵子(fim、lpf和pef)在鼠伤寒沙门氏菌黏附于不同上皮细胞系(HEp-2和HeLa)中的作用,这些操纵子分别编码I型菌毛,长极性菌毛和质粒编码性菌毛,结果显示只有鼠伤寒沙门氏菌lpf突变体对HEp-2细胞的黏附性显著降低,而末端基因缺失显著降低了鼠伤寒沙门氏菌对HeLa的黏附性。上述研究表明,菌毛合成相关基因的组成决定了细菌肠道感染过程中黏附的上皮细胞类型。
2.4 脂多糖
脂多糖(lipopolysaccharides,LPS)也是沙门氏菌的一种毒力因子,它由类脂A、核心寡糖(C-OS)和O-抗原多糖(O-PS)组成,其中,类脂A和C-OS可激活T淋巴细胞,而O抗原则可以激活B细胞分泌抗体[44]。脂多糖在沙门氏菌感染宿主的过程中会释放出内毒素,导致宿主白细胞先减少后增加、血小板减少、肝糖消耗、黏膜出血,最终休克死亡[45]。CRAVEN[46]通过对鸡进行灌胃的方法测定了鼠伤寒沙门氏菌野生型和LPS缺失株对鸡肠道细胞的侵袭能力,结果发现LPS缺失型鼠伤寒沙门氏菌定殖于鸡肠道和脾脏中的细胞数量显著低于野生型,表明LPS在沙门氏菌侵袭宿主细胞过程中起着重要作用。
综上所述,沙门氏菌毒力因子多且作用机制复杂,目前认为SPI-1和SPI-2在沙门氏菌入侵人体细胞和在细胞内存活发挥了较为主要的作用,质粒和菌毛等毒力因子中某些操纵子的作用机制仍需进行深入研究。未来或可关注这些毒力因子之间的协同或交叉关系,寻找更多在沙门氏菌致病过程中起作用的毒力因子,有助于明确沙门氏菌感染人体并导致人患病的根本原因,为预防和治疗沙门氏菌病提供思路。
3 沙门氏菌耐受与致病能力的相关性
受沙门氏菌污染的食品在加工、贮藏及运输过程中会受到很多逆境条件的抑杀作用。然而,由于食品基质的保护或沙门氏菌自身的抗性,这些逆境条件可能无法将沙门氏菌完全杀灭,甚至会诱导沙门氏菌抗性、毒性和耐药特性增强。
首先,食品加工及贮藏环节的逆境条件可能使沙门氏菌对后续家庭烹饪环节的热处理产生耐受性。例如,YE等[47]通过分析肠炎沙门氏菌表型和基因表达,发现酸适应后细菌热胁迫(rpoH、uspB和htrA)、盐胁迫(proP、proV和osmW)和冷胁迫(cspA、cspC和csdA)的相关基因表达显著上调。其次,食品加工及烹饪过程中的冷、酸、热、渗透压胁迫等体外应激条件也可能诱导沙门氏菌对体内应激条件产生耐受性。例如,DE MELO等[48]通过人工胃肠道模型测定了经酸和渗透胁迫后的肠炎沙门氏菌和鼠伤寒沙门氏菌对人体胃肠道的耐受性,结果表明经胁迫后的两种血清型的沙门氏菌对胆盐的耐受性及胃肠道存活能力都显著高于未经胁迫的对照组细菌。沙门氏菌感染人体的能力也可能会因前期的一系列逆境条件的应激作用而增强。例如,SIRSAT等[49]测定了亚致死热应激下鼠伤寒沙门氏菌毒力基因的表达以及对Caco-2 细胞的黏附和侵袭能力,结果显示热应激诱导了SPI-2和SPI-5基因的表达,相对于未经热应激的细菌,热应激后的细菌对Caco-2细胞的黏附能力更强。最后,体外和体内各应激条件的胁迫也可能导致沙门氏菌的耐药性增强。例如,DE SALES等[50]利用人工模拟胃肠道模型测定了15株肠道沙门氏菌的耐药性,结果发现其中有12株在体外模拟处理后对环丙沙星出现耐药性,这些结果说明食品加工过程中的杀菌条件和胃肠道逆境环境可能导致沙门氏菌产生耐药性。
因此,沙门氏菌对人体内各应激条件的耐受反应可能使其对其他逆境条件产生交叉保护,或导致其毒力因子的作用增强,从而提高对人体的致病能力,增加感染风险。目前关于沙门氏菌抗性及毒性机制的研究多集中于食品加工或贮存环节的应激条件对沙门氏菌后续生理行为产生的影响,而较少关注沙门氏菌通过食物被人体摄入后面临的应激条件对其耐受及致病机制的影响,故需对沙门氏菌在人体内应激条件下毒力因子作用机制进行深入研究,或许能为更有效地控制沙门氏菌感染提供指导。
4 结论与展望
当前国内外关于沙门氏菌体内耐受及致病能力研究主要集中在表型的测定,对于沙门氏菌在人体胃肠道应激条件连续或协同作用下的调控机制研究仍有不足。未来应重点关注体内应激条件下沙门氏菌调控因子的具体作用方式,通过体内耐受性与致病性之间的交互影响进一步探究沙门氏菌对人体的感染能力。
基于此,本文从以下4个方面作出展望:(1)沙门氏菌在逆境下发生的适应行为使其能更好地在人体胃肠道中生存,继续深入探讨沙门氏菌的抗逆分子机制,可为开发沙门氏菌防控技术提供新的靶标。(2)对沙门氏菌毒力质粒和菌毛中某些作用机制尚不明确的操纵子进行更加深入的研究,探索沙门氏菌更多的毒力靶点和更具体的作用方式,明确沙门氏菌导致人患病的根本原因。(3)将胃肠道连续应激的人工模型应用于沙门氏菌毒力基因等分子水平调控的研究,有助于构建更符合真实情况的沙门氏菌剂量反应关系。(4)可将食品加工及贮存环节的杀菌方式与体内应激条件对沙门氏菌抗性及毒性影响的研究相联系,为预防和控制沙门氏菌感染提供新思路。
