光敏剂溴化5,10,15,20-四(4-吡啶基,N-丙基胺)对神经母细胞瘤细胞系SH-SY5Y杀伤作用研究
2022-01-13陆周霞万洪志
郭 燕, 肖 勃, 陈 絮, 陆周霞, 万洪志, 肖 雁, 肖 竦*
(1.贵州医科大学基础医学院化学教研室,贵州贵阳 550025:2.贵州医科大学分子生物学重点实验室,贵州贵阳 550001)
神经母细胞瘤(Neuroblastoma,NB)是婴幼儿中最常见的颅外实体瘤,占儿童肿瘤的8%~10%[1,2]。研究表明,低、中风险神经母细胞瘤的患儿预后非常好,但高风险患者的预后较差,患者通过化疗、放疗、手术、骨髓清除和免疫疗法可进行治疗,但生存率仍然低于50%[3 - 5]。因此,开发微创、低毒、存活率高的新治疗策略迫在眉睫。
光动力疗法(Photodynamic Therapy,PDT)作为一种新兴的抗肿瘤治疗手段,具有无创、毒性低、预后好、副作用小等优点。光动力肿瘤治疗包含三种重要因素:光敏剂(Photosensitizer,PS)、光和氧。光敏剂被特定波长的光激发,光能转移与氧结合,产生具有毒性的自由基和活性氧(Reactive Oxygen Species ROS),导致细胞凋亡或者坏死[6 - 8]。理想光敏剂的特点是:易溶于水,性质稳定;生物相容性高,能够与细胞内对氧化损伤高度敏感的部位结合;具有靶向性;光照下活性氧的量子产率高;可快速从体内排出;毒副作用低[9]。
卟啉化合物是一类生物体内的天然产物,血卟啉衍生物是现代光敏剂的起源,其对肿瘤细胞具有选择性[10],在光动力治疗的应用中一直占据很重要的位置。肿瘤细胞线粒体内部和细胞核带负电荷[11],易与带正电荷的物质结合。基于此,本文合成水溶性较好,表面带正电荷的卟啉衍生物溴化5,10,15,20-四(4-吡啶基,N-丙基胺)(TPPPA),其光动力作用于SH-SY5Y细胞的杀伤效果明显。
1 实验方法
1.1 主要仪器与试剂
Epoch2超微量微孔分光光度计(美国,Biotek);FV1000激光扫描共聚焦显微镜(日本,奥林巴斯公司);FACSCelesta流式细胞仪(美国,BD);UV-2600紫外-可见光分光光度计(日本,岛津公司);Caryeclipse荧光光谱仪(美国,VRIAN)。420 nm激光器(长春镭仕光电科技光电有限公司)。
人神经母细胞瘤细胞株SH-SY5Y购于ATCC。2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)试剂盒购于日本Sigma公司;3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑溴化物(MTT)及二甲基亚砜(DMSO)购于北京索莱宝公司;细胞培养材料购于北京NEST公司;凋亡试剂盒购于美国BD公司;单线态氧绿色荧光探针(SOSG)购于美国Invitrogen公司;三氯甲烷和N,N-二甲基甲酰胺(DMF)购于山东金昊化工公司;丙酮购于天津科密欧公司;乙腈购于山东紫翔化工公司。
1.2 TPPPA合成和表征
TPPPA的合成线路如下:
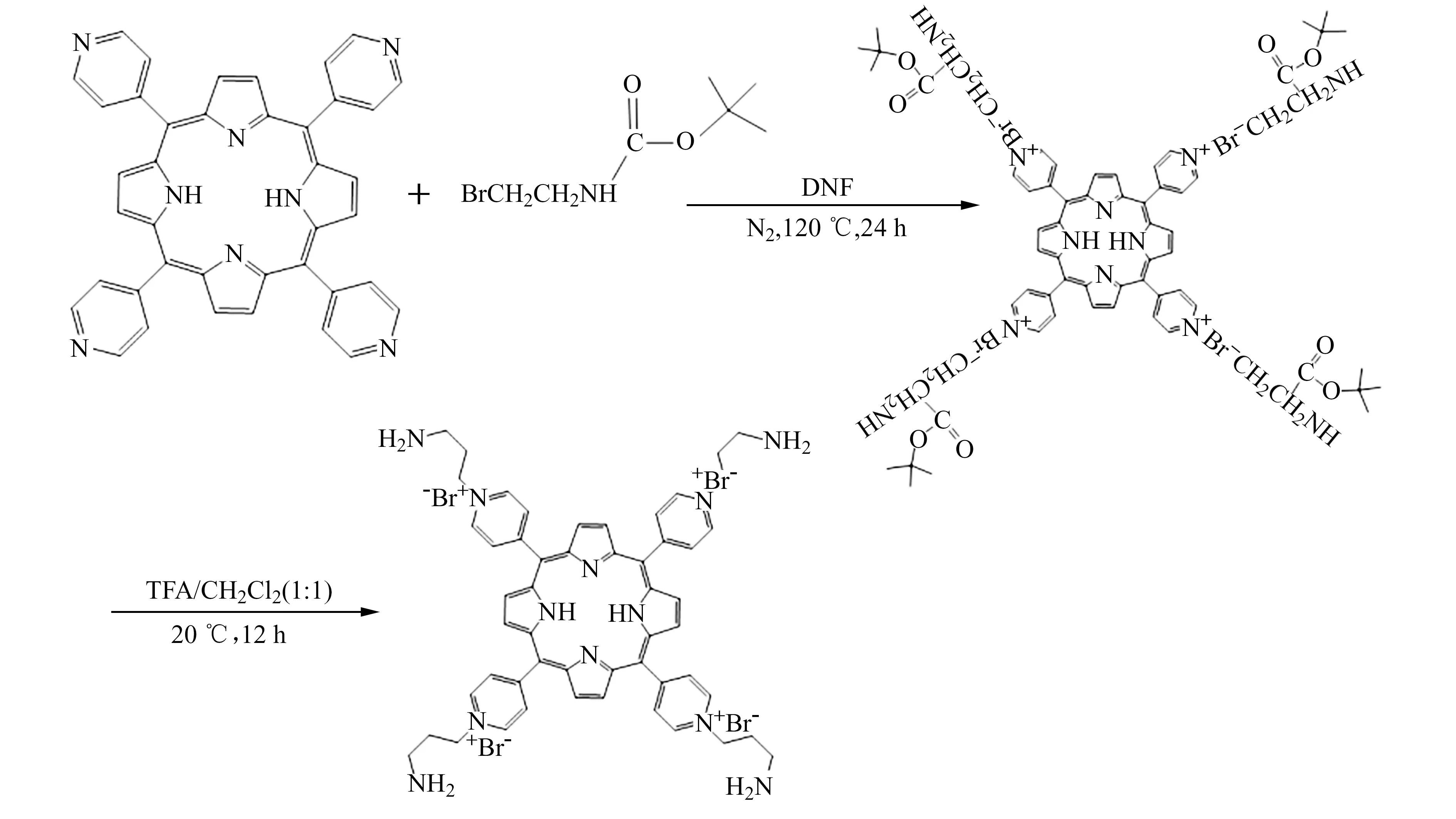
称取5,10,15,20-四(4-吡啶基)卟啉(H2TPyP)123 mg(0.2 mmol)和N-Boc-3-氨基丙基溴952 mg(4 mmoL),加入20 mL超干DMF,氮气保护下120 ℃反应24 h。冷却至室温,将反应液缓慢滴入50 mL乙腈中,待沉淀完全后,减压抽滤,分别用三氯甲烷、丙酮洗涤沉淀。将沉淀溶于10 mL三氟乙酸(TFA)/二氯甲烷混合溶液(体积比1∶1),常温反应12 h。蒸去溶剂,加水溶解,调节溶液pH至7.0,蒸去溶剂,再用5 mL水/乙腈混合溶液(体积比1∶1)重结晶,得到紫红色固体。固体产物53 mg,产率约为22%。
1H NMR(DMSO,400 MHz):δ:9.61(d,8H),9.27(s,8H),9.03(d,8H),5.01(t,8H),3.47(t,8H),2.56(m,8H)。
将制备的TPPPA配制成浓度为10 μmol/L的溶液,测定动态光散射(Dynamic Light Scattering,DLS),紫外-可见吸收光谱和荧光光谱。加入2.5 μL的SOSG溶液混匀,420 nm激光照射检测单线态氧。
1.3 细胞形态学观察
6孔板培养SH-SY5Y细胞,加入1 mL浓度为10 μmol/L的TPPPA溶液共同孵育24 h,420 nm激光照射后,用倒置荧光显微镜观察。
1.4 细胞内活性氧检测
6孔板培养细胞,用浓度为10 μmol/L的TPPPA溶液孵育24 h,然后加入1 mL浓度为10 μmol/L DCFH-DA孵育20 min,420 nm激光照射细胞后,继续孵育30 min,用无血清的培养液洗涤细胞3次,对照组不加光敏剂。用倒置荧光显微镜采集荧光图像,用图像软件ImageJ进行分析。
1.5 细胞存活率检测
96孔板培养细胞,加入100 μL一定浓度的TPPPA溶液共同孵育24 h,对照组不加药物孵育,光照后继续孵育24 h,每孔加入MTT溶液20 μL(5 mg/mL),37 ℃培养箱中孵育4 h,弃去上清液,加入150 μL DMSO,室温振荡5 min,用超微量微孔分光光度计,于490 nm波长处测量吸光度。计算细胞生存率:细胞生存率=实验组OD值/对照组OD值×100%。
1.6 细胞凋亡检测
实验分为空白对照组、激光照射组、TPPPA药物组和TPPPA-PDT组。6孔板培养细胞,加入1 mL浓度为10 μmol/L的TPPPA溶液孵育24 h,420 nm激光照射(50 mW/cm2,3 min),继续避光孵育6 h,用凋亡试剂盒检测,流式细胞仪分析。
1.7 TPPPA在SH-SY5Y细胞内的分布
采用激光共聚焦专用培养皿(Φ15 mm玻璃皿)培养细胞,加入1 mL浓度为10 μmol/L的TPPPA溶液孵育24 h后,再加入DAPI溶液孵育30 min,磷酸盐缓冲溶液(PBS)洗涤细胞5次,420 nm激光照射(50 mW/cm2,1 min)后,用激光共聚焦扫描显微镜采集荧光图像。
2 结果与讨论
2.1 理化性质检测
药物具备良好的水溶性有利于其在体液内转运,结合到作用部位,从而产生药物效应。一般来说,毛细血管内皮细胞间的孔隙直径约60~120 nm,亲水性药物的分散粒径大小,影响药物通过细胞膜的水性通道,进而影响药物的跨膜转运[12]。当H2TPyP接入丙基胺后,吡啶基的侧链增长,空间位阻增大,分子间的静电斥力使之在水中的溶解性得到改善。DLS结果如图1所示,25 ℃下,TPPPA和H2TPyP的溶液均表现为单峰分布,大小均一,水合动力学粒径分别为~50 nm,~120 nm。TPPPA分散粒径减小,更易于通过细胞膜,促使药物有效进入细胞。

图1 H2TPyP和TPPPA的动态光散射图
10 μmol/L TPPPA水溶液与H2TPyP的DMSO溶液的紫外-可见吸收光谱、荧光发射光谱比较,其强度明显增强(图2),体现良好的光谱性质。TPPPA的紫外-可见吸收光谱包括两个特征吸收(图2A):420 nm左右的Soret带,以及500~600 nm区间的弱吸收Q带。向长波方向各吸收峰相对强度逐渐减弱。424.5 nm出现最大吸收(2.36)。如图2B所示,425 nm波长激发下,在710 nm发射较强的明亮红色荧光,接近近红外区域,近红外光在组织或细胞中的穿透力有明显优势,利于在细胞及组织中进行观察。

图2 H2TPyP、TPPPA的紫外-可见吸收光谱图(A)和荧光光谱图(B)
2.2 单线态氧的生成
卟琳类光敏剂主要的毒性产物是单线态氧,光照条件下由于激发光、光敏剂和分子氧的相互作用,平衡被打破,光敏剂受激光照射后与分子氧结合生成单线态氧的能力,直接影响光动力疗法的效果。利用荧光探针SOSG 检测产生单线态氧的量,如图3。TPPPA在420 nm、30 mW/cm2光照激发下,产生的单线态氧产率随光照时间增加而上升,呈现时间依赖性。由于丙胺基的引入,整个化合物的电子云密度降低,由基态跃迁到激发态的能量降低,使跃迁更易发生,处于激发态的光敏剂发生能量转移易产生较多的单线态氧,如果作用于肿瘤细胞,会引起一系列生理变化和对肿瘤细胞的毒性杀伤。这一结果为药物TPPPA进入肿瘤细胞后的杀伤作用提供了基础。

图3 TPPPA的单线态氧检测
2.3 形态学观察
在倒置荧光显微镜白场下观察光动力作用下细胞的形态变化(图4)。对照组细胞呈梭形或多角形贴壁生长,有神经突样突起(图4A)。实验组光照1 min后出现细胞变圆,胞浆中充满颗粒,胞膜边缘不光滑(图4B)。光照2 min 后大部分细胞变圆,胞质中出现空泡(图4C)。光照3 min后可观察到细胞膜崩解(图4D)。由于丙胺基的引入使TPPPA带正电荷,增强了与肿瘤细胞的阴离子基团的相互作用,亲和性增加,光动力作用下细胞形态变化明显。

图4 倒置显微镜下SH-SY5Y细胞形态改变(200×)
2.4 SH-SY5Y细胞内活性氧的检测
肿瘤细胞对ROS非常敏感,ROS的存在是光动力作用杀伤肿瘤细胞的重要决定因素[13,14],采用DCFH-DA荧光探针对其进行检测[15]。TPPPA与细胞孵育24 h,420 nm激光(功率为50 mW/cm2)照射,细胞内产生的ROS明显增加(图5)。对图5A进行荧光定量分析,如图5B所示,显示出光照3 min细胞内产生的ROS约为光照1 min时的两倍(P<0.01)。

图5 TPPPA作用于SH-SY5Y细胞后ROS的产生
2.5 光动力作用检测
MTT结果显示,TPPPA的暗毒性很低(图6A),420 nm激光的光毒性很小(图6B),TPPPA浓度为10 μmol/L,光照强度、光照时间均与细胞存活率成负相关(图6C和6D),光照(50 mW/cm2)3 min时的光动力作用最强,细胞存活率仅为17.33%。采用最优检测条件(50 mW/cm2,3 min),利用流式细胞仪检测细胞凋亡情况,肿瘤细胞SH-SY5Y的凋亡率达到46.32%(图7)。细胞凋亡的方式有很多种,其中ROS的增加会引发抗氧化能力增强,细胞氧化还原系统失衡,导致严重的细胞损伤[16]。线粒体是产生ROS的主要部位,大量的ROS引起线粒体相关的促凋亡蛋白释放,引起细胞凋亡[17]。

图6 SH-SY5Y细胞存活率

图7 流式细胞仪检测SH-SY5Y细胞的凋亡情况(50 mW/cm2,3 min)
2.6 TPPPA在SH-SY5Y细胞中的分布
4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)在荧光显微镜下发出蓝色荧光,可以和DNA结合用于活细胞细胞核的染色[18]。TPPPA发出的红色荧光可以指示其在细胞中滞留的位置。激光照射细胞(50 mW/cm2,1 min)孵育10 min后,可观察到TPPPA广泛分散在细胞质和细胞核(图8A),孵育30 min后,TPPPA主要集中于细胞核(图8B)。由于TPPPA被丙胺基官能团修饰后带正电荷,且细胞线粒体内部和细胞核DNA表面均存在负电荷,光动力作用过程中,光敏剂通过细胞膜进入细胞,随着时间推移,再向细胞核转移。这可能因为TPPPA在光动力作用过程中线粒体功能逐渐发生障碍,结合作用减弱,通过静电作用定位于细胞核[19]。
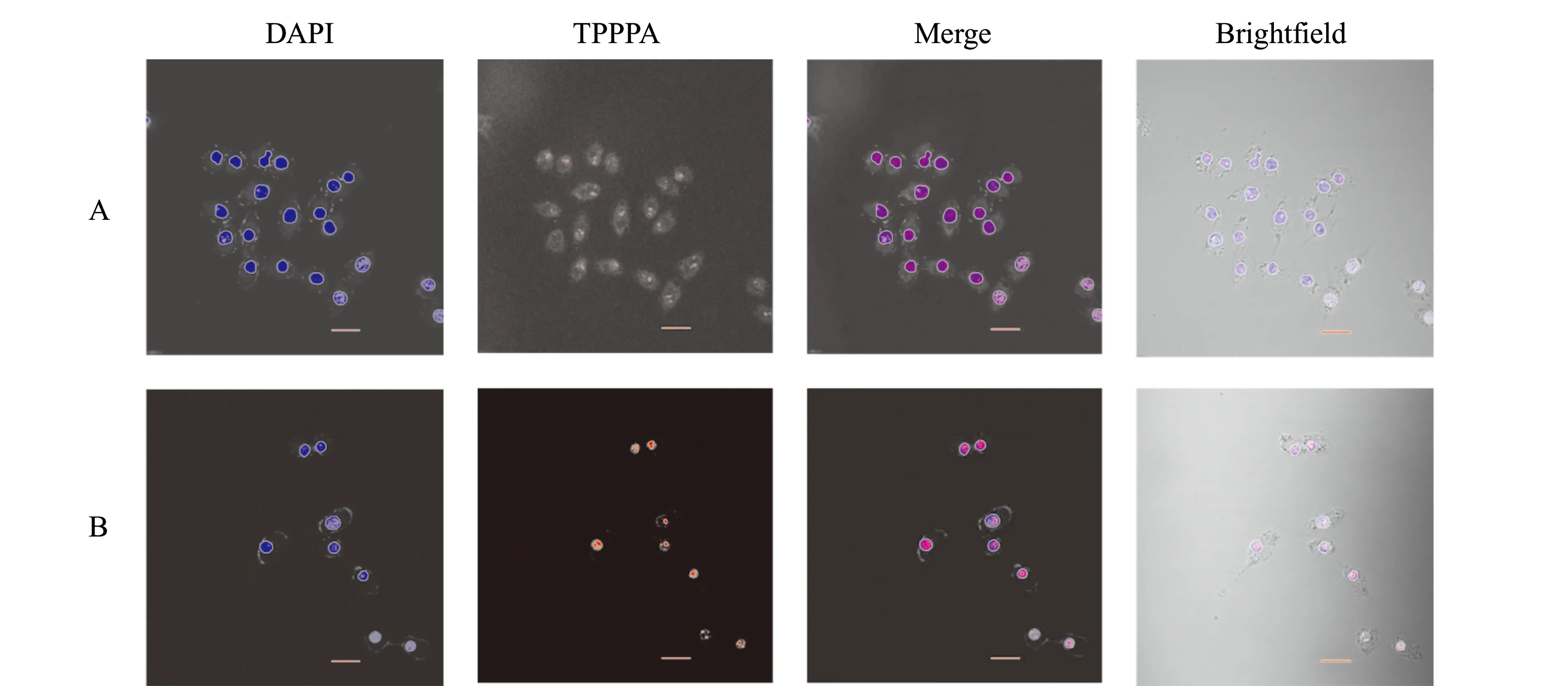
图8 激光扫描共聚焦显微镜观察TPPPA在SH-SY5Y细胞内的分布(标尺=10 μm)
3 结论
合成获得的卟啉衍生物TPPPA,由于引入了极性丙基胺基团,水溶性较好,光学性能优良。借助卟啉衍生物TPPPA发出的红色荧光可观察药物在细胞中的分布情况。TPPPA水溶液带正电荷,激光照射后与细胞内带负电荷的物质结合进入细胞,广泛分布于细胞内,随后集中于细胞核。此过程产生的ROS,有效杀伤SH-SY5Y细胞。实验结果表明TPPPA具备理想光敏剂的特征,这将为设计和筛选带正电荷的光敏剂提供依据。
