天冬氨酸氯化生成含氮消毒副产物连续反应动力学的建模
2022-01-12薛如冰刘志刚周正协何建荣
薛如冰,刘志刚,周正协,何建荣,许 航,陈 卫
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京 210098;2.河海大学环境学院,江苏南京 210098;3.宁波市自来水有限公司,浙江宁波 315041)
我国饮用水水源污染呈现多种污染物共存的复合污染特征,大量常规有机污染和微量有机化合物共存[1]。NaClO作为消毒剂具有操作简便、效果可靠、价格低廉的优点,但其与有机物反应会生成有致癌作用的消毒副产物(DBPs)[2]。
自从在氯化饮用水中检出三氯甲烷(CF)后,DBPs的出现成为学者研究消毒饮用水的热点[3],与常规的DBPs相比,含氮消毒副产物(N-DBPs)具有更强的遗传毒性和细胞毒性[4-7]。N-DBPs的前体物主要是溶解性有机氮(DON),而广泛存在于天然水体中的氨基酸,占DON的20%~75%[8]。天冬氨酸(Asp)作为氨基酸的一种,是天然水体中普遍存在的内源性天然有机物,也是蛋白质和藻类有机化合物的重要组成成分[9]。学者指出,Asp是二氯乙腈(DCAN)和二氯乙酰胺(DCAcAm)典型的前体物,有着较高的产率[10-11]。Chen等[12]在此前已将Asp作为N-DBPs前体物,研究Asp氯化生成DCAN、DCAcAm、亚硝基二甲胺(NDMA)、氯化氰(CNCl)的水体环境因子和水处理技术参数影响机制,同时探究了它们的生成特性。
综上,研究者们对N-DBPs前体物已经有了一定的认识,然而对氨基酸氯化生成N-DBPs的连续反应机理尚不明确。因此,为了有效确定N-DBPs的生成趋势及其稳定性,本文以天然水体中普遍存在的内源性天然有机物Asp为N-DBPs前体物,研究Asp氯化生成DCAN和DCAcAm的经时变化规律,以及DCAN和DCAcAm的水解性能,并建立Asp氯化生成DCAN及DCAcAm的连续反应动力学模型,为实际生产运行中有效控制N-DBPs提供理论依据。
1 试验材料和方法
1.1 试验装置
氨基酸氯化生成N-DBPs以及N-DBPs的水解试验装置如图1所示。称取0.01 mmol的Asp和0.3 mmol的NaClO溶液于100 mL的容量瓶中,并加入去离子水,NaOH或者HCl水溶液调节pH值至7±0.2后,用去离子水定容到100 mL,最后将配置好的反应溶液转移至棕色玻璃瓶,放置在(22±1) ℃恒温水浴锅中,于无光条件下进行反应。在反应时间分别为1、2、4、8、24、48、72、120 h和168 h时取样,加入抗坏血酸终止Asp和氯的进一步反应,并检测溶液中DCAN和DCAcAm的浓度。
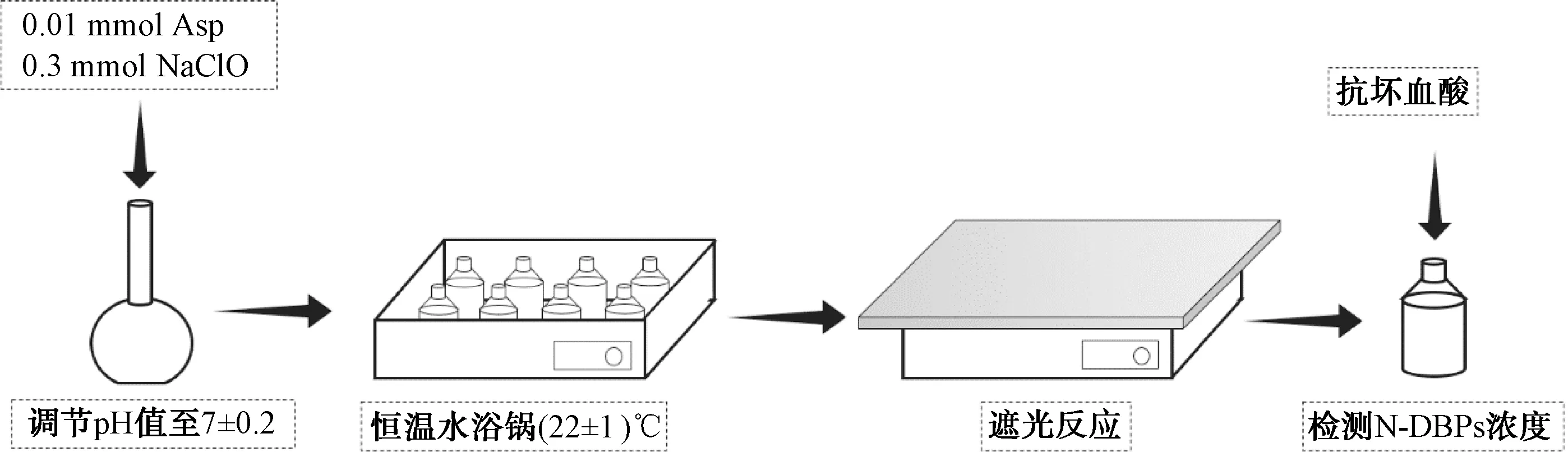
图1 氯化试验装置和流程图Fig.1 Flow Chart and Chlorination Experimental Facility
1.2 分析方法
水样测定N-DBPs之前的预处理方法为水溶液和氯反应一定时间后,向水溶液中投加2 mmol/L的抗坏血酸,以中和没有和氨基酸反应的余氯,分别采用0.1 mol/L的HCl和0.1 mol/L的NaOH 将水溶液的pH值调节至4~6,保证N-DBPs稳定不易水解。
采用GC-MS液-液萃取法检测DCAN,采用GC-ECD液-液萃取法检测DCAcAm,最小检测限均<1 μg/L,回收率分别为98%和82%。
2 结果与分析
2.1 连续一级反应动力学模型
连续化学反应是一种典型且较复杂的化学反应,即化学反应是由多步完成,前一步的生成物即为下一步的反应物,如此进行,称为连续反应,若两步反应都是一级反应,则称为连续一级反应[13-14][式(1)]。
(1)
其中:A——第一步反应的反应物;
B——第一步反应的生成物,同时也为第二步反应的反应物;
C——第二步反应生成物;
k1、k2——第一步和第二步反应的反应系数。
由动力学反应可知,这3种物质的反应速率表达式分别为式(2)~式(4)。
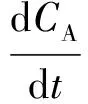
(2)
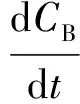
(3)
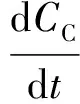
(4)
其中:CA、CB、CC——A、B、C物质的摩尔浓度,mol/L;
t——反应时间,h。
将式(2)、式(3)和式(4)分别积分,可分别得到3种物质的浓度如式(5)~式(6)。
CA=CA,0e-k1t
(5)
(6)
(7)
其中:CA,0——A物质的初始摩尔浓度,mol/L。
式(5)、式(6)和式(7)中3种物质浓度随时间变化的曲线如图2所示。初始反应A物质的浓度随反应时间延长而逐渐降低;以A物质为反应物的生成物B,浓度先逐渐升高,在浓度出现极大值后,转而逐渐降低,这是连续反应的突出特征;同时,以B物质为反应物的生成物C,其浓度则随着时间的延长逐渐上升。
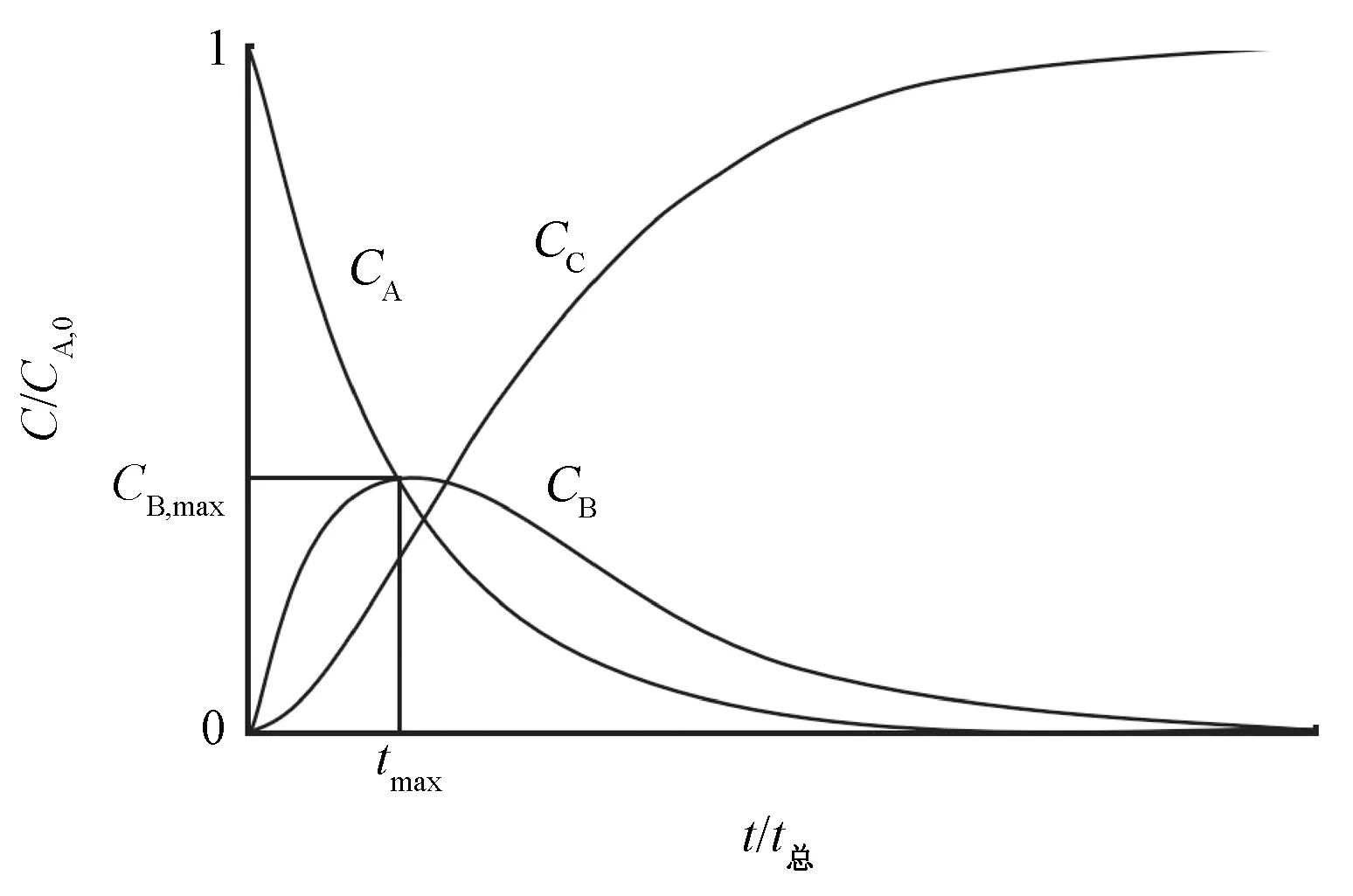
图2 连续一级反应各物质浓度随时间变化曲线Fig.2 Concentration-Time Curves of Each Substance in Consecutive First-Order Reaction
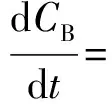
(8)
(9)
(10)
其中:tmax——B物质达到最大浓度的反应时间,h;
CB,max——B物质的最大摩尔浓度,mol/L。
2.2 氯化N-DBPs经时变化规律
根据本课题组Chen等[12]在前期研究,本研究选择添加0.1 mmol的Asp和0.3 mmol的NaClO于装置中进行试验,Asp氯化生成N-DBPs的经时变化规律如图3所示。数据表明随着反应时间的增加,DCAN的浓度在前4 h内逐渐升高,并于4 h时达到最大值,为128.5 μg/L,随后开始逐渐降低。主要原因是不稳定的DCAN会发生水解,且水解速率随着生成浓度的逐渐增加而升高。因此,检测到的DCAN浓度为生成浓度和水解浓度的差值,当DCAN达到浓度的最大值时,DCAN的生成速率和水解速率相等[15-16]。
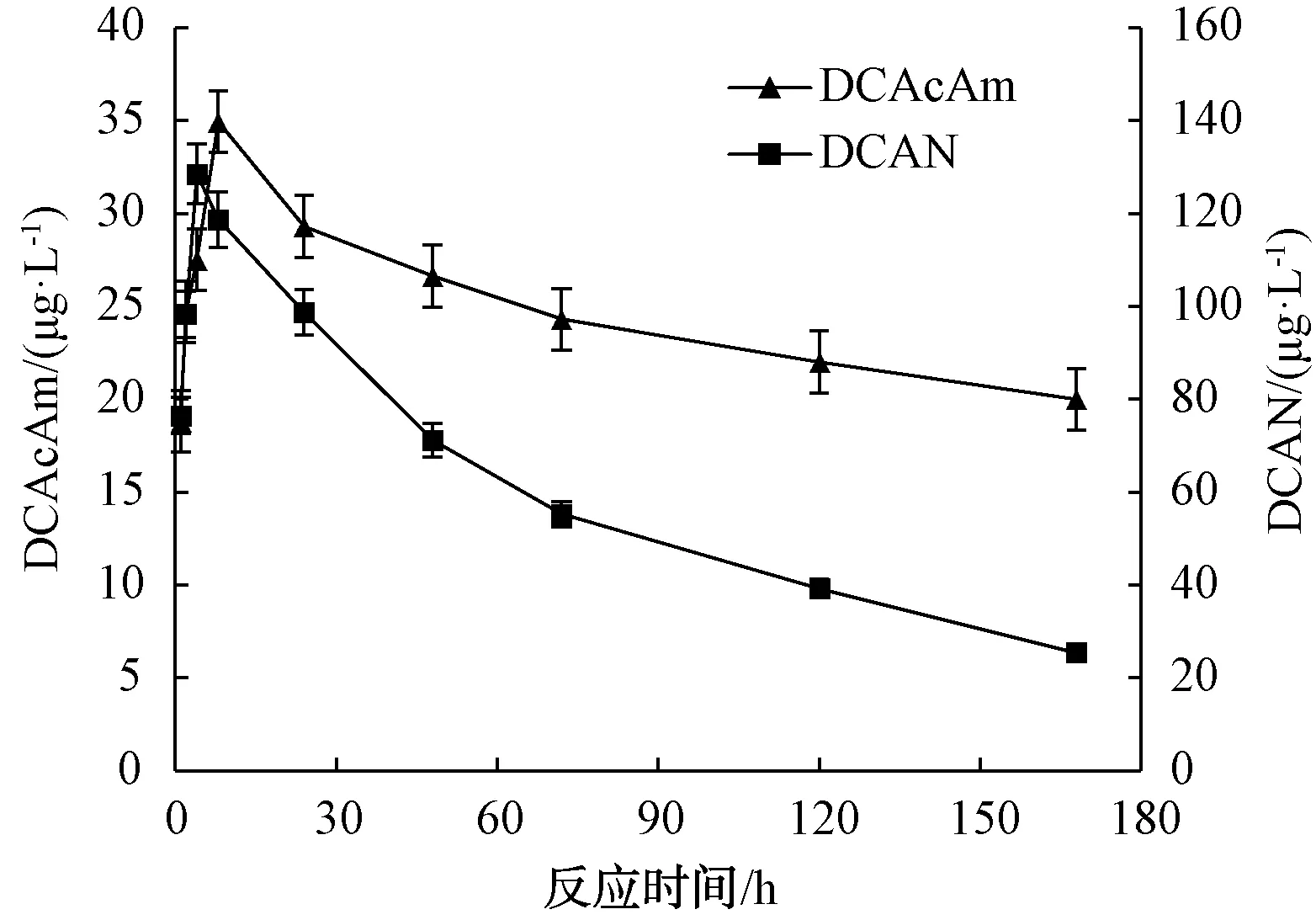
图3 反应时间对Asp氯化生成DCAN和DCAcAm的影响Fig.3 Effect of Reaction Times on Formation of DCAN and DCAcAm by Asp Chlorination
DCAcAm的浓度随着反应时间的延长,也同样呈现先升高后降低的趋势,在反应时间为8 h时,DCAcAm浓度达到最大值,为34.9 μg/L。这是因为不仅DCAcAm自身会发生水解,DCAN也会水解生成DCAcAm,当水溶液中有足够的DCAN,水解生成DCAcAm的速率会增大,从而导致DCAcAm的最大值出现时间晚于DCAN[17]。
此试验的溶液中并未检测出NDMA和CNCl,因此,本文主要探究产率较高且较为典型的N-DBPs——DCAN和DCAcAm的水解规律以及其反应模型。
2.3 N-DBPs水解性能
本课题组在前期研究中探究了Asp在不同条件下的生成特性,但并未研究其水解特性,而在连续一级反应动力学的模型中涉及到生成速率常数和水解速率常数这2个速率常数,意味着一旦有不稳定的N-DBPs的生成,也一定会伴随它的分解。不稳定的N-DBPs在水体中主要为水解反应,而水解速率常数可以通过配置一定浓度的N-DBPs通过试验来确定。考虑到2.2节中的试验得到Asp氯化反应生成DCAN和DCAcAm的质量浓度最大值分别为128.5 μg/L和34.9 μg/L,且根据我国供水现状,氯化反应后的出厂水至用户处的停留时间一般多集中于24 h,此时DCAN、DCAcAm的质量浓度分别为98.7、29.3 μg/L。因此,本节选择配制质量浓度分别为100、50 μg/L的DCAN、DCAcAm的溶液,在和2.2节中相同的试验条件下,分别于1、2、4、8、24、48、72、120、168 h时对其取样,并测定DCAN、DCAcAm对应时间下的浓度。
图4为DCAN和DCAcAm随时间变化的水解衰减,通过拟合,这2种物质的水解速率常数分别为0.011、0.008 h-1,相关系数R2也均在0.99以上,结果说明了DCAN和DCAcAm的水解均符合一级反应。

图4 DCAN和DCAcAm的水解衰减Fig.4 Hydrolytic Attenuation of DCAN and DCAcAm
水解速率常数越大,物质就越不稳定,因此,由DCAN和DCAcAm的水解速率常数可知,虽然DCAN和DCAcAm的水解常数相差并不大,但相对于DCAcAm来说DCAN更不稳定。这也进一步说明了这2种N-DBPs随着Asp和氯反应时间的延长,溶液中检测出DCAN的最大值出现的时间比DCAcAm更早,这一结果与2.2节中的研究相符。同时,这也和生成速率有一定的关系,需要建立连续反应动力学模型来进一步阐述。
2.4 模型在氨基酸氯化生成N-DBPs经时变化的应用
由图3可知,Asp与氯反应会生成DCAN,但所生成的DCAN的最大浓度也只占Asp初始摩尔浓度的2%不到,且Asp和氯反应后还会生成卤乙酸(HAAs)、卤乙腈(HANs)、三卤甲烷(THMs)、卤硝基甲烷(HNMs)等多种DBPs[18],DCAN只是生成物中的一部分,或者说只有一部分的Asp和氯反应是生成DCAN,还有部分甚至大部分的Asp和氯反应生成其他的DBPs以及非消毒副产物的物质。因此,即使Asp和氯反应生成DCAN的反应以及其水解反应均为一级反应,也不能直接采用式(6)得到溶液中的DCAN浓度。同时,为了统一单位,将式(6)换算为式(11),其中CA,0改为CAsp,0×MDCAN×αDCAN。
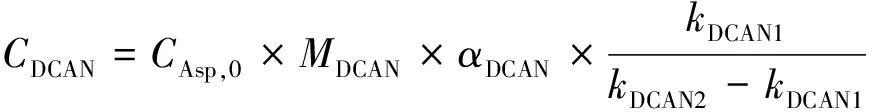
(11)
其中:CDCAN——t时溶液中所检测出的DCAN质量浓度,μg/L;
CAsp,0——Asp的初始摩尔浓度,mmol/L,本研究中取值为0.1 mmol/L;
MDCAN——DCAN的摩尔质量,为110 g/mol;
αDCAN——DCAN的反应系数;
kDCAN1、kDCAN2——DCAN的生成速率和水解速率常数,h-1。
由2.1节可知,在tmax时DCAN达到浓度的最大值,将式(9)代入式(11),得式(12)。
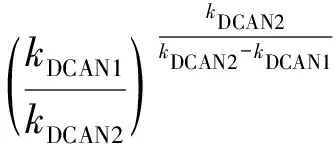
(12)
根据式(11),用Matlab软件对其进行拟合,拟合结果如图5所示。由模拟结果可得,相关系数R2为0.97,αDCAN为0.012,kDCAN1、kDCAN2分别为0.982 9、0.010 6 h-1,说明Asp和氯反应生成DCAN的反应以及DCAN的水解反应均符合一级反应。DCAN的生成速率常数明显大于水解速率常数,所以会呈现水溶液中检测的DCAN浓度先升高后降低的结果。利用式(12)计算,得到DCAN的最大质量浓度为125.4 μg/L,对应的反应时间为4.66 h。该结果与2.2节的试验中DCAN于4 h时达到最大质量浓度(128.5 μg/L)的结果基本吻合。
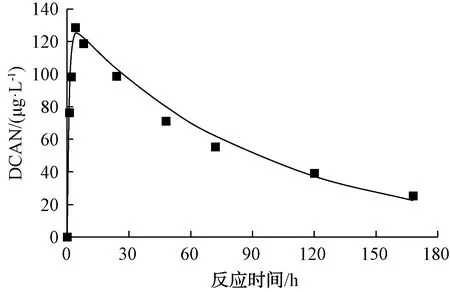
图5 DCAN连续一级反应随时间变化关系模拟曲线Fig.5 Simulated Concentration-Time Curves for DCAN in Consecutive First-Order Reaction
通过一级连续反应动力学模拟Asp氯化生成DCAcAm的相关系数较小,相关研究表明,DCAcAm并不是全部来源于DCAN的水解,也可能直接来源于氨基酸和氯的反应或者其他途径[19]。因此,这里假设DCAcAm的生成途径有2种:一种是Asp和氯反应生成DCAN,DCAN进一步水解生成DCAcAm,即式(7)中的CC;另一种途径是Asp和氯反应后直接生成DCAcAm,即式(6)中的CB。但是,DCAN的水解产物也不一定全部都是DCAcAm。
经过DCAN水解生成DCAcAm的浓度CDCAcAm-1、Asp和氯反应后直接生成DCAcAm的浓度CDCAcAm-2、在溶液中检测到DCAcAm的浓度CDCAcAm分别为式(13)~式(15),其中,CA,0-1和CA,0-2分别换算为CAsp,0×MDCAcAm×αDCAN×αDCAcAm-1和CAsp,0×MDCAcAm×αDCAcAm-2。
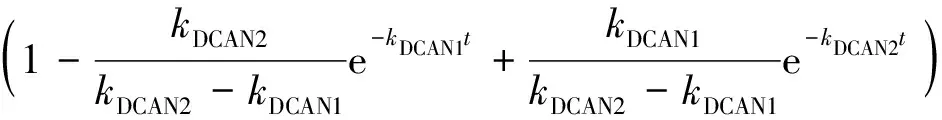
(13)
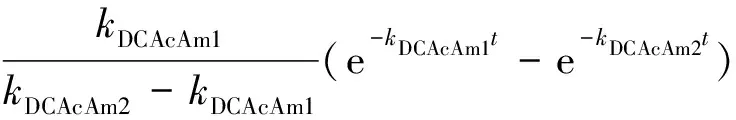
(14)
CDCAcAm=CDCAcAm-1+CDCAcAm-2
(15)
其中:CDCAcAm——t时溶液中所检测出的DCAcAm质量浓度,μg/L;
CAsp,0——Asp的初始摩尔浓度,mmol/L,本研究中取值为0.1 mmol/L;
MDCAcAm——DCAcAm的摩尔质量,取值为128 g/mol;
αDCAcAm-1、αDCAcAm-2——Asp和氯反应生成DCAN后再水解生成DCAcAm、Asp和氯反应直接生成DCAcAm的反应系数;
kDCAcAm1、kDCAcAm2——DCAcAm的生成速率、水解速率常数,h-1。
根据式(13)~式(15),用Matlab软件对其进行拟合的结果如图6所示。由拟合结果可得,相关系数R2为0.73,αDCAcAm-1、αDCAcAm-2分别为0.091、0.000 24,kDCAcAm1、kDCAcAm2分别为0.655 3、0.008 23 h-1。
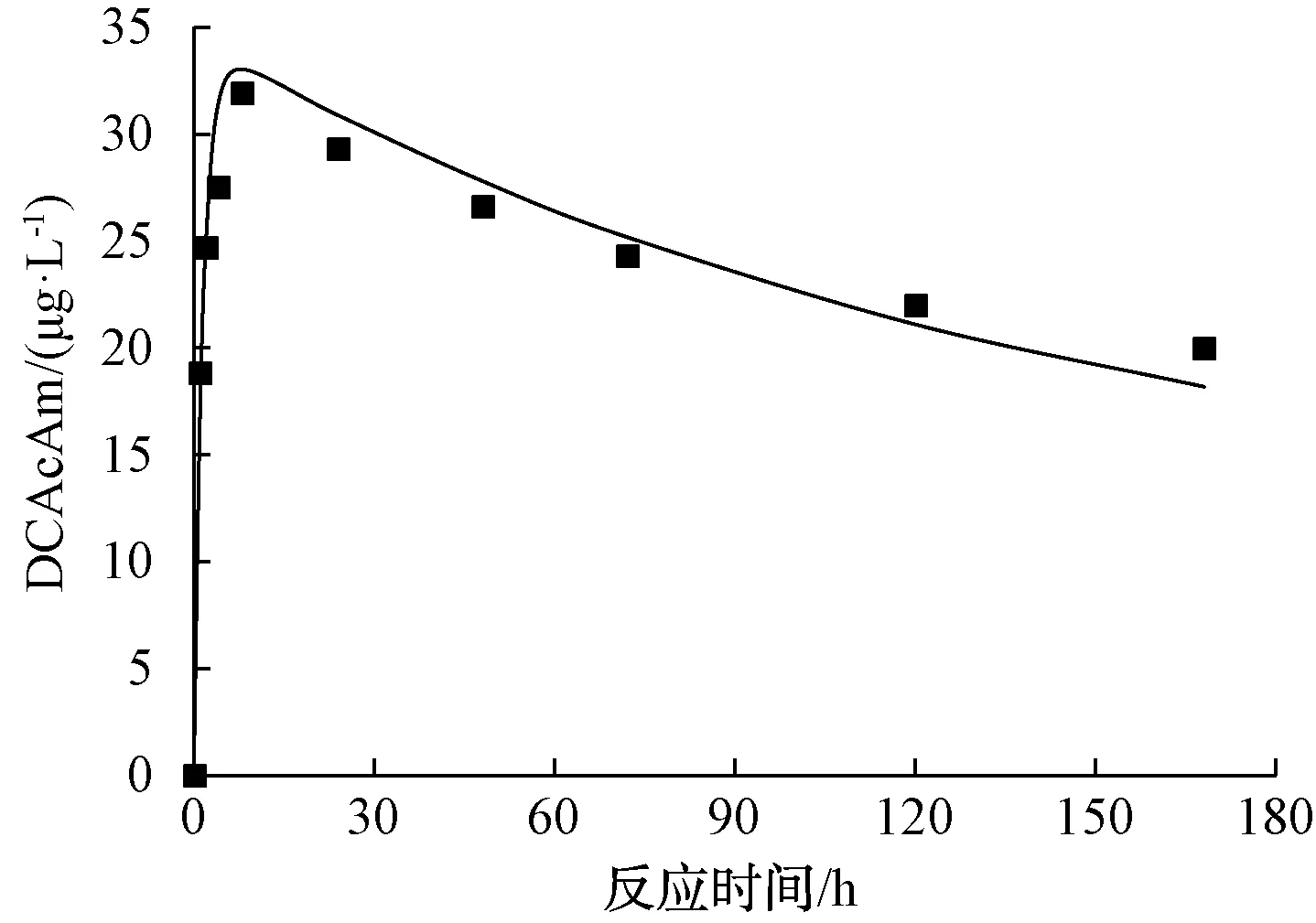
图6 DCAcAm连续一级反应随时间变化关系模拟曲线Fig.6 Simulated Concentration-Time Curves for DCAcAm in Consecutive First-Order Reaction
由上述数据可知,DCAcAm的相关系数明显没有DCAN的动力学模型高,说明DCAN的水解除来源于Asp和氯反应直接生成DCAcAm外,可能还存在其他途径生成DCAcAm。但是,DCAcAm的生成速率常数明显高于水解速率常数,这与2.2节研究中实际溶液里检测到的DCAcAm浓度先上升后下降的趋势相符合。通过Matlab拟合得到DCAcAm的最大质量浓度为33.03 μg/L,相对应的反应时间为7.61 h。在2.2节的经时变化试验中,DCAcAm的浓度在8 h时达到最大值(34.9 μg/L),与反应动力学模型所得的数据基本吻合。
综上,以Asp为前体物的氯化含氮消毒副产物DCAN和DCAcAm的浓度变化符合一级连续反应动力学模型,可由此有效确定N-DBPs的生成趋势,为实际生产提供参考。
3 结论
本文以天然水体中普遍存在的内源性天然有机物Asp为N-DBPs前体物,探究了Asp氯化生成N-DBPs经时变化规律,解析了N-DBPs的水解特性,并建立了氨基酸氯化生成N-DBPs的连续反应动力学模型,得出以下结论。
(1)随着Asp和氯反应时间的延长,DCAN、DCAcAm的质量浓度均呈现先升高后降低的趋势,所出现最大值分别为128.5、34.9 μg/L,对应时间分别为4、8 h。反应溶液中并未检测出NDMA和CNCl。
(2)DCAN、DCAcAm的水解反应均符合一级反应,水解速率常数分别为0.011、0.008 h-1,DCAN相对于DCAcAm来说更加不稳定。
(3)Asp和氯反应生成DCAN、DCAcAm均符合连续一级反应动力学,Asp和氯反应生成DCAN的路径相对较单一,所以一级反应动力学模型拟合度较高。而DCAcAm不仅来源于DCAN的水解、Asp和氯的反应生成,也可能存在其他路径生成,因此,其一级反应动力学模型拟合度没有DCAN的高。通过拟合,DCAN、DCAcAm出现的最大值分别为125.4、33.03 μg/L,所对应的反应时间分别为4.66、7.61 h。
