基于核基因RAG1海蛇分子系统学初步研究
2022-01-12王湘君苏海英
王湘君 陈 文 苏海英
①海南热带海洋学院水产与生命学院,两栖爬行动物研究省级重点实验室②南京师范大学生命科学学院 ③海南热带海洋学院海洋科学技术学院
国内两栖爬行动物分子系统学研究,通常采用线粒体基因片段。目的:为研究核基因片段在海蛇分子系统学中的可行性。方法:搜索并下载NCBI上所有海蛇RAG1基因序列。运用Mega软件比对后,建立MrBayes系统聚类树。结果:结果显示,数据库中共包括2亚科6属41种的RAG1序列,系统发育树支持率不高,部分分支不清晰;中国产的5个单属单种都应隶属于真海蛇属,海蛇的亲缘关系与地域关系不明显。结论:建议RAG1基因与线粒体基因联合建树,并更新《中国动物志》。
1 前言
海蛇肉营养蛋白高、滋味鲜美、食之强身健体。鲜食或加工罐头食品均可,经济价值很高。
海蛇亚科Hydrophiinae和扁尾海蛇亚科Laticaudinae,与眼镜蛇亚科Elapinae相似,具有前沟牙的毒蛇。尾侧扁如桨,躯干后部亦略侧扁[1]。
多数海蛇聚集在北大洋洲和南亚半岛之间,比如环纹海蛇、长吻海蛇、青环海蛇和青灰海蛇等几种海蛇发现于温带水域。
中国沿海分布着长吻海蛇、黑头海蛇、平颏海蛇、扁尾海蛇、环纹海蛇、半环扁尾海蛇、青环海蛇、淡灰海蛇、青灰海蛇、小头海蛇、棘眦海蛇、海蝰、蓝灰扁尾海蛇、龟头海蛇、棘鳞海蛇等l5种扁尾海蛇亚科和海蛇亚科。这些海蛇主要生存南海、北部湾以及琼、台、粤、桂和闽等沿海区域,长吻海蛇分布于中国沿海省份[2]。
通过 DNA 分子标记技术研究蛇类亲缘关系和进化地位,对蛇类资源的科学评估和保护及开发利用都有重要意义[3-5],但国内都是基于线粒体基因的进化树分析。
重组激活蛋白基因(recombination activating gene,RAG)是脊椎动物内特有的一类基因,在脊椎动物T细胞受体和免疫血球素基因的重排与重组过程中扮演着关键角色[6]。RAGs,尤其是RAG1,具有进化缓慢,第3位密码子变化最小,不同物种之间的碱基组成近乎恒定等一些适于用来研究系统发育的特点[7]。
该基因作为脊椎动物特异性免疫反应的关键基因,国内已经应用于鱼类[8-11]和鸟类[12]多个物种 DNA 水平上的序列分析。国外也成功运用于两栖类[13]和爬行类[14]的分子系统树的建立。
本实验研究旨在通过比较分析2亚科6属41种的 RAG1 序列,构建分子系统进化树,探讨该基因建树的可行性,并初步分析海蛇的系统关系。
2 材料与方法
研究材料及方法如下所示。
从NCBI搜索所有海蛇RAG1基因序列,若某个物种的序列多于5条,则最多保留5条,根据序列号,尽量保留不同来源的数据,共下载海蛇亚科和扁尾海蛇亚科6属41种78条序列。
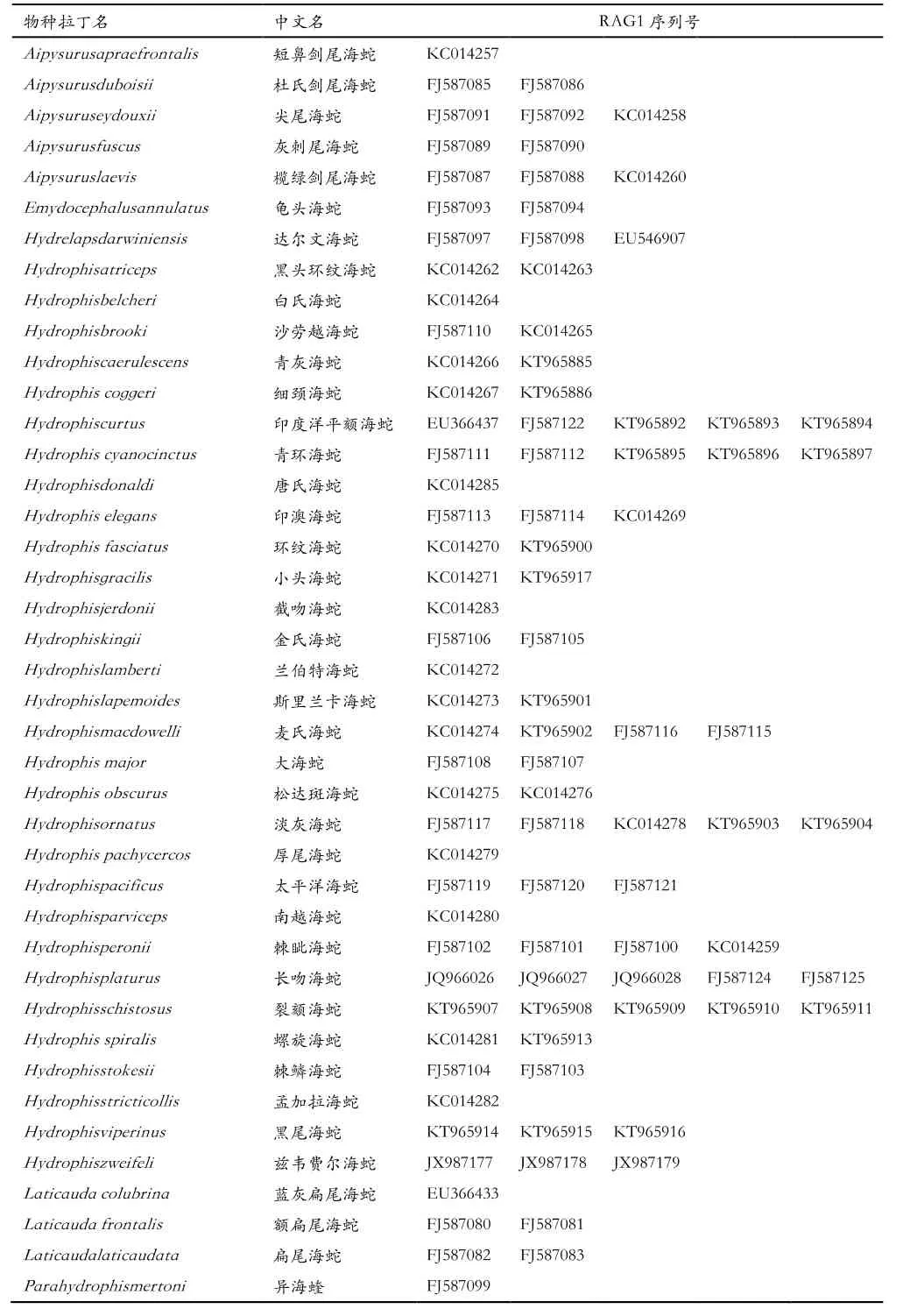
表1 从GenBank下载的RAG1序列旋海蛇
下载序列存为fasta文件并辅以手动校正,进而序列放进MEGA7.0进行校对。通过基因序列数据处理后应用Java(Sequence Matrix)构建的贝叶斯系统树,采用标准模型,300万代收敛,约6h收存。
同样的模型,换用计算服务器平台由重庆有线电视网络股份有限公司提供云计算环境,36VCPU,32G内存,13min完成收树。
3 结果与分析
如图,海蛇亚科(Hdrophiinae)6属41个物种,多物种混为一支,扁尾海蛇亚科(Laticaudinae))同种个体聚集趋势明显,同物种除海蛇属相应分支支持率均低于40%。整体树总体拓扑结构不清晰。有个别不清晰点为物种名有变动,此树建树时间过长且多物种混为一支无法应用。
物种名有变动点:Polyodontognathuscaerulescens现用名Hydrophiscaerulescens、Microcephalophisgracilis现用名Hydrophisgracilis、Leioselasma elegans现用名Hydrophis elegans。
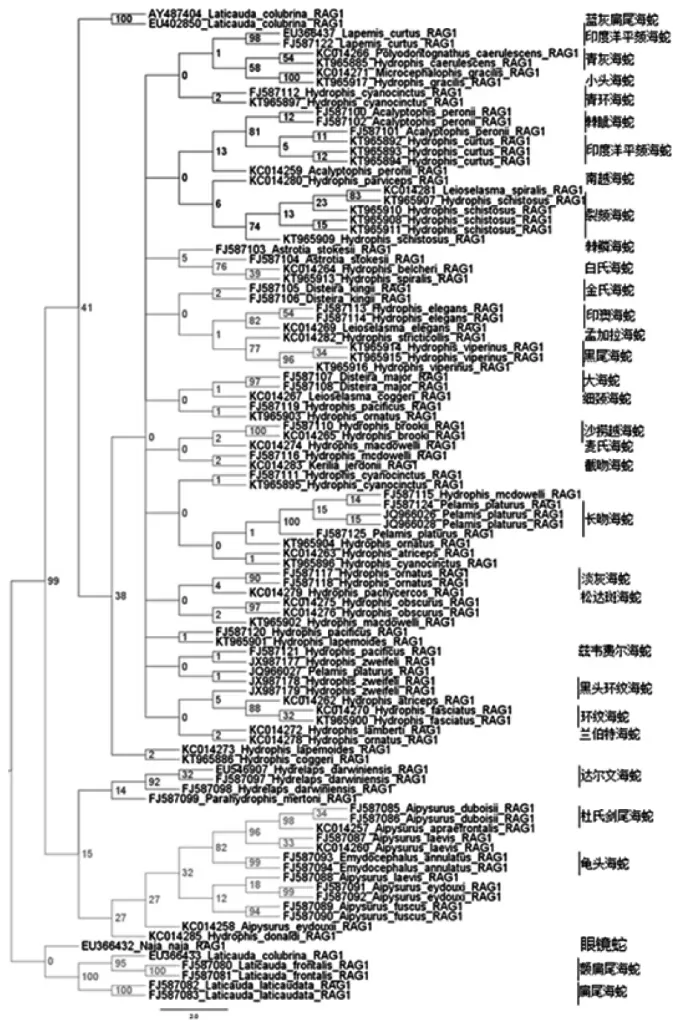
图1 RAG1贝叶斯系统聚类树
3.1 扁尾海蛇属
从树上可以看出,扁尾海蛇属(Laticauda)并未聚为一支。其中,扁尾海蛇(L.laticaudata)和额扁尾海蛇(L.frontalis)亲缘关系非常近,两者与外群眼镜蛇(Najanaja)聚为一支,处于系统发育树的根部。而蓝灰扁尾海蛇(L.Colubrina)形成时间略晚,在剑尾海蛇属大支之后,其它海蛇之前。此分支点的支持率高达99%。
3.2 真海蛇属
绝大多数真海蛇聚为一个大支。其中斯里兰卡海蛇(Hydrophislapemoides)和细颈海蛇(H.coggeri)聚成的小支分化时间相对最早。其它真海蛇形成11个分支。
第一分支中,小头海蛇(H.gracilis)和青灰海蛇(H.Caerulescens)亲缘关系最近,再与印度洋平颏海蛇(H.curtus)聚为一小支。青环海蛇(H.cyanocinctus)位于另一小支。均为中国海域发现的物种,除青灰海蛇外,都曾发现于南海海域。
第二分支中,印度洋平颏海蛇(H.curtus)和棘眦海蛇(H.peronii)交错聚成一小支,印度洋平颏海蛇明显不呈单系。另一小支中,螺旋海蛇(H.spiralis)镶嵌于裂颏海蛇(H.schistosus)之中,再与南越海蛇(H.parviceps)汇聚。
第三分支中,另一条螺旋海蛇(H.spiralis)和白氏海蛇(H.belcheri)亲缘关系最近,再与棘鳞海蛇(H.stokesii )汇聚,但棘鳞海蛇不呈单系。
第四分支中,孟加拉海蛇(H.stricticollis)和黑尾海蛇(H.viperinus)亲缘关系最近,再与印澳海蛇(H.elegans)汇聚,金氏海蛇(H.kingii)相对最原始。
第五分支中,大海蛇(H.major)和细颈海蛇(H.coggeri)亲缘关系近,太平洋海蛇(H.pacificus)和淡灰海蛇(H.ornatus)亲缘关系近。
第六分支中包括:沙捞越海蛇(H.brooki)、麦氏海蛇(H.macdowelli)、截吻海蛇(H.jerdonii)。但麦氏海蛇不呈单系。
第七分支中,青环海蛇(H.cyanocinctus)相对最原始。麦氏海蛇(H.macdowelli)镶嵌于长吻海蛇(H.platurus)之中,两者与另一条淡灰海蛇(H.ornatus)汇聚,再与松达斑海蛇(H.obscurus)汇聚成一个小支。而黑头环纹海蛇(H.atriceps)和另一条青环海蛇(H.cyanocinctus)汇聚于另一小支。
第八分支中,淡灰海蛇(H.ornatus)与厚尾海蛇(H.pachycercos)亲缘关系近,松达斑海蛇(H.obscurus)麦氏海蛇(H.macdowelli)亲缘关系近。
第九分支仅包括一条太平洋海蛇(H.pacificus)和一条斯里兰卡海蛇(H.lapemoides)。
第十分支中,一条长吻海蛇(H.platurus)和一条太平洋海蛇(H.pacificus)镶嵌于兹韦费尔海蛇(H.zweifeli)之中,兹韦费尔海蛇不呈单系。
第十一分支中,环纹海蛇(H.fasciatus)和黑头环纹海蛇(H.atriceps)亲缘关系近,再与兹韦费尔海蛇(H.zweifeli)和太平洋海蛇(H.pacificus)聚为一小支;另一小支包括一条斯里兰卡海蛇(H.lapemoides)和一条细颈海蛇(H.coggeri)。
3.3 其它海蛇
剑尾海蛇属大支明显形成两个分支。其中,剑尾海蛇属(Aipysurus)和龟头海蛇属(Emydocephalus)聚为一支。但龟头海蛇(E.annulatus)嵌于多种剑尾海蛇之中,剑尾海蛇属未成单系。
杜氏剑尾海蛇(A.duboisii)和短鼻剑尾海蛇(A.apraefrontalis)亲缘关系很近;龟头海蛇(E.annulatus)与榄绿剑尾海蛇(A.laevis)亲缘关系很近,龟头海蛇镶嵌于三条榄绿剑尾海蛇之中。以上四种蛇聚为一小支。
而尖尾海蛇(A.eydouxii)和灰刺尾海蛇(A.fuscus)亲缘关系很近,聚为另一小支。真海蛇属中的唐纳德海蛇(Hydrophisdonaldi)也镶嵌其中。
在剑尾海蛇属大支的另一分支中,包括两个单属单种,即达尔文海蛇(Hydrelapsdarwiniensis)和异海蝰(Parahydrophismertoni)。
4 讨论
4.1 分支问题
细颈海蛇(H.coggeri)、印度洋平颏海蛇(H.curtus)、棘鳞海蛇(H.stokesii )、麦氏海蛇(H.macdowelli)、长吻海蛇(H.platurus)、淡灰海蛇(H.ornatus)、青环海蛇(H.cyanocinctus)、松达斑海蛇(H.obscurus)、太平洋海蛇(H.pacificus)、斯里兰卡海蛇(H.lapemoides)、兹韦费尔海蛇(H.zweifeli)、黑头环纹海蛇(H.atriceps)和榄绿剑尾海蛇(A.laevis),共13个物种不呈单系。
运用细胞核基因RAG1基因建树,约1/3的多条序列的蛇类,同一物种并未聚为一支,与线粒体基因建树研究结果相似,但其有争议的物种数比例明显高于线粒体基因[15]。
许多分支支持率并不高,且并未形成二岔分化。可见核基因单独使用,聚类效果不清晰。但考虑到海蛇研究起步晚,物种鉴定尚不成熟,作者暂时建议,核基因建树需要联合线粒体基因,以提高支持率。
4.2 分类问题
从系统树上可以看出,《中国动物志》上记载的5个单属单种,棘眦海蛇(Acalyptophisperonii)、棘鳞海蛇(Astrotiastokesii)、截吻海蛇(Keriliajerdonii)、长吻海蛇(Pelamis platurus)和海蝰(Praescutataviperina),都镶嵌于真海蛇属(Hydrophis)大支之中。这与全球海蛇分布最多的国家澳大利亚的研究一致[16]。作者建议,中国需要重新修订工具书《动物志》,某些属、种的命名应参考国际国内最新的研究成果。
由图可知,斯里兰卡海蛇和细颈海蛇、小头海蛇和青灰海蛇、印度洋平颏海蛇和棘眦海蛇、裂颏海蛇和南越海蛇、白氏海蛇与棘鳞海蛇、孟加拉海蛇和黑尾海蛇、印澳海蛇和金氏海蛇、沙捞越海蛇和截吻海蛇、淡灰海蛇与厚尾海蛇,以及杜氏剑尾海蛇和短鼻剑尾海蛇、尖尾海蛇和灰刺尾海蛇、额扁尾海蛇和扁尾海蛇,都有着较近的亲缘关系。
4.3 分布问题
同属蛇类的亲缘关系远近,往往与地域远近相关[17,18]。但海蛇的地域迁徙路线阻碍相对较少,其活动范围普遍大于陆地蛇类。从系统树上可以看出,真海蛇属除第一分支的蛇类在中国海域均有分布;除第第九分支外,其余9个分支,都有1-2和物种在中国海域有记载。
而中国南海海域所产的8个物种中,除黑头海蛇(H.melanocephalus)外,其余7个物种的RAG1基因在NCBI上均有序列。长吻海蛇(H.platurus)位于第七、第十分支,平颏海蛇(H.curtus)位于第一、第二分支;青灰海蛇(H.caerulescens)位于第一分支,青环海蛇(H.cyanocinctus)位于第一、第七分支,环纹海蛇(H.fasciatus)位于第七、第十一分支,小头海蛇(H.gracilis)位于第一分支,淡灰海蛇(H.Ornatus)位于第五、第七、第八分支。可见,即使同属,南海的海蛇在系统树上并未聚集。
5 结论
RAG1基因在NCBI上包括的物种多,可以运用于分子系统学建树,但建议与线粒体基因联合建树。
本研究与国际研究一致,5个单属单种(棘眦海蛇、棘鳞海蛇、截吻海蛇、长吻海蛇和海蝰)的分类地位应重新界定,建议更新《中国动物志》。
据目前的研究来看,同属海蛇的分布区域,与亲缘关系的远近,没有明显的相关性。
