立足实验情境 发展核心素养
——以“难溶电解质的溶解平衡”为例
2022-01-12广东省中山市第二中学528429林增辉
广东省中山市第二中学(528429) 林增辉
1 教学情境的概述
合理的情境化教学,能有效地调动学生的学习兴趣和积极性,因此,教学情境的创设倍受关注,成为了教学的重要组成部分,但教学情境的引入,在丰富课堂教学的同时,也引发了大家的思考。有学者通过剖析多节化学优质课,从“构成”“功能”和“过程特征”3个维度对教学情境进行分析,指出应围绕教学与评价目标、聚焦学科核心素养等创设教学情境。学者们在课例分析的基础上,指出了教学情境应用中存在的问题,提出了创设教学情境应该遵循的基本原则,使教学情境的创设越来越有针对性和技术性。
《普通高中化学课程标准(2017年版)》明确提出:倡导真实问题情境的创设,开展以化学实验为主的多种探究活动。课标明确倡导创设教学情境,这既是对教学情境研究的重视,也是对教学情境功能的期许。但值得一提的是,因为课程标准中出现“真实”字样,在日常教学中,很多教师把“真实问题情境”理解为“生活情境”,认为只有生活中的问题,才是“真实情境”,才能培养学生的探究能力,忽视了“开展以化学实验为主的多种探究活动”。笔者认为,生活情境有它的优点,能快速调动学生的生活经验,增强课堂的趣味性。能让学生快速进入课堂的角色;但很多生活情境,看似简单,实则包含了很复杂的内容,学生很难在课堂上用有限的化学知识进行分析,自然也难以达到教学的目的。而实验情境,则能让学生利用观察实验现象、收集实验数据,结合化学理论知识进行推理学习,达到深刻理解化学过程的目的。因此,富有探究价值的化学实验情境,无论是用于学科知识的关联、学科问题的揭示,还是培养学生的高阶思维能力,都能发挥积极的作用。笔者以“难溶电解质的溶解平衡”为例,立足于实验情境展开教学,成效卓著。
2 基于实验情境的教学案例
2.1 基于教学情境视角的文献分析
“难溶电解质的溶解平衡”是一个应用性很强的化学现象,在日常生活和工业生产中很容易找到与之有联系的内容,很多教师的教学设计都呈现了这一特点。教师选择了生活中出现的一些化学现象,筛选出学生比较熟悉的内容,辅以合适的教学问题,设计成富含学科意义的情境,给予了学生们开阔的视野和积极的启发。由于生活情境能让学生快速进入课堂角色,在本节课中,笔者以“纯净水对人体骨质的影响”为情境教学内容。为了让学生能更真切地感受难溶物的溶解平衡现象,笔者创设了一系列的实验情境,在实验情境中探索难溶物的溶解平衡原理。
2.2 教学内容与学情分析
“难溶电解质的溶解平衡”是人教版化学选修4第3章第4节的内容,这一节主要讲授的内容是溶解平衡的概念、平衡移动的影响因素和溶解平衡的应用。在此之前,学生已经学习了离子反应、难溶电解质的概念,也学习了化学平衡、电离平衡和水解平衡等基本理论,因此,本节课的关键在于怎样把“难溶电解质”和“溶解平衡”进行有机融合,落实溶解平衡的基本概念,突破沉淀的生成、溶解和转化等实际的应用问题,建立基于溶度积的定量分析模型。此外,笔者还注意到了一些学生认知的薄弱点,例如对于难溶的物质,学生往往会认为是绝对不溶的,缺乏“相对性”的意识。又如在判断平衡移动的方向时,学生还不善于利用平衡常数进行定量的分析,习惯于简单的定性判断,思维方法不够丰富。这些也将是课堂教学需要解决的基本问题。
2.3 教学目标
(1)通过观察实验现象,应用化学平衡理论理解、描述难溶电解质的溶解平衡现象。
(2)掌握溶度积常数,并能利用浓度商、溶度积常数进行简单地计算。
(3)运用定量计算,理解淀沉生成、溶解和转移的本质,认识沉淀溶解平衡在生活、生产中的作用。
2.4 教学环节设计
2.4.1 环节一:情境引入、宏观辨识
问题讨论:长期喝纯净水,对人的骨骼有什么影响吗?
设计说明:利用生活常识引发疑问,为什么骨骼中难溶性的钙盐会被溶解?
2.4.2 环节二:宏观辨识与微观探析
实验1:向盛有3 mL 0.1 mol/L NaCl溶液的试管(试管①)中滴加5~6滴0.1 mol/L AgNO3溶液。
提问:请问AgCl浊液中是否含有Ag+?
设计说明:氯化钠过量,可以保证Ag+充分反应,在学生的经验认识中,AgCl是不溶的,浊液中没有Ag+。
实验2:从试管①中取1 mL上层澄清溶液于试管②中,分别往两支试管中逐滴加入饱和Na2S溶液(注:如能离心分离效果更好)。
设计说明:试管①②均生成黑色沉淀,说明清液中含有Ag+;试管①中原来的白色淀沉也转变成黑色沉淀。这些现象,有力地冲击学生的经验认知,让学生明白,难溶盐也是能溶解的。
微观探析:AgCl浊液中存在Ag+,符合化学平衡“没有完全反应”的特点,当加入S2-,Ag+与S2-生成Ag2S(s),而继续加入S2-,白色沉淀逐渐转化为黑色Ag2S(s),可推断AgCl(s)发生溶解,生成了Ag2S(s),难溶电解质既存在溶解平衡的现象,也可以发生转化。
2.4.3 环节三:定量推理与模型认知
问题讨论:为什么加入S2-,AgCl(s)会溶解,而Ag2S(s)会生成呢?如何解释呢?
设计说明:创设疑问,为引入溶度积常数作铺垫。
模型建立:①浓度商Qc>Ksp,溶液过饱和,生成沉淀;②浓度商Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态;③浓度商Qc 2.4.4 环节四:应用模型、深化理解 沉淀反应应用一:沉淀的生成 经过近似计算,在常温下,当c(OH-)约为10-11mol/L时,也就是pH约为3时,Fe3+几乎完全沉淀。而当Cu2+完全沉淀时,c(S2-)仅为10-15mol/L的数量级。通过Ksp与Qc的计算,让学生从定量的角度,了解在生活生产中,如何控制条件,达到沉淀离子的目的。 沉淀反应应用二:沉淀的溶解 微观探析碳酸钙溶于盐酸的原理: 设计说明:在学生的认知中,CaCO3与盐酸的反应,只是一个静态的反应方程式,学生并不理解其微观的反应过程。分析反应过程,让学生认识到这是一个包含溶解平衡、弱电解质电离平衡的多平衡体系。 问题迁移:水解呈酸性的NH4Cl能否溶解碱性难溶物Mg(OH)2和Fe(OH)3? 实验3:用小试管取2 mL 0.1 mol/L的MgCl2溶液,滴加5~6滴0.1 mol/L的NaOH溶液,溶液变浑浊。 问题讨论:往上述试管中滴加0.1 mol/L的NH4Cl溶液,沉淀能否溶解? 实验4:往Mg(OH)2悬浊液中滴加0.1 mol/L的NH4Cl溶液,白色浑浊消失。 问题讨论:NH4Cl溶液能否溶解Fe(OH)3沉淀? 实验5:往Fe(OH)3悬浊液中滴加0.1 mol/L的NH4Cl溶液,红褐色沉淀没有溶解。 定量分析:用pH试纸测定0.1 mol/L的NH4Cl溶液的pH约5~6,而在前面已经近似计算过,当pH约等于3时,Fe3+已经几乎沉淀完全,因此,在pH约5~6的区间内,Fe(OH)3沉淀不会溶解。而利用Mg(OH)2的Ksp(1.8×10-11)进行近似计算,当溶液中的c(Mg2+)=0.1 mol/L时,c(OH-)要达到10-5mol/L的数量级才会产生沉淀,即pH要达到9以上,低于9则可促进沉淀的溶解。 设计说明:对于Mg(OH)2和Fe(OH)3这两种弱碱,如果没有利用Ksp进行计算,学生无法体会两者之间的差异,容易产生错误的认识,通过实验探究和定量分析,让学生进一步理解物质性质的一般性和特殊性。 沉淀反应应用三:沉淀的转化 (1)由环节二的实验可知,溶度积小的沉淀可转化为溶度积更小的沉淀。 (2)工业应用。用Na2CO3将锅炉上难溶于酸的CaSO4转化成易溶于酸的CaCO3[Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6]。 设计说明:将实验室的结论推广应用于工业生产,是化学学科的一大特色,学以致用,能极大程度地激发学生学习化学的兴趣。同时,也可让学生在实践中,不断地检验、推理论证理论模型,使化学理论和实践相互促进。 创设实验情境,基于实验现象分析问题,是进行知识论证的有力手段。例如“取AgCl浊液的上层清液与S2-反应”这一实验,有力地冲击了学生的经验认识,也成为了本节课的突破口。因此,通过创设实验情境,并基于实验情境,分析实验的宏观现象,引导学生从微观角度进行推理论证,理解反应的本质,能有效地促进学生化学学科思维的发展。 化学是一门以实验为基础的科学,实验的重要性众所周知,但在开展实验教学时,应明确实验是为教学服务的,而不是教学为实验服务的。实验是探究、推理论证的途径,在必要的时候,可适当增加实验,以提高教学的有效性。在本案例的环节四中,关于沉淀的溶解,笔者设计了氯化铵溶液分别与Mg(OH)2沉淀、Fe(OH)3沉淀反应的实验,在表面上看,两者似乎都可以反应,但实验事实证明,只有Mg(OH)2沉淀能与氯化铵溶液反应。这样的设计不仅能让学生深刻体会物质性质的一般性和特殊性,也能让学生认识到化学实验的重要性。因此,通过实验与分析,能有效地突破本节课的重点和难点。 课堂是发展学生学科核心素养的主阵地,但归根结底是要依靠学科知识进行落实。因此,教师首先必须明确每节课所能承载的素养功能,并有计划地融入教学设计,最大程度地促进教学目标的达成。在本案例中,笔者从宏观、微观、定量和模型四个层次,分别融入了宏观辨识与微观探析、科学探究、证据推理与模型认知等核心素养目标,并以实验情境为载体,促进学生核心素养的发展。


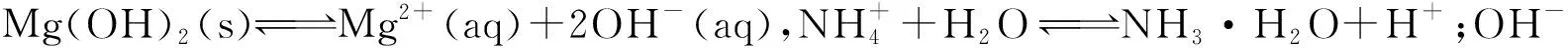
3 结语
3.1 立足实验教学,发展学科思维
3.2 整合教学素材,突破重点难点
3.3 发展学科素养,达成教学目标
