脑深部电刺激术治疗毁损术后帕金森病的疗效
2022-01-10邵钰阳熊文平张修民张继波陈劲草
杨 鑫 邵钰阳 聂 盼 付 锴 熊文平 张修民 柳 雯 张继波 陈劲草 张 捷
帕金森病(Parkinson disease,PD)是中老年人常见的神经系统变性疾病[1],主要由中脑黑质多巴胺能神经元变性死亡、黑质-纹状体中多巴胺减少所致,病因尚未完全阐明[2],临床主要表现为震颤、僵硬、运动迟缓和姿势步态异常。左旋多巴是改善PD 运动症状最有效的药物,但随着疾病的进展,疗效会逐渐减退,并出现症状波动或异动症等,严重影响病人的生活质量。
手术是中晚期PD 的重要治疗手段[3],方法主要有神经核团毁损术和脑深部电刺激术(deep brain stimulation,DBS)。苍白球内侧部(globus pallidus internu,GPi)毁损术和丘脑毁损术等能明显改善PD的震颤、僵硬等症状,但随着疾病进展,部分病人可因毁损灶对侧肢体(毁损侧)症状复发或加重,或非毁损灶对侧肢体(非毁损侧)出现新症状而需接受进一步治疗[3]。双侧丘脑腹外侧核毁损术后语言和认知功能障碍发生率可达20%[4],双侧GPi毁损术后并发症发生率可达17%[4,5]。
与神经核团毁损术相比,DBS 具有不破坏脑组织、术后可调控性等优势,已成为目前治疗PD 的主要手术方式[4]。丘脑底核(subthalamic nucleus,STN)DBS可改善PD核心运动症状,包括震颤、僵硬、运动迟缓和姿势步态异常,明显改善中晚期PD的生活质量。本文探讨既往接受过毁损术的PD病人行STNDBS治疗的有效性和安全性。
1 资料与方法
1.1 病例选择标准 纳入标准:①既往PD 诊断明确且经神经核团毁损术治疗;②神经核团毁损术治疗后毁损侧震颤和/或僵直症状复发或加重,非毁损侧出现新的症状,H-Y分期大于2.5;③年龄以<75岁为宜;④排除存在认知功能障碍无法配合手术、合并严重脑萎缩或恶性肿瘤、身体条件较差或伴凝血功能障碍,以及家属拒绝手术的病人。
1.2 研究对象2013年1月至2021年3月收治符合标准的PD 共33 例,其中男17 例,女16 例;年龄49~75岁,平均62.30 岁;病程5~27 年,平均12.85 年;26 例接受双侧DBS,7 例接受单侧DBS;毁损术与DBS 间隔1~12 年,平均6.45 年;曾行一侧丘脑腹中间核(Vim)毁损术24 例,一侧GPi 毁损术4 例,双侧Vim毁损术4 例,一侧GPi 毁损术和对侧Vim 毁损术1例。DBS 前,H-Y 分期中位数3 个月(3~4 个月),统一帕金森病量表(Unified Parkinson Disease Rating Scale,UPDRS)运动功能(UPDRS Ⅲ)评分中位数41分(29~56 分)、生活能力(UPDRS Ⅱ)评分中位数13分(11~20 分),简明精神量表(Mini-mental State Examination,MMSE)评分中位数28分(26~29分)。1.3 手术方法 在局麻下安装Leksell-G 型立体定向头架,行3.0T MRI扫描,包括T1全脑(层厚1 mm无间距)及T2轴位丘脑薄层(层厚2 mm 无间距),扫描基线与定位框架平行。将MRI数据导入SurgPlan手术计划系统计算靶点坐标、入颅点及最佳手术路径。采用直接定位法确定STN 坐标[6],即STN 的中后1/3交界处,并参照红核定位法,即轴位红核最大层面、双侧红核前缘切线与丘脑底核相交处。在局麻下行电极植入,行微电极记录(microelectrode recording,MER)。微电极到达预定靶点后,进行宏刺激以观察症状改善情况及有无副反应,然后植入治疗电极并再次行测试刺激,有副反应时调整电极位置,直至效果满意。全身麻醉下将延长导线及可植入式脉冲发生器植入胸前锁骨下皮下。术后1 d复查CT了解有无出血等,术后1周复查MRI了解电极位置,术后7~10 d拆线出院,术后4周开机刺激。
1.4 观察指标 术后随访6~99个月。①安全性:观察术中是否出现言语障碍、眼球活动障碍、肢体运动异常等,麻醉复苏后观察肢体活动情况、有无颅内出血、梗死或癫痫发作等,随访期间有无伤口感染、死亡或硬件故障。②疗效:术前、术后6 个月采用UPDRS Ⅲ评分、UPDRS Ⅱ评分、H-Y 分期、MMSE 评分和左旋多巴等效日剂量(levodopa equivalent daily dose,LEDD)评估疗效以及用药情况。③程控参数:记录术后6个月刺激频率、脉宽、电压、阻抗,并计算刺激能量。
1.5 统计学方法 采用SPSS 20.0软件处理;计量资料以中位数及其四分位间距表示,采用Wilcoxon 符号秩检验;检验水准α=0.05。
2 结果
2.1 治疗安全性 术中均未出现言语障碍、眼球活动障碍、偏瘫等;术后1 d复查头部CT检查未见颅内出血或梗死,无癫痫发作病例。术后无感染及死亡病例,无硬件故障。5 例因电池耗竭行脉冲发生器置换术。
2.2 疗效分析 术后刺激器开、未服药状态下,UPDRS Ⅲ评分、UPDRS Ⅱ评分、H-Y 分期、LEDD 均较术前明显降低(P<0.05,表1),而MMSE 评分较术前无明显变化(P>0.05,表1)。

表1 本文33例PD病人DBS治疗6个月的疗效
开机后6个月,和非毁损侧相比,毁损侧肢体震颤评分改善率明显增高(P<0.05,表2),但僵硬评分改善率、运动迟缓评分改善率均无明显变化(P>0.05,表2)。

表2 本文33 例PD 病人DBS 后6 个月毁损侧与非毁损侧运动症状改善情况(%)
2.3 程控参数分析 开机6个月,和非毁损侧相比,毁损侧刺激电压和刺激能量明显降低(P<0.05,表3),但刺激频率、脉宽和阻抗无明显变化(P>0.05,表3)。
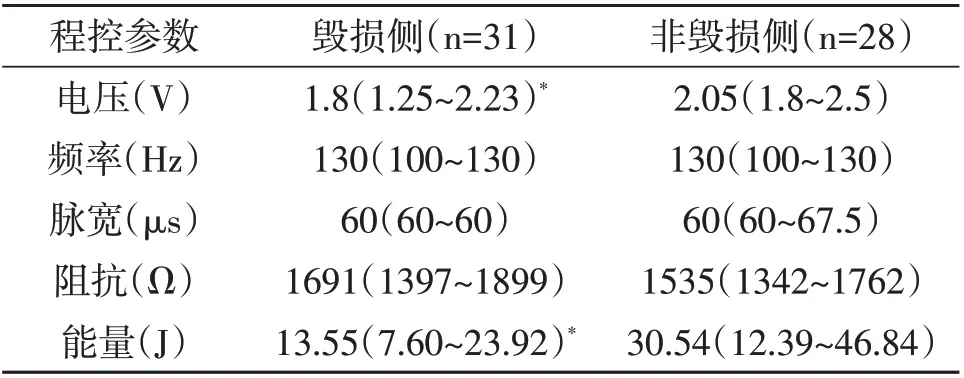
表3 本文33例PD病人DBS后6个月程控参数情况
3 讨论
神经核团毁损术常用的靶点包括GPi 和Vim。GPi 毁损术对静止性震颤、僵硬及运动迟缓等PD 的运动症状有效,尤其对左旋多巴引起的异动症改善明显,但对震颤的控制不如Vim毁损术[7]。Vim毁损术对震颤症状控制较好,对僵硬症状部分有效,但对运动迟缓及姿势平衡症状无明显改善[8,9]。随着时间的推移、病情进展,毁损侧肢体会出现僵硬、运动迟缓加重或/和非毁损侧肢体出现新的症状。双侧毁损术后,认知功能下降、构音障碍和吞咽障碍等并发症的风险高[7]。对于既往接受过毁损术的PD 病人,毁损侧肢体症状复发或加重,或非毁损侧肢体出现新的症状时,应该采用可逆性、非破坏的DBS。
DBS 治 疗PD 常 用 的 靶 点 有STN 和GPi,STNDBS 和GPi-DBS 对PD 运动症状的控制均具有良好的疗效,前者的优点在于术后可以减少服用量,但有出现刺激诱发异动症的可能;后者的优点在于对异动症、步态障碍和中轴症状明显的病人,具有较好的疗效,并且适合认知功能受损的病人,但术后服药量一般不能减少[10]。本文病例均没有异动症,因而选择STN-DBS。
靶点定位时,我们全部采用MER验证STN的位置,电信号长度均大于4 mm,与未接受过毁损术的PD 病人相同[11],术后MRI 显示电极均位于STN 的预定位置。所以,毁损术后行DBS 时,MER 完全可以满足术中验证靶点的需要[11]。本文结果显示,既往接受过脑深部核团毁损术的PD 病人,STN-DBS 后未见明显并发症,病人认知功能无明显下降,表明手术是安全的;开机6个月,病人的症状及日常生活能力明显改善,左旋多巴等药物的服药量明显减少,表明毁损术后STN-DBS治疗的有效性。另外,我们开机6个月,与非毁损侧相比,毁损侧震颤评分明显改善,但是僵硬评分和运动迟缓评分无明显变化。
在开机6 个月的程控参数中,毁损侧刺激电压和刺激能量较非毁损侧明显降低(P<0.05)。这与本文病例毁损侧肢体的症状较轻相符合。研究表明,电极阻抗与电极所处的解剖位置相关,可以反映电极所处位置的细胞组成成分[12]。本文结果显示,毁损侧和非毁损侧的电极阻抗没有显著差异(P>0.05),且术后1 周1.5T MRI 扫描显示电极均位于STN。这说明电极所处的STN 的细胞组成成分相似,这也与我们观察到开机后疗效无显著差异相符。
综上所述,PD 病人GPi 或Vim 毁损术后复发或出现新症状,行STN-DBS 是安全、有效的,毁损侧STN-DBS后电刺激所需能量及电压更低。
