通过测序与预测分析靶向奶牛乳腺κ-酪蛋白的miRNA
2022-01-10李文清王潇阳李晨婉张国只赵亚宁张宏禄李万利
李文清 王潇阳 李晨婉 张国只 赵亚宁 张宏禄 李万利
(1.河南农业大学生命科学学院,郑州 450002;2.河南省农业科学院畜牧兽医研究所,郑州 450002)
酪蛋白占牛奶总蛋白的80%,是新生儿氨基酸和磷酸钙的主要来源。牛奶中有4种类型的酪蛋白:αS1、αS2、β和κ。众所周知,κ-酪蛋白(κ-casein,CSN3)变异影响牛奶的工业生产特性,如乳浊状态[1]。由于糖基化形式的存在,CSN3形成一个高度水合的聚电解质层,具有空间和静电稳定性[2]。因此,CSN3是维持牛奶不透明状态的重要物质。
进化过程中,编码酪蛋白的核苷酸序列保守性很差,在所有的酪蛋白中,CSN3的核苷酸序列相对最保守[3]。目前,奶牛CSN3研究主要集中在CSN3基因多态性与乳产量或乳成分之间的关系上[4-5]。但是,对于奶牛CSN3基因表达调控方面的研究比较少,而CSN3的基因调控与奶牛乳产量或乳成分也密切相关。作为一类小的非编码RNA,miRNA可以在转录后调节基因表达,影响多种生物学过程[6],并且在奶牛的不同泌乳期,miRNA表达水平不同[7-8]。然而,还没有关于miRNA和CSN3基因之间调节的报道。因此,本研究的目的是寻找调节奶牛CSN3表达的miRNA,以期为miRNA的功能研究提供理论依据。
1 材料与方法
1.1 奶样采集
采集中国荷斯坦奶牛3个泌乳阶段的牛奶样品,分别以产后60 d左右、产后120 d左右、产后240 d左右代表不同的泌乳阶段。同一泌乳阶段要求奶牛泌乳时间前后相差不超过10 d。具体方法为:选择15头奶牛,每个泌乳阶段选择5头,每头牛用50 mL离心管采集6管牛奶,当天将样品四周冰袋覆盖下运输至实验室。一部分样品用于检测牛奶中CSN3浓度;另一部分样品放入离心机离心,用于从牛奶中分离体细胞(somatic cell,SC)。分离方法:4 ℃、600×g离心10 min,弃去上层物质,沉淀即为体细胞。将分离出的体细胞加1 mL Trizol试剂,冻存于-80 ℃冰箱中,用于后续基因表达的研究。
1.2 酶联免疫吸附测定(ELISA)检测
采用牛CSN3的ELISA试剂盒(货号:ml059486,上海酶联生物科技有限公司)测定牛乳中CSN3浓度,方法参照试剂盒说明书。简述如下:无菌管收集50 mL牛奶作为单个样本,-80 ℃贮存备用。样本在4 ℃、1 000×g下离心20 min,去除最上面的脂肪层。上清液用0.01 mol/L、pH=7.4的磷酸盐缓冲液(PBS)稀释10倍,之后进行ELISA试验。CSN3的ELISA试剂盒内含1套标准品,在450 nm处用光谱仪测定标准品光密度(OD)值,可以得到OD值与CSN3浓度的标准曲线。样品中CSN3浓度可以通过测定OD值与标准曲线比较来确定。
1.3 乳腺组织样品
分别于产后60 d、产后120 d和产后240 d对3头健康荷斯坦奶牛的乳腺组织进行了3次活体取样,具体方法参考Li等[9]。简述如下:对采样的乳腺部位进行局部麻醉,用灭菌的活体取样器直接取样,插入深度约为10 cm,1次能取3 g左右的样品,用高压灭菌的手术剪和镊子将样品切割为绿豆大小的小块,放入1 mL冻存管,投入液氮中冻存。对手术部位进行消毒灭菌,缝合伤口,注射抗生素,手术后1周内的牛奶弃去不用。奶牛饲喂全混合日粮,自由饮水。
1.4 小RNA测序和数据加工
乳腺组织RNA提取、小RNA测序和数据处理委托中国联川生物公司开展。Trizol试剂提取RNA后,用生物分析仪2100(Agilent,美国)测定RNA的完整数(RIN)。在Illumina HiSeq 2500平台上构建了3个小RNA文库(每个样本1 μg),用于单端测序(36或50 bp)。原始序列采用ACGT101-miR程序和miRBase 21.0过滤。通过校正计算对数据进行标准化处理,后续分析采用的均为标准化数据。低表达定义为所有样本的拷贝数小于10的miRNA;中表达定义为1个样本的拷贝数大于10,所有样本的拷贝数小于平均值;高表达定义为至少1个样本的拷贝数大于平均值。采用SAS 9.0的卡方检验(2×2)分析基于归一化的差异表达miRNA。
1.5 靶向CSN3的miRNA预测
使用TargetScan 7.2(http://www.targetscan.org/vert_72/)预测靶向CSN3基因的miRNA。
1.6 交集筛选
将2种方法(小RNA测序分析和生物信息学软件预测)交集筛选出miRNA作为下一步的研究对象。在差异表达miRNA中,删除低表达或不在软件预测范围的miRNA。采用RNAhybrid(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid)预测miRNA与CSN3-3’非编码区(3’untranslated region,3’UTR)之间的结合自由能。
1.7 载体构建
利用表1所示的引物,从牛基因组DNA中扩增出CSN3-3’UTR的全长(207 bp)。将PCR产物克隆到psiCHECK-Ⅱ,利用NotI和XhoI限制性酶切位点构建了psiCHECK-Ⅱ-CSN3-3’UTR质粒。
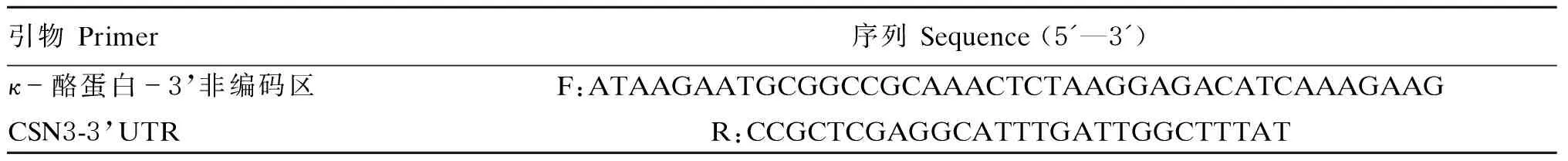
表1 CSN3-3’UTR的引物Table 1 Primers for CSN3-3’UTR
1.8 荧光素酶报告基因分析
293T细胞接种于96孔板中,每孔接种密度为2×104个细胞。采用PmirGLO载体和psiCHECK-Ⅱ载体作为系统控制和测试控制。将4种miRNA模拟物(60 nmol/L)和阴性对照(中国锐博公司)分别与1 μg质粒共转染293T细胞,转染试剂采用2 μL X-tremegene HP (罗氏公司,瑞士)。转染48 h后,用双荧光素酶报告试剂盒(E1910,Promega公司,美国)检测荧光素酶活性。
1.9 CSN3、bta-miR-193b和bta-miR-193a-3p的PCR检测
应用SYBR Prime Script RT-PCR试剂盒(TaKaRa,日本)测定牛奶体细胞中CSN3、bta-miR-193b和bta-miR-193a-3p的相对表达量。甘油醛-3-磷酸脱氢酶(GAPDH)和U6分别作为CSN3和miRNA的内参基因,引物设计见表2。扩增程序:95 ℃ 30 s,然后95 ℃ 5 s,40个循环,60 ℃ 34 s。采用2-ΔΔCt方法计算目的基因相对表达量。

表2 CSN3和miRNA的引物设计Table 2 Primer design for CSN3 and miRNA
1.10 统计分析
采用SPSS 22.0软件对牛奶中CSN3浓度、产奶量以及CSN3和miRNA基因相对表达量进行单因素方差分析;对2组之间相对荧光素酶活性进行t检验。数据显示为平均值±标准误,P<0.05表示差异显著,P<0.01表示差异极显著。使用SigmaPlot 14.0软件绘制图形。
2 结 果
2.1 CSN3浓度
ELISA法测定不同泌乳阶段奶牛分泌的牛奶中CSN3浓度(图1),在不同泌乳期,CSN3浓度差异不显著(P>0.05)。然而,从产后60 d到产后240 d,奶牛产奶量显著下降(P<0.05)(图1)。3个泌乳阶段平均产奶量分别为21.044、15.872、10.326 kg。因此,从产后60 d到产后240 d,牛奶中CSN3蛋白总量呈现降低趋势(CSN3蛋白总量=CSN3浓度×产奶量)。

产奶量的数据显示为5头奶牛的平均值。检测时间分别为产后60 d、产后120 d和产后240 d。The data of milk yield showed an average milk yield of five cows. The determined time was 60th day, 120th day and 240th day after delivery.图1 牛奶中CSN3浓度和产奶量变化Fig.1 Changes in milk CSN3 concentration and milk yield
2.2 差异表达的miRNA
本试验RNA的完整性指标RIN>7.0,样品可以用于后续测序。测序原始数据已存入美国国家生物技术信息中心(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA589107)。本试验比较了不同泌乳期构建的3个miRNA文库,通过卡方检验(P≤0.05)和倍数改变(|log2(倍数改变)|>1)筛选差异表达的miRNA。3个文库中共检测到1 949个miRNA,其中有390个差异表达。在差异表达的miRNA中,有11个低表达的miRNA被删除。其中,中、高表达miRNA共379个,仅仅93个高表达的miRNA。不考虑miRNA前体和染色体位置的不同,只有77个miRNA呈现高表达,且在不同泌乳阶段差异显著(P<0.05),见表3。

表3 奶牛乳腺组织3个泌乳阶段均呈现高表达且差异显著的miRNATable 3 Highly and differentially expressed miRNA in three lactation stages of cow mammary gland (n=77)
2.3 TargetScan预测
根据TargetScan预测,CSN3-3’UTR上有2个保守位点和21个保守性差的miRNA结合位点(表4)。

表4 TargetScan预测的靶向CSN3的miRNATable 4 Predicted miRNA targeting CSN3 with TargetScan

续表4保守位点Conserved sites非翻译区中的位置Position in the UTR/bp保守性差的位点Poorly conserved sites非翻译区中的位置Position in the UTR/bpbta-miR-193b74~80bta-miR-193a-3p74~80bta-miR-236497~103bta-miR-2317113~119bta-miR-2329-3p113~119bta-miR-2284j152~158bta-miR-2284n152~158bta-miR-2284c152~158bta-miR-2284ab152~158bta-miR-2284m152~158bta-miR-2284d152~158bta-miR-2284v152~158bta-miR-2284k152~158
2.4 交集
删除低表达的miRNA后,只有4个中表达的miRNA保留在预测范围内(表5)。它们是bta-miR-33a、bta-miR-2284ab、bta-miR-193a-3p、bta-miR-193b。这4个miRNA与CSN3-3’UTR结合的最小自由能分别为-16.1、-18.6、-21.8和-20.9 kcal/mol(1 kcal/mol≈4.184 kJ/mol)(表6)。

表5 交集中4个miRNA的测序数据分析Table 5 Sequencing data analysis of four miRNA in intersection
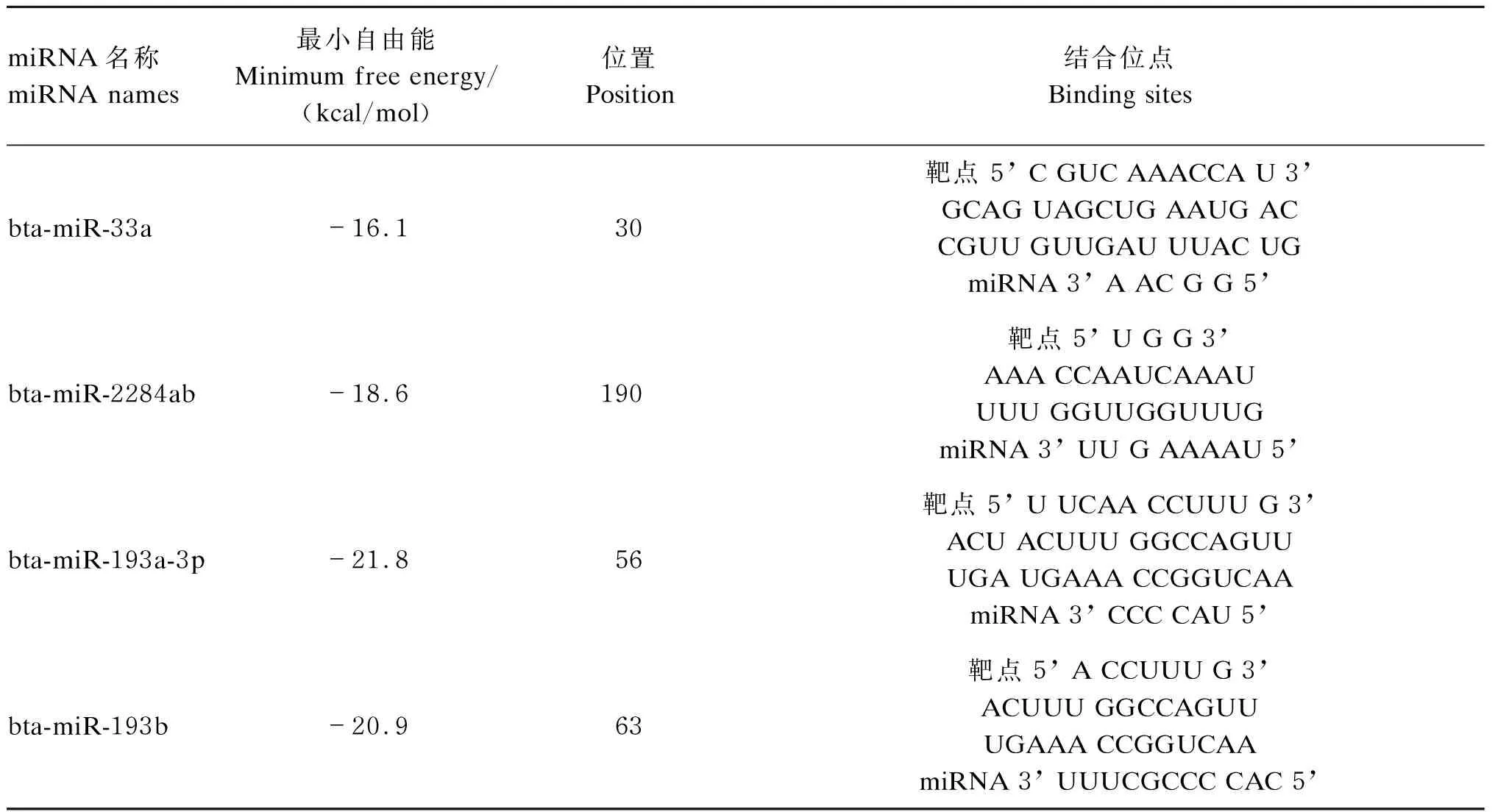
表6 RNAhybrid预测miRNA与CSN3-3’UTR的结合情况Table 6 Prediction for miRNA binding CSN3-3’UTR with RNAhybrid
2.5 bta-miR-193b和bta-miR-193a-3p靶向CSN3-3’UTR的双荧光验证
bta-miR-33a和bta-miR-2284ab模拟物(mimic)与阴性对照模拟物(mimic NC)相比,双荧光素酶活性无显著性差异(P>0.05)(图2-a、图2-b)。当bta-miR-193b和bta-miR-193a-3p模拟物被转染后,双荧光素酶活性极显著下降(P<0.01)(图2-c、图2-d)。与阴性对照模拟物相比,bta-miR-193b和bta-miR-193a-3p模拟物导致萤火虫荧光素酶/肾素酶的比值分别下降28%和26%。综上所述,这些结果提示bta-miR-193b和bta-miR-193a-3p可直接结合CSN3-3’UTR,从而调节CSN3的表达。

mimic NC:阴性对照模拟物 negative control mimic。P<0.01:差异极显著 significant difference。图2 4种miRNA相对荧光素酶活性的变化Fig.2 Change of relative luciferase activity for four miRNA
2.6 CSN3、bta-miR-193b和bta-miR-193a-3p的变化趋势
为了验证CSN3与bta-miR-193家族之间的关系,对牛奶体细胞样品中这些基因的相对表达量进行了检测。牛奶体细胞CSN3的相对表达量从产后60 d到产后120 d极显著下降(P<0.01)(图3)。相反,bta-miR-193b和bta-miR-193a-3p在产后60 d至产后120 d呈上升趋势,且bta-miR-193b变化产生统计学上的显著差异(P<0.01)(图3)。

P<0.01:差异极显著 significant difference;P>0.05:差异不显著 no significant difference。图3 不同时期牛奶体细胞中3个基因(CSN3、bta-miR-193b、bta-miR-193a-3p)的相对表达趋势Fig.3 Relative expression trends of three genes (CSN3, bta-miR-193b and bta-miR-193a-3p) in milk somatic cells at different stages
3 讨 论
作为小的非编码RNA分子,miRNA可以结合靶基因的3’UTR来抑制靶基因的表达[10]。每个miRNA可以调节上百个基因,每个基因可以受到上百个miRNA的调节[11]。牛奶中CSN3浓度在3个泌乳期间没有明显变化,但产奶量急剧下降,这意味着乳腺表达的CSN3的蛋白总量下降了。为了从miRNA角度探索CSN3表达的调控机制,采用TargetScan预测搜索靶向牛CSN3的miRNA。和其他预测工具一样,TargetScan预测也选择进化上保守的miRNA结合位点。假阳性是预测软件中常见的问题。因此,本试验将小RNA测序分析与软件预测相结合。为了获得尽可能多的候选miRNA,只放弃在3个阶段没有显著差异或者低表达水平的miRNA。软件预测范围内的大多数miRNA表达水平较低。通过这种方法,本试验筛选到4个可能靶向CSN3的miRNA。
在这项研究中,使用基因的3’UTR来搜索miRNA,这比使用miRNA搜索靶基因在方法上更易操作。研究人员只需构建一个CSN3-3’UTR的载体,逐个测试不同的miRNA。根据双荧光素酶活性测定结果,只有bta-miR-193b和bta-miR-193a-3p引起相对荧光素酶活性明显下降。而bta-miR-33a和bta-miR-2284ab没有这个功能,尽管依据软件预测bta-miR-33a具有保守的结合位点。
最小自由能和小RNA测序在避免预测的假阳性方面具有积极作用。与CSN3-3’UTR结合时,bta-miR-193b和bta-miR-193a-3p的最小自由能均低于bta-miR-33a和bta-miR-2284ab。自由能越低,结合的可能性就越高。与此同时,依据小RNA测序数据结果,bta-miR-193b的表达在3个泌乳阶段持续增加。这种现象与miRNA对靶基因的负调节作用相吻合。依据测序数据中bta-miR-33a和bta-miR-2284ab的表达趋势变化,可以将它们从预测的范围内剔除。同时,双荧光素酶试验结果证实了bta-miR-33a和bta-miR-2284ab不能靶向CSN3。
牛奶体细胞的基因表达数据为bta-miR-193b和bta-miR-193a-3p靶向CSN3提供了进一步的依据。关于miR-193家族的资料不多,目前的研究主要集中于miR-193b抑制肿瘤和促进脂肪生成方面[12-13],miR-193a也在很多肿瘤中表现为抑制作用[14]。这2个miRNA在牛上的报道很少,最近的一项研究发现,bta-miR-193b通过靶向乙酰辅酶A合成酶2(ACSS2)来调节牛脂肪细胞的发育[15];bta-miR-193a-3p在牛乳腺上皮细胞(MAC-T)中具有时间表达差异性[16]。但关于miR-193家族调控乳蛋白方面还未见任何报告。寻找调节乳蛋白的miRNA对于研究乳蛋白合成的调节机制至关重要。下一步试验,本课题组将进行bta-miR-193b和bta-miR-193a-3p靶向CSN3的细胞培养水平和活体动物水平验证。
4 结 论
通过小RNA高通量测序、生物信息学预测、结合位点自由能分析、双荧光结合分析、荧光定量分析,表明bta-miR-193b和bta-miR-193a-3p靶向CSN3,但还需进行奶牛乳腺细胞试验和活体动物试验的进一步验证。产后60 d至产后240 d,随着产奶量的下降,我们推测bta-miR-193b和bta-miR-193a-3p在维持牛奶中CSN3浓度稳定方面起关键作用。本试验为后期开展miRNA调控CSN3以及牛奶中CSN3稳定机制的研究指明了方向。
