胃肠胰神经内分泌肿瘤组织lncRNA HNF1A-AS1表达变化及其与患者预后的关系
2022-01-10张帮柱蔺原曾艳
张帮柱,蔺原,曾艳
攀枝花学院附属医院普外科,四川攀枝花617000
神经内分泌肿瘤(NENs)是一类起源于干细胞且具有神经内分泌标志物的、能够产生生物活性胺和(或)多肽激素的肿瘤,胃肠胰神经内分泌肿瘤(GEP-NENs)是其最常见的类型[1-2]。近年来,GEP-NENs的发病率迅速上升,其发病率在消化系统肿瘤中仅次于结肠癌[3]。目前,GEP-NENs发病的确切分子机制尚不完全清楚,手术切除仍然是其最主要的治疗手段,但术后复发或转移概率较高,患者预后较差。长链非编码RNA(lncRNA)是一类转录本长度超过200 nt、不具备蛋白编码功能的RNA分子,但可在表观遗传调控、转录调控以及转录后调控等层面上调控基因的表达,从而参与调控多种生物学过程[4-5]。肝细胞核因子1α-反义链1(HNF1A-AS1)是近年发现的一种反义lncRNA。有研究报道,lncRNA HNF1A-AS1能够参与肿瘤细胞的增殖、侵袭和迁移,与胃癌、胶质瘤、乳腺癌等恶性肿瘤的发生、发展密切相关[6-8]。但lncRNA HNF1A-AS1在GEP-NENs中的作用尚不明确。本研究观察了GEP-NENs组织lncRNA HNF1A-AS1表达变化,并分析其表达与患者预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2014年1月—2017年12月攀枝花学院附属医院收治的GEP-NENs患者85例。纳入标准:①经术后组织病理学检查明确GEP-NENs诊断;②初诊;③接受根治性或姑息性手术治疗,术前未接受任何抗肿瘤治疗;④临床病理资料和术后随访资料完整。排除标准:①合并其他部位恶性肿瘤者;②合并心、肝、肾等重要脏器严重功能不全者;③合并全身感染性疾病者;④合并造血系统疾病者。其中,男48例、女37例,年龄45~75(58.1±5.8)岁;肿瘤直径:≥3 cm 64例,<3 cm 21例;肿瘤部位:胃肠道66例,胰腺19例;TNM分期:Ⅰ、Ⅱ期37例,Ⅲ、Ⅳ期48例;浸润深度:T1、T2期32例,T3、T4期53例;有淋巴结转移29例,无淋巴结转移56例。本研究经攀枝花学院附属医院医学伦理委员会批准(审批编号:2021NL-067-04),患者或其家属知情同意并签属知情同意书。
1.2 lncRNA HNF1A-AS1表达检测 取手术切除的GEP-NENs组织及其配对的癌旁组织(距肿瘤组织边缘≥5 cm,并经术后组织病理学检查证实为正常组织),置于-80 ℃冰箱保存。取冻存组织200 mg,剪碎后置于EP管中,采用TRIzol法提取组织总RNA,经琼脂糖凝胶电泳和紫外可见分光光度计鉴定,提取的总RNA完整且浓度和纯度合格。按逆转录试剂盒说明,将总RNA逆转录为cDNA。逆转录条件:42 ℃ 1 h,95 ℃ 5 min。以cDNA为模板,按PCR试剂盒说明进行PCR扩增。引物序列:lncRNA HNF1A-AS1上游引物5′-TCAAGAAATGGTGGCTAT-3′,下游引物5′-GCTCTGAGACTGGCTGAA-3′;GAPDH上游引物5′-GAAGGTGAAGGTCGGAGT-3′,下游引物5′-GAAGATGGTGATGGGATTTC-3′。PCR扩增体系共20 μL:cDNA模板2 μL,上下游引物各1 μL,SYBR Green Master Mix 10 μL,ddH2O 6 μL;反应条件:95 ℃ 30 s,95 ℃ 15 s、62 ℃ 30 s、72 ℃ 20 s共40个循环。PCR反应结束后绘制熔解曲线,收集循环阈值(CT)数。以GAPDH为内参,采用2-ΔΔCT法计算lncRNA HNF1A-AS1相对表达量。实验重复3次,取平均值。
1.3 随访 所有患者出院后通过门诊或电话方式定期随访,随访截至2020年12月,统计患者生存情况,计算3年累积生存率。

2 结果
2.1 GEP-NENs组织与癌旁正常组织lncRNA HNF1A-AS1表达比较 GEP-NENs组织lncRNA HNF1A-AS1相对表达量为0.430±0.181,癌旁正常组织为0.792±0.202。GEP-NENs组织lncRNA HNF1A-AS1相对表达量明显低于癌旁正常组织(t=-12.294,P<0.01)。
2.2 GEP-NENs组织lncRNA HNF1A-AS1表达与患者临床病理特征的关系 见表1。

表1 GEP-NENs组织lncRNA HNF1A-AS1表达与患者临床病理特征的关系
2.3 lncRNA HNF1A-AS1表达与GEP-NENs患者预后的关系 截至2020年12月,共随访5~36(24.26±7.39)个月,死亡32例。以GEP-NENs组织lncRNA HNF1A-AS1相对表达量的均数为截断值,将GEP-NENs患者分为lncRNA HNF1A-AS1高表达者(≥0.430,41例)与lncRNA HNF1A-AS1低表达者(<0.430,44例)。随访期间,lncRNA HNF1A-AS1高表达者死亡10例,3年累积生存率为75.61%(31/41);lncRNA HNF1A-AS1低表达者死亡22例,3年累积生存率为50.00%(22/44)。lncRNA HNF1A-AS1高表达者3年累积生存率明显高于lncRNA HNF1A-AS1低表达者(χ2=10.667,P<0.01)。见图1。
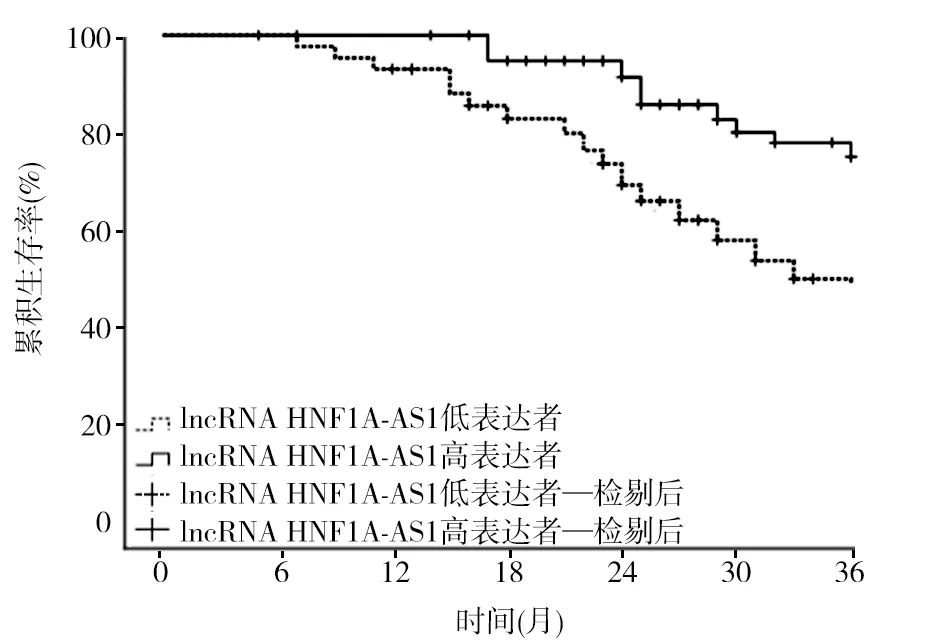
图1 不同lncRNA HNF1A-AS1表达GEP-NENs患者的生存曲线
2.4 GEP-NENs患者预后的影响因素分析 单因素Cox比例风险回归分析显示,年龄、TNM分期、浸润深度、淋巴结转移和lncRNA HNF1A-AS1表达可能与GEP-NENs患者预后不良有关(P均<0.05)。见表2。
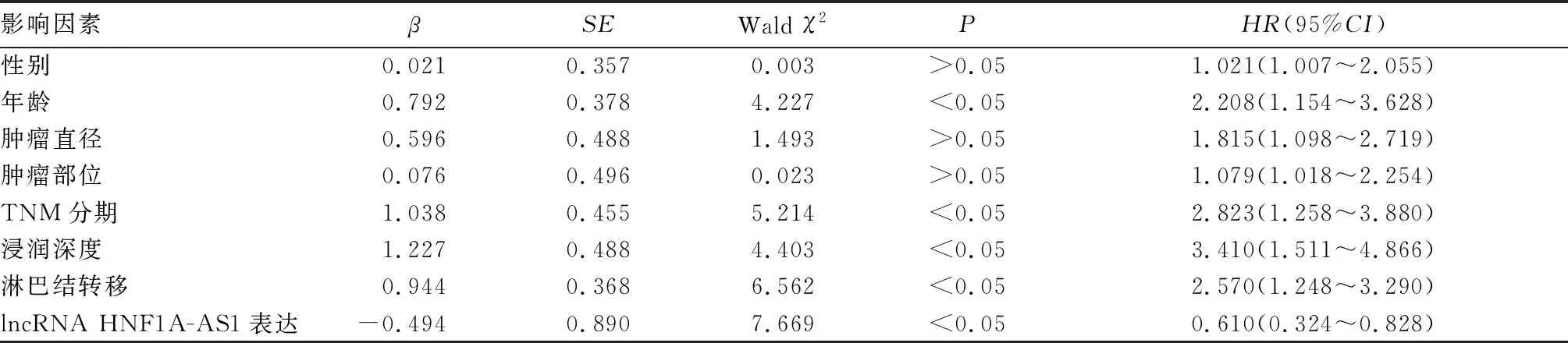
表2 GEP-NENs患者预后不良的单因素Cox比例风险回归分析结果
以GEP-NENs患者预后情况(死亡=1,存活=0)为因变量,以性别(男=1,女=0)、年龄(≥60岁=1,<60岁=0)、肿瘤直径(≥3 cm=1、<3 cm=0)、肿瘤部位(胃肠道=1,胰腺=0)、TNM分期(Ⅲ、Ⅳ期=1,Ⅰ、Ⅱ期=0)、浸润深度(T3、T4期=1,T1、T2期=0)、淋巴结转移(有=1,无=0)、lncRNA HNF1A-AS1表达(连续变量)为自变量,纳入多因素Cox比例风险回归模型。结果发现,TNM分期Ⅲ、Ⅳ期和有淋巴结转移是GEP-NENs患者预后不良的危险因素,而lncRNA HNF1A-AS1高表达是其保护因素(P均<0.05)。见表3。

表3 GEP-NENs患者预后不良的多因素Cox比例风险回归分析结果
3 讨论
NENs是一类起源于神经内分泌细胞的肿瘤。既往认为,NENs是一种发病率低且相对罕见的肿瘤。但随着对NENs研究不断深入和检查技术不断提升,NENs的检出率逐渐升高。GEP-NENs是NENs最常见的类型,占所有NENs的60%以上[1]。目前,GEP-NENs发病的确切分子机制尚不完全清楚,手术切除仍然是其最主要的治疗手段。但由于GEP-NENs具有高度异质性,同一患者可出现多个或多种NENs,术后复发或转移概率较高,预后较差[9]。
lncRNA是一类转录本长度超过200 nt、不具备蛋白编码功能的RNA分子,可通过竞争性结合特定蛋白或miRNA,形成分子海绵效应,在细胞增殖、分化、凋亡等生命活动中发挥重要作用[10-11]。研究表明,人类肿瘤细胞的生物学行为与肿瘤组织异常表达的lncRNA密切相关[4-5]。HNF1A-AS1是lncRNA家族成员之一,是一个长度为2 785个核苷酸的单外显子转录本,定位于人染色体12q24.31。lncRNA HNF1A-AS1最早在食管腺癌的RNA测序分析中被发现,其在食管腺癌组织中高表达,并能够促进食管腺癌侵袭和转移[12]。LIU等[13]研究报道,在胃癌组织中lncRNA HNF1A-AS1表达上调,lncRNA HNF1A-AS1可通过结合miR-30b-3p激活PI3K-AKT信号通路,促进胃癌侵袭、转移以及肿瘤血管生成等。GUO等[14]研究发现,在结肠癌组织中lncRNA HNF1A-AS1表达上调,lncRNA HNF1A-AS1可通过靶向miR-124调控肌球蛋白Ⅵ,促进结肠癌侵袭和转移。但SHI等[15]研究发现,在喉鳞状细胞癌组织中lncRNA HNF1A-AS1表达下调,并在体外研究中证实上调lncRNA HNF1A-AS1表达能够抑制喉鳞状细胞癌细胞增殖、侵袭和迁移。以上研究表明,lncRNA HNF1A-AS1能够参与多种恶性肿瘤的发生、发展。但lncRNA HNF1A-AS1在GEP-NENs中的作用尚不明确。
本研究结果发现,GEP-NENs组织lncRNA HNF1A-AS1相对表达量明显低于癌旁正常组织,并且lncRNA HNF1A-AS1表达与TNM分期、浸润深度、淋巴结转移有关,提示lncRNA HNF1A-AS1表达降低与GEP-NENs恶性进展有关,lncRNA HNF1A-AS1在GEP-NENs中可能发挥抑癌基因作用。进一步研究发现,lncRNA HNF1A-AS1高表达者3年累积生存率明显高于lncRNA HNF1A-AS1低表达者,提示lncRNA HNF1A-AS1表达降低可导致GEP-NENs患者预后不良,其原因与lncRNA HNF1A-AS1表达降低能够促进GEP-NENs恶性进展有关。有研究将lncRNA HNF1A-AS1转染至GEP-NENs细胞系LCC-18、BON-1,发现LCC-18细胞和BON-1细胞的增殖、迁移和上皮间质转化能力显著降低,其机制可能与lncRNA HNF1A-AS1能够靶向下调抑瘤素M表达有关[16-17]。魏亚玲[18]研究发现,lncRNA HNF1A-AS1和抑瘤素M为GEP-NENs组织中的差异表达基因,上调lncRNA HNF1A-AS1能够抑制抑瘤素M表达,进而抑制GEP-NENs细胞侵袭、迁移和上皮间质转化。
本研究结果还发现,即使在排除年龄、TNM分期、浸润深度、淋巴结转移对GEP-NENs患者预后的影响,lncRNA HNF1A-AS1高表达仍然是GEP-NENs患者预后的独立保护因素,提示lncRNA HNF1A-AS1有可能成为评估GEP-NENs患者预后的生物标志物。
综上所述,GEP-NENs组织lncRNA HNF1A-AS1低表达,其表达变化与TNM分期、浸润深度和淋巴结转移有关;lncRNA HNF1A-AS1高表达是GEP-NENs患者预后的保护因素。但lncRNA HNF1A-AS1在GEP-NENs发生、发展中的具体作用机制仍需进一步研究。
