DNMT抑制剂5-AzaDc对结直肠癌肝转移的影响
2022-01-10孙绍伟张焕虎曹金宫庆韩传吉
孙绍伟,张焕虎,曹金,宫庆,韩传吉
山东大学附属威海市立医院胃肠外科,山东威海264200
结直肠癌是消化系统常见的恶性肿瘤,在我国其发病率和病死率分别居恶性肿瘤的第3位和第5位[1-2]。手术切除仍然是目前结直肠癌最主要的治疗手段,但术后转移的风险较高。据报道,50%~60%结直肠癌患者术后发生肝转移[3]。因此,早期发现并控制结直肠癌肝转移就显得尤为重要。近年研究证实,DNA甲基化与肿瘤恶性生物学行为密切相关[4]。与基因突变不同,DNA甲基化是由DNA甲基转移酶(DNMT)催化完成的一种表观遗传学修饰,在促癌基因或抑癌基因的表达调控中具有至关重要的作用[5]。因此,DNMT被认为是恶性肿瘤的一个潜在治疗靶标。VERLAAT等[6]研究发现,DNMT抑制剂在维持肿瘤细胞中DNA甲基化沉默的肿瘤抑制基因重新表达方面具有明显效果。5-氮杂-2′-脱氧胞苷(5-AzaDc),中文名为地西他滨,是一种新型DNMT抑制剂。5-AzaDc能够在DNA复制过程中替代胞嘧啶,竞争性结合DNMT,抑制DNMT活性,从而达到抑制DNA甲基化的作用。目前,5-AzaDc主要作为恶性血液病的治疗药物,用于治疗结直肠癌的报道较少,对结直肠癌肝转移的治疗更是鲜有报道。2020年1月—3月,本研究构建了裸鼠结直肠癌肝转移模型,观察了DNMT抑制剂5-AzaDc对结直肠癌肝转移的影响。现报告如下。
1 材料与方法
1.1 材料 健康雄性BALB/c裸鼠50只,SPF级,6~8周龄,体质量180~240 g,购自长沙市天勤生物技术有限公司,动物许可证号:SCXK(湘)2019-0015。所有裸鼠于屏障系统动物房内独立通风笼具中单笼饲养,自由摄食和饮水。饲养环境:温度(25±3)℃,相对湿度55%~60%,光照12 h明暗交替。实验设计和实施过程符合动物福利和伦理要求。人结直肠癌细胞系HCT116(以下称HCT116细胞),购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。DNMT抑制剂5-AzaDc,纯度≥97%,购自美国Sigma-Aldrich公司。酶标仪,购自上海昂拉仪器有限公司;Accuri C6 Plus流式细胞仪,购自北京赛百奥科技有限公司。DNMT活性检测试剂盒,购自美国Epigentek公司。
1.2 动物分组处理 所有裸鼠适应性喂养1周,按随机数字表法随机分为模型组、对照组以及5-AzaDc低、中、高剂量组,每组10只。模型组和5-AzaDc低、中、高剂量组通过脾脏种植法构建结直肠癌肝转移模型。具体方法:将HCT116细胞接种于含10% FBS的RPMI 1640培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养,以获取足够数量的HCT116细胞;裸鼠用戊巴比妥钠腹腔注射麻醉,常规消毒,选择左背部斜切口进腹暴露脾脏,将HCT116细胞缓慢注入脾脏,待脾脏被膜肿胀、变白后,压迫止血并杀灭可能外渗的HCT116细胞,然后将脾脏放回原位,关腹。对照组予戊巴比妥钠腹腔注射麻醉后,选择左背部斜切口进腹暴露脾脏,但不注入HCT116细胞,随即关腹。麻醉清醒后,常规饲养,当裸鼠出现明显消瘦、行动迟缓、弓背、精神萎靡等现象时,5-AzaDc低、中、高剂量组分别腹腔注射1.0 μmol/L 5-AzaDc 0.3、0.4、0.5 mg/kg,每周1次,连续注射8周。对照组和模型组腹腔注射等量生理盐水,每周1次,连续注射8周。
1.3 观察指标 各组腹腔注射8周后,采集外周静脉血2 mL保存备用,然后颈椎脱臼处死,无菌条件下剖腹取肝转移瘤组织,PBS冲洗干净,保存备用。
1.3.1 DNMT活性 取部分肝转移瘤组织,剪碎、消化、再培养后,经流式细胞仪分离,获取肝转移瘤细胞。按DNMT活性检测试剂盒说明检测DNMT活性。
1.3.2 肿瘤球数量 取部分肝转移瘤组织,剪碎、消化、再培养后,经流式细胞仪分离,获取肝转移瘤细胞。将肝转移瘤细胞以500个/孔密度接种于96孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱内常规培养。从培养第3天开始,隔天于显微镜下观察肿瘤球形成情况。培养2周时,显微镜下拍照,计数直径>40 μm的肿瘤球数量。
1.3.3 细胞存活率 取部分肝转移瘤组织,剪碎、消化、再培养后,经流式细胞仪分离,获取肝转移瘤细胞。取肝转移瘤细胞1×106个,PBS洗涤后,用结合缓冲液稀释成密度为4×105个/mL细胞悬液,室温下避光孵育10 min,上流式细胞仪检测。
1.3.4 血清CD44v6、VEGF检测 取大鼠外周静脉血,3 000 r/min离心10 mim、离心半径8 cm,留取上层血清。采用ELISA法检测血清CD44v6、VEGF。试剂盒购自深圳晶美生物工程有限公司,所有操作严格按试剂盒说明进行。
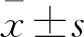
2 结果
2.1 各组肝转移瘤细胞DNMT活性比较 对照组仅开腹,脾脏未注入HCT116细胞,无肝转移瘤细胞形成。模型组与5-AzaDc低、中、高剂量组肝转移瘤细胞DNMT活性分别为13.24±1.01、9.22±2.22、5.12±1.03、4.34±1.24。随着5-AzaDc浓度升高,各组肝转移瘤细胞DNMT活性逐渐降低(F=39.495,P<0.05)。5-AzaDc低、中、高剂量组肝转移瘤细胞DNMT活性均低于模型组(P均<0.05),5-AzaDc中、高剂量组肝转移瘤细胞DNMT活性低于5-AzaDc低剂量组(P均<0.05),而5-AzaDc中剂量组与5-AzaDc低剂量组肝转移瘤细胞DNMT活性比较差异无统计学意义(P>0.05)。
2.2 各组肝转移瘤细胞肿瘤球数量和细胞存活率比较 对照组仅开腹,脾脏未注入HCT116细胞,无肝转移瘤细胞形成。模型组与5-AzaDc低、中、高剂量组肝转移瘤细胞肿瘤球数量和细胞存活率比较见表1。

表1 模型组与5-AzaDc低、中、高剂量组肝转移瘤细胞肿瘤球数量和细胞存活率比较
2.3 各组血清CD44v6、VEGF水平比较 见表2。

表2 各组血清CD44v6、VEGF水平比较
3 讨论
肝脏是结直肠癌血行转移最主要的靶器官,临床上10%~25%结直肠癌患者一经确诊便已发生肝转移,另有20%~25%结直肠癌患者在接受根治性手术后3年内出现肝转移[7-8]。肝转移是影响结直肠癌患者预后的重要因素,亦是导致患者死亡的主要原因,据报道约30%结直肠癌患者死于肝转移[9-10]。目前,临床治疗结直肠癌主要采取手术联合放化疗,但远期效果不佳,肝转移是导致治疗失败的重要原因[11-12]。因此,探索一种治疗结直肠癌肝转移的有效手段,对改善患者预后具有重要意义。
近年来,随着表观遗传学研究不断深入,启动子区高甲基化引起的多种抑癌基因失活被认为可能是恶性肿瘤发生的重要原因。DNA甲基化是由DNMT催化下,以S-腺苷甲硫氨酸作为甲基供体,将活性甲基转移至DNA链中特定碱基上的化学修饰过程。作为一种表观遗传学修饰,DNA甲基化可在不改变DNA序列的前提下,对个体生长、发育以及基因表达等发挥重要的调控作用,并且这种修饰在细胞增殖过程中可稳定传递。因此,DNA甲基化对肿瘤细胞的干性调控以及维持过程具有至关重要的作用[13-15]。5-AzaDc是一种新型DNMT抑制剂,可在DNA复制过程中替代胞嘧啶,竞争性结合DNMT,抑制DNMT活性,从而干扰DNMT对基因表达的调控作用。以往5-AzaDc主要用于治疗恶性血液病,用于治疗结直肠癌的报道较少,对结直肠癌肝转移的治疗更是鲜有报道。
本研究结果发现,模型组与5-AzaDc低、中、高剂量组肝转移瘤细胞DNMT活性逐渐降低;5-AzaDc低、中、高剂量组肝转移瘤细胞DNMT活性均低于模型组,并且5-AzaDc中、高剂量组肝转移瘤细胞DNMT活性低于5-AzaDc低剂量组,而5-AzaDc中剂量组与5-AzaDc高剂量组肝转移瘤细胞DNMT活性比较差异无统计学意义。提示5-AzaDc能够抑制结直肠癌肝转移瘤细胞DNMT活性,并且随着5-AzaDc剂量增加,其作用效果越来越明显。本研究结果还发现,模型组与5-AzaDc低、中、高剂量组肿瘤球数量和细胞存活率均逐渐降低;5-AzaDc低、中、高剂量组肿瘤球数量和细胞存活率均低于模型组,并且5-AzaDc中、高剂量组肿瘤球数量和细胞存活率均低于5-AzaDc低剂量组,而5-AzaDc中剂量组肿瘤球数量和细胞存活率与5-AzaDc高剂量组比较差异无统计学意义。结果提示,5-AzaDc能够抑制肝转移廇细胞成瘤能力和侵袭能力。DNMT能够通过调控Wnt/β-catenin信号通路抑制SFTP1基因甲基化,在结直肠癌干细胞干性维持中具有至关重要的作用。而5-AzaDc通过抑制DNMT活性调控Wnt/β-catenin信号通路,促使SFTP1基因去甲基化,进而抑制结直肠癌干细胞干性以及肝转移瘤细胞增殖和侵袭。此外,5-AzaDc作为新型DNMT抑制剂,能够通过共价键与DNMT结合并形成不可逆的复合物,从而导致DNMT活性受到抑制,促使基因组甲基化水平降低,重新激活因高甲基化而失活的重要抑癌基因,最终发挥抗肿瘤作用。
CD44是一种分布极为广泛的细胞表面跨膜糖蛋白,CD44v6是其家族的重要成员。CD44v6过表达多见于转移力强的肿瘤细胞。CD44v6能够通过介导淋巴细胞归巢以及改变肿瘤细胞骨架构象和分布,影响肿瘤细胞的运动能力,使肿瘤细胞获得转移潜能,从而形成转移瘤并稳固寄宿和生长。CD44v6因与肿瘤侵袭和转移关系密切而受到广泛关注。在结直肠癌患者中,CD44v6高表达通常与肝转移和不良预后密切相关。VEGF是新生血管形成的关键性调控因子,在恶性肿瘤的发生、发展过程中发挥重要作用。血清VEGF水平升高可促进新生血管形成,增加肿瘤转移概率;血清VEGF水平升高还能增加血管通透性,使血浆蛋白外渗,从而为血管内皮细胞迁移和肿瘤转移提供基质[16]。本研究结果发现,模型组和5-AzaDc低、中、高剂量组血清CD44v6、VEGF水平均高于对照组;5-AzaDc低、中、高剂量组血清CD44v6、VEGF水平均低于模型组,并且5-AzaDc中、高剂量组血清CD44v6、VEGF水平均低于5-AzaDc低剂量组,而5-AzaDc中剂量组血清CD44v6、VEGF水平与5-AzaDc高剂量组比较差异均无统计学意义。提示5-AzaDc能够抑制结直肠癌肝转移裸鼠血清CD44v6、VEGF水平,进而阻止肿瘤侵袭和转移。5-AzaDc可能通过抑制DNMT活性进而影响CD44v6、VEGF基因启动子区域中CpG岛甲基化,从而使血清CD44v6、VEGF水平降低。
综上所述,5-AzaDc对结直肠癌肝转移具有一定抑制作用,其作用机制可能与抑制肿瘤血管形成有关。但目前5-AzaDc抑制结直肠癌肝转移的具体作用机制仍不完全清楚,尚需进一步研究。
