食管癌组织miR-122-5p、CREB1 mRNA表达变化及其临床意义
2022-01-10邓伟明李道航孟凡亮
邓伟明,李道航,孟凡亮
1 安徽医科大学附属巢湖医院心胸外科,安徽巢湖238000;2 安徽医科大学附属巢湖医院呼吸与危重症医学科
食管癌是上消化道常见的恶性肿瘤,也是全球第八大常见恶性肿瘤。由于早期症状不典型,大多数食管癌患者就诊时已进展至晚期,而对于晚期食管癌只能采取化疗、放疗、分子靶向治疗等,但治疗效果欠佳[1]。目前,食管癌的发病机制尚不完全清楚。因此,探索食管癌发生、发展的分子机制对其早期诊断和靶向治疗具有重要意义。非编码RNA是一类不编码蛋白的RNA,但这类RNA在基因转录水平、转录后水平及翻译水平具有重要的调控作用,能够参与调控细胞增殖、分化、凋亡等生物学过程[2]。微小RNA-122-5p(miR-122-5p)是一种小分子非编码RNA。有研究报道,miR-122-5p可作为癌基因或抑癌基因,参与多种恶性肿瘤细胞的增殖、侵袭、迁移等[3-4]。环磷酸腺苷反应元件结合蛋白1(CREB1)是一种调节基因转录的蛋白质,可通过调控下游靶基因表达,参与细胞增殖、分化、周期调控等生物学活动,其异常表达与多种恶性肿瘤细胞的增殖、侵袭、迁移等密切相关[5-6]。但miR-122-5p、CREB1在食管癌发生、发展中的作用尚不清楚。本研究观察了食管癌组织miR-122-5p、CREB1 mRNA表达变化,并分析其表达变化与患者临床病理特征和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年1月—2018年3月安徽医科大学附属巢湖医院收治的食管癌患者92例。所有患者经术后组织病理检查明确诊断。纳入标准:①符合食管癌诊断标准;②初诊;③接受根治性或姑息性切除手术;④术前未接受任何抗肿瘤治疗;⑤临床病理资料和术后随访资料完整。排除标准:①合并其他部位恶性肿瘤者;②合并心、肝、肾等重要脏器严重疾病者;③合并全身感染性疾病者;④合并血液系统疾病者。其中,男56例、女36例,年龄41~87(58.24±7.18)岁;病理类型:腺癌32例,鳞癌60例;肿瘤直径:≥4 cm 45例,<4 cm 47例;组织分化程度:低分化48例,中高分化44例;TNM分期[7]:Ⅰ、Ⅱ期66例,Ⅲ、Ⅳ期26例;有淋巴结转移22例,无淋巴结转移70例。本研究经安徽医科大学附属巢湖医院医学伦理委员会批准(审批编号:KYXM-202109-018),患者或其家属知情同意并签属知情同意书。
1.2 miR-122-5p、CREB1 mRNA表达检测 采用RT-qPCR技术。取手术切除的胃癌组织及其配对的癌旁组织(距肿瘤组织边缘>5 cm,经术后组织病理检查证实为正常胃组织),液氮下充分研磨,采用TRIzol法提取组织总RNA,经琼脂糖凝胶电泳和紫外可见分光光度计鉴定,提取的总RNA完整且纯度和浓度合格。按TaKaRa逆转录试剂盒说明将总RNA逆转录为cDNA。逆转录条件:42 ℃ 1 h,95 ℃ 5 min。以cDNA为模板,按PCR试剂盒说明进行PCR扩增。引物序列:miR-122-5p上游引物5′-CCGCTCGAGTTCGTGGCTACAGAGTTT-3′、下游引物5′-CCGGAATTCTTTATCGAGGGAAGGATT-3′,内参U6上游引物5′-CTTTTCTCCGGAACACAGATTTC-3′、下游引物5′-GATTTGCCAAGTGGGAGGGA-3′;CREB1 mRNA上游引物5′-CGCGGATCCAAATGGACTGGCTTGG-3′、下游引物5′-CGGAATTCTGCCCTATGGAAGAGCTG-3′,内参GAPDH上游引物5′-CACTCCTCCACCTTTGA-3′、下游引物5′-CCACCACCCTGTTGCTG-3′。PCR反应体系:cDNA模板2 μL,上下游引物各1.5 μL,SYBR Green Master Mix 10 μL,ddH2O 8 μL(miR-122-5p);cDNA模板2 μL,上下游引物各1 μL,SYBR Green Master Mix 10 μL,ddH2O 6 μL(CREB1 mRNA)。PCR反应条件:95 ℃预变性30 s,95 ℃变性15 s、62 ℃退火30 s、72 ℃延伸20 s共40个循环(miR-122-5p);95 ℃预变性30 s,95 ℃变性5 s、62 ℃退火35 s、72 ℃延伸30 s共40个循环(CREB1 mRNA)。PCR扩增反应结束后进行熔解曲线分析,收集循环阈值(CT)数。以U6或GAPDH为内参,采用2-ΔΔCT法计算miR-122-5p、CREB1 mRNA相对表达量。实验重复3次,取平均值。
1.3 随访 所有患者出院后通过门诊复查或电话形式定期随访3年,随访截至2021年3月,统计术后3年总生存率。

2 结果
2.1 食管癌组织与癌旁正常组织miR-122-5p、CREB1 mRNA表达比较 食管癌组织与癌旁正常组织miR-122-5p 相对表达量分别为0.346±0.068、0.953±0.250,CREB1 mRNA相对表达量分别为3.488±0.993、1.419±0.477。食管癌组织miR-122-5p 相对表达量明显低于癌旁正常组织,CREB1 mRNA相对表达量明显高于癌旁正常组织(t分别为-22.481、18.004,P均<0.01)。
2.2 食管癌组织miR-122-5p表达与CREB1 mRNA表达的关系 Pearson相关分析显示,食管癌组织miR-122-5p 表达与CREB1 mRNA表达呈负相关关系(r=-0.562,P<0.01)。
2.3 食管癌组织miR-122-5p、CREB1 mRNA表达与患者临床病理特征的关系 见表1。
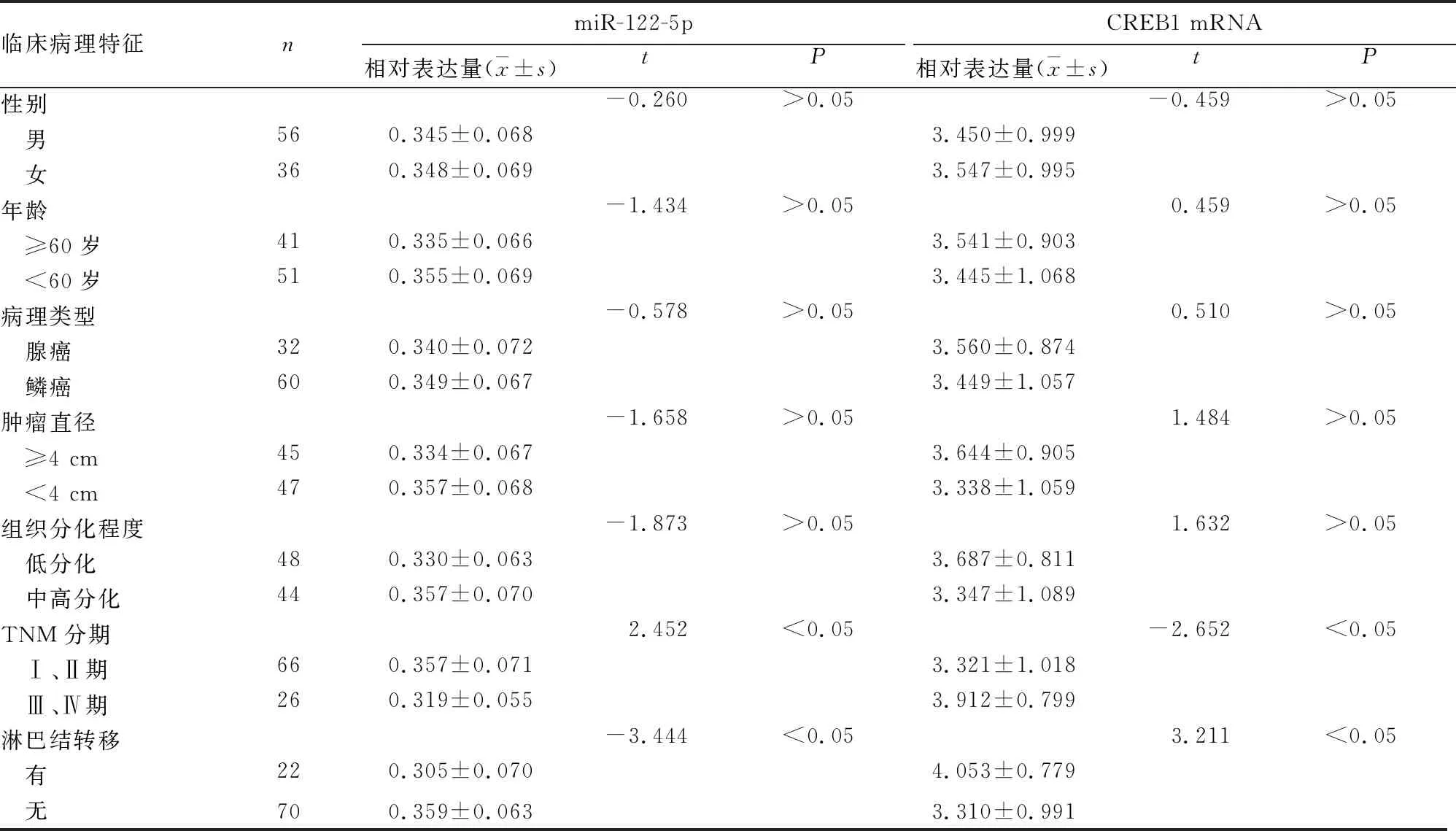
表1 食管癌组织miR-122-5p、CREB1 mRNA表达与患者临床病理特征的关系
2.4 食管癌组织miR-122-5p、CREB1 mRNA表达与患者预后的关系 截至2021年3月,共随访3~36个月,中位随访时间21个月,随访期间死亡38例。以食管癌组织miR-122-5p相对表达量的均数为临界值,将患者分为miR-122-5p高表达者(≥0.346,44例)与低表达者(<0.346,48例),miR-122-5p高表达者与低表达者术后3年总生存率分别为70.45%(31/44)、47.92%(23/48),miR-122-5p高表达者术后3年总生存率高于miR-122-5p低表达者(χ2=7.327,P<0.01);以食管癌组织CREB1 mRNA相对表达量的均数为临界值,将患者分为CREB1 mRNA高表达者(≥3.488,42例)与低表达者(<3.488,50例),CREB1 mRNA高表达者与低表达者术后3年总生存率分别为45.24%(19/42)、70.00%(35/50),CREB1 mRNA高表达者术后3年总生存率低于CREB1 mRNA低表达者(χ2=7.582,P<0.01)。见图1、2。
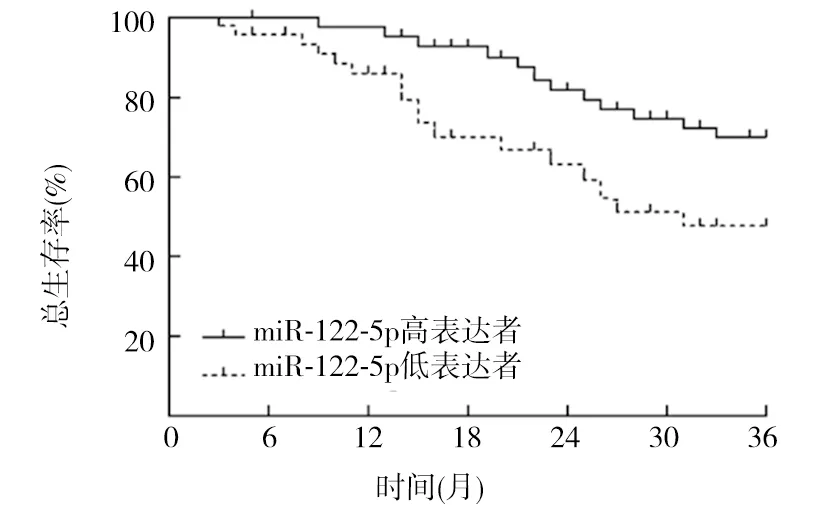
图1 食管癌组织不同miR-122-5p表达者术后3年生存曲线

图2 食管癌组织不同CREB1 mRNA表达者术后3年生存曲线
2.5 食管癌患者预后的影响因素分析 以食管癌患者预后(死亡=1,存活=0)为因变量,以性别(男=1,女=0)、年龄(≥60岁=1,<60岁=0)、病理分型(腺癌=1,鳞癌=0)、肿瘤直径(≥4 cm=1、<4 cm=0)、组织分化程度(低分化=1,中高分化=0)、TNM分期(Ⅲ、Ⅳ期=1,Ⅰ、Ⅱ期=0)、淋巴结转移(有=1,无=0)、miR-122-5p表达(≥0.346=1、<0.346=0)、CREB1 mRNA表达(≥3.488=1、<3.488=0)为自变量,纳入Cox比例风险回归模型,结果发现TNM分期Ⅲ、Ⅳ期及有淋巴结转移、CREB1 mRNA表达≥3.488为食管癌患者预后不良的独立危险因素,而miR-122-5p表达≥0.346为其独立保护因素(P均<0.05)。见表2。

表2 食管癌患者预后的Cox比例风险回归分析结果
3 讨论
食管癌是一种起源于食管黏膜上皮的恶性肿瘤。我国是食管癌的高发国家之一,据统计,2020年我国食管癌新发病例和死亡病例分别为32.4万例、30.1万例[8]。由于早期症状不典型,大多数食管癌患者就诊时已进展至晚期,而对于晚期食管癌只能采取化疗、放疗、分子靶向治疗等,但治疗效果欠佳,5年生存率仅20%~30%[9]。目前,食管癌的发病机制尚不完全清楚。因此,探索食管癌发生、发展的分子机制对其早期诊断和靶向治疗具有重要意义。
非编码RNA是一类不编码蛋白的RNA,包括miRNA、lncRNA、circRNA、piRNA等,虽然不编码蛋白,但能够在RNA水平上发挥多种生物学功能。miRNA是人体内广泛分布的内源性非编码RNA,长度一般为21~23个核苷酸,能够通过与mRNA相互作用,降解mRNA或抑制mRNA翻译,从而调控靶基因表达。有研究报道,miRNA能够调控多种癌基因或抑癌基因表达,从而参与食管癌的发生、发展[10]。miR-122-5p为miRNA家族成员之一,定位于人染色体18q21.31。作为肝脏的特异性miRNA之一,miR-122-5p最初多用于肝脏疾病的早期诊断和病情评估。YANG等[11]研究报道,miR-122-5p能够通过抑制连环蛋白δ2抑制肝癌细胞侵袭和迁移。WANG等[12]研究发现,miR-122-5p能够通过负向调控M2型丙酮酸激酶促进肾癌细胞增殖和迁移。以上研究表明,miR-122-5p在不同肿瘤中发挥的作用亦不相同。本研究结果显示,食管癌组织miR-122-5p相对表达量明显低于癌旁正常组织,并且其表达与TNM分期、淋巴结转移有关,提示miR-122-5p可能作为抑癌基因参与食管癌的发生、发展。陈劭赓等[13]将miR-122-5p mimic转染食管癌EC109细胞后发现,EC109细胞增殖能力降低、凋亡比例升高,从细胞水平上佐证了miR-122-5p能够参与食管癌的发生、发展。进一步研究发现,miR-122-5p高表达者术后3年总生存率高于miR-122-5p低表达者,并且miR-122-5p高表达为食管癌患者预后的独立保护因素。提示miR-122-5p表达与食管癌预后有关,其表达越低,患者预后越差。
CREB是一种选择性结合CREs的核蛋白,因能刺激基因转录,又被称为转录增强因子。活化的CREB可参与多种信号传导过程,能够调控细胞增殖、分化、凋亡等生物学行为[14]。CREB1作为CREB家族中的一员,定位于人染色体2q32-34,可异常启动肿瘤相关基因转录,通过调控具有细胞增殖、分化、凋亡等功能的靶基因表达,参与肿瘤细胞的恶性生物学行为。有研究报道,CREB1能够参与卵巢癌、非小细胞肺癌等实体肿瘤的发生、发展[15-16]。本研究结果发现,食管癌组织CREB1 mRNA表达明显高于癌旁正常组织,并且其表达与TNM分期、淋巴结转移有关,提示CREB1能够参与食管癌的发生、发展,其机制可能与CREB1异常启动肿瘤相关基因转录,从而促进食管癌细胞增殖、分化、迁移等有关。进一步研究发现,CREB1 mRNA高表达者术后3年总生存率低于CREB1 mRNA低表达者,CREB1 mRNA高表达为食管癌患者预后不良的独立危险因素。提示CREB1 mRNA表达与食管癌预后有关,其表达越高,患者预后越差。
有研究报道,在膀胱癌、结肠癌中miR-122能够通过靶向调控CREB1参与肿瘤细胞的增殖、侵袭、迁移等[17-18]。陈劭赓等[13]通过双荧光素酶报告基因实验证实,miR-122-5p能够靶向负调控CREB1抑制食管癌细胞的生长和增殖。提示在食管癌中miR-122-5p与CREB1存在靶向调控关系。本研究结果显示,食管癌组织miR-122-5p表达与CREB1 mRNA表达呈负相关关系,二者可能共同参与食管癌的发生、发展。但miR-122-5p是否通过靶向调控CREB1参与食管癌患者预后尚不清楚,还需进一步研究。
综上所述,食管癌组织miR-122-5p表达下调、CREB1 mRNA表达上调,二者表达变化与TNM分期、淋巴结转移以及患者预后有关。但本研究样本量较小且随访时间较短,其结论还有待于进一步验证。
