山羊Hoxa5基因克隆及表达特性
2022-01-10陈定双王瑞龙林亚秋朱江江李艳艳
陈定双,王瑞龙,林亚秋,王 永,朱江江,李 鑫,张 浩,李艳艳
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部 四川省重点实验室,四川 成都 610041;2.西南民族大学 畜牧兽医学院,四川 成都 610041)
同源框基因(Homeobox genes,HOX)最早由McGinnis等[1]在果蝇中鉴定出,之后在脊椎动物中发现,该基因是一个转录因子超家族。它们被分为几个类别,其中Ⅰ类同源框基因是39种包含183个核苷酸序列(同源异型盒)的胚胎发育的转录调节因子,编码61个氨基酸结构域(同源蛋白)[2]。同源结构域起到转录调节的作用,识别以5′-TATA-3′为核心的DNA序列,调控下游基因的转录活性。在哺乳动物中HOX家族的39个基因成簇分布于7,17,12,2号染色体上,构成了4簇并由此命名为HOXA、HOXB、HOXC和HOXD簇[3]。HOX基因与女性生殖道发育、神经元发育、急性髓系白血病、造血过程、乳腺癌、肺癌[4-7]等的发生发展有关。除此之外,也有研究表明,HOX基因与脂肪发育有关,例如Hoxa1、Hoxa5、Hoxa10、Hoxc4和Hoxc8存在于棕色脂肪组织中。除Hoxa1和Hoxc4外,这些基因也在白色脂肪组织中表达[8]。
Hoxa5基因属于HOX基因家族,它位于人类7号染色体HOXA簇的中间位置[3]。人Hoxa5基因编码含270个氨基酸的ANTP类同源结构域蛋白[9]。该基因广泛存在于哺乳动物和啮齿动物中,并被鉴定出在小鼠内脏脂肪组织的表达高于皮下脂肪组织[10-11]。据报道,肥胖患者在接受胰胆分流-十二指肠转位(BPD-DS)减脂手术后皮下脂肪组织的Hoxa5表达被上调[12];过表达Hoxa5可促进小鼠前体脂肪细胞的分化[13];在3T3-L1脂肪细胞中敲低处理Hoxa5会使脂质积累减少[14];在大鼠断奶后生长期的运动训练中显著提高Hoxa5的表达,Hoxa5很可能在产后早期运动训练引起的棕色脂肪标志物变化中发挥作用[15]。目前,该基因在乳腺癌和肺癌的生物学功能研究比较深入,在反刍动物脂肪代谢的研究甚少,且在山羊脂代谢上的研究尚未见报道。
因此,本试验以简州大耳羊为研究对象,在克隆山羊Hoxa5基因cDNA序列的基础上,拟通过在线工具分析山羊Hoxa5基因的生物学特征,并通过实时荧光定量PCR技术分析Hoxa5基因在山羊不同组织和诱导分化不同阶段的皮下脂肪细胞中的表达水平,同时构建了pEGFP-Hoxa5融合表达载体转染山羊皮下脂肪细胞,观察该基因发挥生物学功能的具体位置。本研究将为Hoxa5基因生物学功能的进一步研究奠定基础。
1 材料和方法
1.1 试验动物与组织采集
选用四川省简阳市大哥大牧业有限公司种羊场1周岁的健康简州大耳羊(n=4)作为试验对象,早晨空腹屠宰后迅速采集其试验所需的组织,用DEPC水清洗除去血渍后立即用锡箔纸包裹好分装入冻存管中(材料器材均先经过去RNA酶处理),置入液氮罐中冻存,带回实验室进行后续试验。
1.2 试验方法
1.2.1 总RNA的提取及反转录 利用TRIzol法提取山羊组织总RNA,检测RNA浓度合格后参考Revert Aid First Strand cDNA Synthesis Kit(Thermo,美国)说明书进行反转录合成cDNA。cDNA于-20 ℃保存备用。
1.2.2 引物的设计及合成 根据GenBank中牛的Hoxa5基因mRNA序列(登录号:NM_001077098.1),利用Primer premier 5设计引物,扩增Hoxa5基因的完整CDS区序列(本研究所用引物序列见表1)。

表1 引物信息Tab.1 Primers information
1.2.3Hoxa5基因克隆及测序 以反转录得到的山羊皮下脂肪组织cDNA作为目的基因扩增模板,利用RT-PCR法扩增山羊Hoxa5基因。RT-PCR反应总体系(25 μL)为:2×Super Pfx MasterMix 酶12.5 μL(终浓度1×);上、下游引物各1 μL(10 pmol/μL);皮下脂肪组织cDNA 1 μL(200~600 ng/μL);ddH2O 9.5 μL。PCR扩增程序:预变性(98 ℃,3 min);变性(98 ℃,10 s),退火(58℃,10 s),延伸(72 ℃,15 s),35个循环;延伸(72 ℃,2 min),4 ℃保温。用1%琼脂糖凝胶电泳检测PCR产物,使用DNA回收试剂盒(天根生化科技有限公司,中国)对目的片段进行回收和纯化,将纯化产物连接至pMD-19T载体,转化至热激后的DH5α感受态细胞,随后接种到含有Amp的LB固体培养基上,37 ℃过夜培养后挑取菌落于干净的EP管中,加入含有Amp的LB液体培养基摇床培养4~6 h,进行菌落PCR鉴定后送至成都擎科生物技术有限公司测序。
1.2.4Hoxa5基因的生物信息学分析 使用相应生物信息分析软件及在线网站对Hoxa5基因进行生物信息学分析,具体生物信息学分析及方法见表2。

表2 序列分析工具及相应分析内容Tab.2 Sequence analysis tools and corresponding analysis content
1.2.5 山羊Hoxa5基因组织表达谱的构建 采用qPCR的方法,检测Hoxa5基因在山羊心、肝、脾、肺、肾、背、股、臂等10个组织的表达差异,根据克隆所得到的CDS区基因序列设计特异性引物,以TBP为内参基因矫正基因的相对表达水平[16](引物序列见表1),qPCR反应体系:10 μmol/L上、下游引物各1 μL ,SYBR®Premix Ex TaqTM(2×)10 μL,cDNA 1 μL,ddH2O 7 μL,总体系为20 μL,每个组织样本设置3个重复。qPCR反应条件:预变性(95 ℃ 3 min);变性(95 ℃ 10 s),退火(60 ℃ 10 s),延伸(72 ℃ 15 s),共38个循环。
1.2.6 山羊Hoxa5基因时序表达谱的构建 取山羊脂代谢研究实验室保存的山羊皮下前体脂肪细胞进行复苏,接种于25 cm2培养瓶中,待细胞传至F3,将山羊皮下脂肪细胞进行细胞计数并均匀接种于12孔板。当细胞融合度达到80%,将完全培养基更换为油酸诱导液(50 μmol/L),在0,12,24,36,48,60,72 h收集细胞样品用于后续qPCR方法检测Hoxa5基因在分化过程中的表达情况。qPCR内参为UXT[17],引物序列见表1,反应条件同1.2.5。
1.2.7 融合表达载体 pEGFP-Hoxa5的构建及转染 根据克隆成功的Hoxa5序列和pEGFP-N1序列,选择XhoⅠ和KpnⅠ作为上下游酶切位点并设计亚克隆引物,引物序列见表1。将亚克隆获得的完整的山羊Hoxa5基因CDS区序列与pEGFP-N1载体分别进行双酶切后纯化回收,使用T4连接酶将纯化后的目的片段与pEGFP-N1载体16 ℃过夜连接,连接产物转化至DH5α感受态细胞过夜培养。将阳性菌落扩大培养并提取质粒,对重组质粒进行双酶切鉴定后送测序。
将F3山羊皮下前体脂肪细胞经计数后均匀接种至24孔板细胞培养板中,待细胞融合度达到80%时,使用脂质体介导法进行转染,转染48 h后在倒置荧光显微镜下观察pEGFP-Hoxa5在山羊皮下脂肪细胞亚细胞定位情况。
1.2.8 数据分析 定量PCR数据用2-ΔΔCt法对其CT值进行分析。显著性检验通过SPSS 17软件中One-way ANOVA分析的Games-Howell检验,利用GraphPad Prism 9.0绘制山羊Hoxa5基因的组织表达谱。
2 结果与分析
2.1 山羊Hoxa5基因克隆
以山羊皮下脂肪组织为模板,RT-PCR法进行扩增,用1%的琼脂糖进行电泳检测,获得的条带与预测的目的片段大小一致(图1-A),并测序进一步验证获得山羊Hoxa5基因序列。通过使用NCBI中的序列分析工具ORF寻找山羊Hoxa5基因开放阅读框序列,发现该基因的编码区序列为813 bp,编码270个氨基酸(图1-B)。将获得的序列提交GenBank获得基因序列登录号为:MZ004987。通过与牛Hoxa5基因(NM_001077098.1)的编码区序列比对发现该基因有1个突变位点,第444位G>A导致第148位氨基酸Ala>Thr(图1-C)。

A:M.DL2000 DNA Marker;1.Hoxa5基因;B:星形.丝氨酸磷酸化位点;圆形.苏氨酸磷酸化位点;三角形.酪氨酸磷酸化位点;实线框.同源结构域;ATG.起始密码子;TGA.终止密码子;C:Hoxa5部分核苷酸序列(NM_001077098.1)与本研究推导氨基酸的比较,潜在的多肽位(A444G)显示在方框中,推导出的氨基酸相应变化。
2.2 生物信息学分析
2.2.1 Hoxa5一级结构及理化性质的分析 利用ExPASy-ProParam软件分析Hoxa5一级结构及理化性质,其各种氨基酸含量如图2-A所示,其中丝氨酸的含量最高(14.4%),色氨酸和半胱氨酸的含量最低(1.1%);该蛋白的分子式为C1262H1929N391O399S10,相对分子质量为29.283 ku,等电点为9.42,该蛋白的GRAVY值和不稳定系数分别为66.01,-0.864,说明该蛋白是不稳定的亲水性蛋白。其他理化性质见表3。

A.山羊Hoxa5蛋白的氨基酸组成预测;B.山羊Hoxa5蛋白的亚细胞定位预测;C.山羊Hoxa5蛋白信号肽序列的预测。A.The predicted amino acid composition in Hoxa5 protein of goat;B.The predicted subcellular localization in Hoxa5 protein of goat;C.The predicted signal peptide in Hoxa5 protein of goat.

表3 Hoxa5理化性质分析Tab.3 Analysis of physical and chemical properties of Hoxa5
2.2.2 Hoxa5蛋白的磷酸化位点、跨膜结构、亚细胞定位和信号肽的分析 通过NetPhos-3.1在线软件对该蛋白的磷酸化位点进行预测,结果表明,该蛋白可能有30个丝氨酸磷酸化位点(Ser),9个苏氨酸磷酸化位点(The)和7个酪氨酸磷酸化(Tyr)(图1-B)。跨膜结构域预测结果显示,Hoxa5蛋白无跨膜结构域。山羊Hoxa5蛋白序列亚细胞定位的预测结果显示,该蛋白主要在细胞核内(95.7%)发挥生物学功能,少部分在细胞质内(4.3%)发挥生物学功能(图2-B)。利用Signalp 4.1在线软件对Hoxa5氨基酸序列进行预测分析,结果表明,Hoxa5是非分泌蛋白,无信号肽(图2-C)。
2.2.3 Hoxa5蛋白的结构特征及互作蛋白的预测 Conserved Domains结构域预测表明,山羊Hoxa5蛋白具有HOX家族典型的同源结构域(图3-A)。使用SOPMA预测二级结构显示,Hoxa5蛋白中无规卷曲(Random coil)含量最高,占总氨基酸残基的60.74%,其次是α螺旋(Alpha helix)占总氨基酸残基的22.96%,延伸链(Extended strand)和β转角(Beta turn)分别占总氨基酸数的11.48%,4.81%(图3-B)。通过SWISS-MODEL软件预测建立山羊与其他物种Hoxa5蛋白的空间结构模型,结果表明,山羊Hoxa5蛋白与绵羊、牛和小鼠具有高度相似性(图4-A)。利用STRING交互式数据库对山羊Hoxa5的互作蛋白进行预测,结果显示,山羊HOXA5可能与HOXD4、HOXB6、HOXA6、PBX1等蛋白质间存在相互作用关系,绘制蛋白质相互作用网络见图4-B。
2.3 氨基酸序列同源性分析
利用NCBI对不同物种Hoxa5基因所编码的氨基酸序列进行比对,显示与绵羊(XP_014950589.2)、牛(NP_001070566.1)、马(XP_001499628.2)、猪(NP_001182161.1)、黑鼠(XP_032762393.1)、豚鼠(XP_003468003.2)、小鼠(NP_034583.1)及人(NP_061975.2)的Hoxa5氨基酸序列相似性依次为100%,99.63%,99.26%,99.26%,98.89%,98.89%,98.89%和98.15%,说明该基因在不同的物种间具有较高的保守性(图4-C)。

A.山羊Hoxa5氨基酸序列生物学功能预测;B.Hoxa5氨基酸序列二级结构预测。A.Prediction of biological function of goat Hoxa5 amino acid sequence;B.The predicted secondary structure of the Hoxa5 amino acid sequence.

A.不同物种中Hoxa5蛋白的三级结构;B.山羊Hoxa5蛋白相互作用分析;C.Hoxa5氨基酸同源性比对。A.The tertiary structure of Hoxa5 protein in different species;B.Interaction analysis of Hoxa5 protein in goat;C.Comparison of amino acid homlogy of goat Hoxa5.
2.4 山羊Hoxa5系统进化树的构建
使用MEGA 5.0软件比较获得的山羊Hoxa5氨基酸序列与绵羊、牛、小鼠等动物氨基酸序列的差异,以确定物种间的进化关系,并用NJ法构建进化树。进化树结果表明,山羊与绵羊属于一个单独的分支,进化关系最近,人与山羊的进化关系最远(图5)。
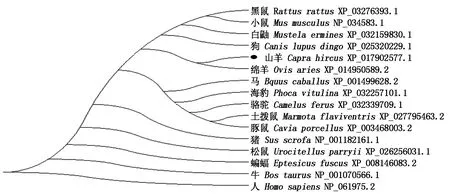
图5 NJ法构建Hoxa5氨基酸系统进化树Fig.5 Phylogenetic tree constructed based on Hoxa5 amino acid with Neighbor-joining method
2.5 组织表达谱的鉴定
本研究以TBP为内参基因,通过荧光定量PCR技术检测Hoxa5基因在山羊不同组织中表达模式,结果显示,该基因在山羊的各个组织中均存在广泛表达,其中在肾脏中的表达量显著高于其他各组织(P<0.05),该基因在心、肺、股二头肌、臂三头肌中也具有较高的表达水平,显著高于肝、脾和皮下脂肪这3个组织(P<0.05)(图6)。

1.心;2.肝;3.脾;4.肺;5.肾;6.背最长肌;7.股二头肌;8.臂三头肌;9.腹部脂肪;10.皮下脂肪。不同小写字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。图7同。
2.6 时序表达谱的鉴定
为探究Hoxa5基因在山羊皮下前体脂肪细胞分化过程中的表达情况,通过时序表达谱可知,山羊Hoxa5基因在经油酸诱导分化的皮下脂肪细胞中表达量有明显的变化,在诱导分化后的第60小时表达量上调最为显著(图7)。

图7 山羊Hoxa5基因在皮下前体脂肪细胞分化过程中的相对表达量Fig.7 Relative expression of Hoxa5 gene in goat during subcutaneous adipocyte differention
2.7 融合表达蛋白pEGFP-Hoxa5的亚细胞定位
为了探究该基因在皮下脂肪细胞中发挥功能的具体位置,在倒置荧光显微镜下观察转染48 h后的山羊皮下前体脂肪细胞,发现转染pEGFP-N1的皮下脂肪细胞,绿色荧光均匀分布于整个细胞;而在转染pEGFP-Hoxa5的皮下脂肪细胞中,绿色荧光分布于细胞核(图中白色箭头指示处),细胞质中无绿色荧光分布(图8)。

图8 Hoxa5蛋白的亚细胞定位Fig.8 The predicted subcellular localization of Hoxa5 protein in goat
3 讨论与结论
同源框(HOX)基因在哺乳动物中具有高度的保守性,它们在发育中起着核心作用。目前HOX基因的研究主要集中在控制胚胎模式、器官的发育和癌症的发生发展[18-23]。最近研究指出,HOX家族的Hoxa5与小鼠脂肪组织的发育及重塑有关,Hoxa5通过激活Fabp4并阻遏PKA/HSL通路来促进小鼠脂肪细胞分化和线粒体生物合成[24];Hoxa5通过抑制小鼠白色脂肪细胞中的Akt/mTORC1信号通路来增加细胞凋亡[25],然而对Hoxa5基因在家畜动物脂肪细胞的研究甚少,且对山羊脂肪细胞的作用尚未见报道。
因此,本研究以简州大耳羊的皮下脂肪组织为模板,以近缘物种牛的Hoxa5基因mRNA序列为参照,设计引物并克隆得到了山羊的Hoxa5基因序列,该基因的编码区序列为813 bp,编码270个氨基酸。Odenwald等[9]通过对小鼠Hoxa5基因克隆分析表明,该基因编码一种270个氨基酸ANTP类同源结构域蛋白,本研究的结果与此一致。通过与牛Hoxa5基因的编码区序列比对发现,该基因有1个突变位点位于ORF区,第444位G>A导致第148位氨基酸Ala>Thr,推测突变可能造成Hoxa5蛋白某些功能的改变。该蛋白具有多个磷酸化位点,猜测这些位点可能有助于山羊Hoxa5蛋白质磷酸化的发生。磷酸化作为蛋白翻译后修饰的方式之一,涉及各种细胞活动,调节许多细胞功能,如细胞生长、分化、凋亡[26],因此,这些磷酸化位点可能是调控山羊Hoxa5蛋白行使功能的重要位点。HOX家族含有特有的结构域,此结构域由180~183个核苷酸构成高度保守的DNA序列,该序列编码的60~61个氨基酸组成了同源结构域[27-28]。通过Conserved Domains在线工具预测分析发现山羊Hoxa5核酸与蛋白预测的整体结构与上述一致,因此,该蛋白可通过同源结构域识别并调节靶基因的转录[29]。通过对山羊Hoxa5蛋白进行氨基酸序列多重比对发现,各种动物间氨基酸序列保守性高,猜测Hoxa5蛋白作为一个具有重要功能的蛋白家族成员之一,在不同物种中具有结构和功能的一致性。进化树分析表明,山羊与绵羊亲缘关系最近,属于一个单独的分支,其中人与山羊的进化关系最远。
Hoxa5基因在人、小鼠上的研究较为深入,在家畜动物上的研究甚少。为了探究该基因是否在山羊各个组织中存在广泛表达,本试验采集了山羊的10个组织并构建了山羊Hoxa5基因的组织表达谱,试验结果表明,Hoxa5基因在所选的组织中均存在广泛表达,但其mRNA表达水平在各个组织中存在差异。比如Hoxa5在肾中表达水平较高,在脾和皮中表达最低。王艳[30]的研究表明,Hoxa5基因在猪的肾脏和子宫的表达量最高,在肝脏和脂肪中表达量中等,在心脏、脾脏和肌肉中的表达量较低。这与本研究存在相似及差异之处,推测这种不同可能因为该基因在不同物种中具有组织表达差异性。
此外,本研究还检测了Hoxa5基因在山羊皮下脂肪细胞分化过程中的表达模式,发现该基因在分化过程中表达水平明显改变,12~72 h的表达水平高于0 h且在第60小时表达水平达到最大值。因此,推测该基因在山羊皮下脂肪细胞分化中可能发挥正向调控作用,然而本研究与曹玮娜[24]在小鼠脂肪细胞上的研究结果存在差异,研究结果表明,Hoxa5基因在小鼠脂肪细胞分化前一天到分化第1天增加,然后随着分化时间的推移表达量逐渐降低并低于分化前一天,结果的差异可能是因为试验动物、检测时间不同所导致的。基于该基因在山羊皮下脂肪细胞中的表达模式以及该基因是转录因子超家族的成员,推测Hoxa5可能调控山羊皮下脂肪细胞的分化,因此,本研究想进一步确认Hoxa5蛋白在山羊皮下脂肪细胞中发挥功能的具体位置,通过构建pEGFP-Hoxa5融合蛋白表达载体,转染山羊皮下脂肪细胞后发现该蛋白主要定位于细胞核中,这与软件预测及Odenwald等[9]在小鼠上的研究结果一致,表明Hoax5蛋白主要在细胞核中行使生物学功能。
本研究成功克隆得到包含完整开放阅读框的山羊Hoxa5基因序列,其中CDS区为813 bp,共编码270个氨基酸,该蛋白的分子量为29.283 ku,是不稳定的、亲水的非分泌蛋白。预测发现该蛋白具有30个丝氨酸磷酸化位点(Ser),9个苏氨酸磷酸化位点(The)和7个酪氨酸磷酸化位点(Tyr),具有HOX基因典型的同源结构域,高级结构由α-螺旋、β-折叠和无规则卷曲组成。Hoxa5广泛表达于各个组织,其中在肾中表达最高。亚细胞定位表明,该蛋白主要在细胞核中发挥生物学功能。本研究结果为今后深入研究Hoxa5基因在山羊脂肪细胞中发挥的具体生物学功能奠定了基础。
