响应白粉菌的小麦NBS基因筛选
2022-01-10田志刚张树伟常利芳贾举庆张晓军
田志刚,张树伟,陈 芳,常利芳,贾举庆,张晓军,李 欣
(1.山西省科技情报与战略研究中心,山西 太原 030001;2.山西农业大学 农学院,作物遗传与分子改良山西省重点实验室,山西 太原 030031 )
由于长期以来采用密植和高水肥的栽培方式,小麦白粉病在世界范围内日趋严重。该病害由布氏白粉菌 (Blumeriagraminisf.sp.tritici,Bgt)引起,常年流行于我国各小麦主产区,严重影响小麦的产量和品质。发掘抗病基因、选育抗病品种是缓解小麦白粉病最经济有效的措施[1]。
目前,国内外已从小麦基因组中鉴定并正式命名了68个抗白粉病位点 (Pm1~Pm68)[2],并且有12个位点上的Pm基因已被克隆。其中,9个基因(Pm1[3]、Pm2[4]、Pm3[5]、Pm5[6]、Pm8[7]、Pm17[8]、Pm21[9]、Pm41[10]和Pm60[11])均为核苷酸结合位点(Nucleotide binding site,NBS)基因。NBS基因广泛存在于植物中,是数量最多的一类抗病基因,其编码蛋白通过结合三磷酸腺苷或三磷酸鸟苷来参与抗病信号传导,进而引发植株对病原菌的抗病反应[12]。水稻[13]、玉米[14]、大豆[15]等作物中的NBS序列已被分离。
2015年,Bouktila等[16]利用普通小麦品种中国春的第一代测序数据,首次分离了436条小麦NBS序列,并初步分析了家族保守域结构。随后,乔麟轶等[17]利用中国春第二代测序数据,从全基因组范围内分离了2 406条小麦NBS序列,分析了序列邻近的SSR位点,并在2AL染色体上筛选出3个可能与抗白粉病基因Pm4a连锁的NBS-SSR标记。上述研究成果为小麦基因组中NBS家族的分离鉴定奠定了基础,但尚未从转录组水平研究NBS对白粉菌的响应情况。
本研究利用小麦受白粉菌胁迫后的转录组数据[18]分析TaNBS家族的表达水平变化,并选择差异表达显著基因进行qRT-PCR和病毒诱导基因沉默(Virus-induced gene silencing,VIGS)验证,以期发掘抗白粉病相关TaNBS基因,为小麦抗病育种提供分子依据。
1 材料和方法
1.1 试验材料和菌株
小麦种质CH7124由作物遗传与分子改良山西省重点实验室提供。该种质由山西省农业科学院畅志坚研究员选育,对白粉菌生理小种E09表现为免疫[19]。白粉菌种E09由中国农业科学院段霞瑜研究员惠赠,由本实验室繁殖、保存。
1.2 试验方法
1.2.1 转录组数据分析 以注册号PRJNA243835检索SRA数据库(http://www.ncbi.nlm. nih. gov/sra/),下载小麦接种白粉菌后0,24,48,72 h的转录组数据。利用Tophat 2.0软件将reads比对到小麦参考基因组上(中国春TGACv1版本,http://tgac-browser.tgac.ac.uk/);之后用cufflinks组装转录本,并用edger获得转录本的FPKM(Expression fragment per kilobase of exon model per million mapped reads)值。
利用小麦NBS家族序列[17]从上述转录本中检索并筛选受白粉菌胁迫后表达量差异显著的TaNBS,筛选标准为log2|FPKMt/FPKMt0|≥1。所得结果用MeV软件输出。
1.2.2 白粉菌接种与鉴定 将CH7124播于育苗盘内,种子萌发后移入人工培养箱,设置22 ℃光照16 h/16 ℃黑暗8 h。待植株生长至三叶期,用扫拂法充分接种白粉菌种E09的分生孢子。并在接菌的0,24,48,72 h剪取植株叶片,于-80 ℃保存。
1.2.3 qRT-PCR 用RNA提取试剂盒 (DP420,天根生化,北京 )提取样品的总RNA,利用反转录试剂盒 (RR036A,宝生物,北京 )反转录cDNA。在罗氏Light Cycler®96-PCR仪上进行qRT-PCR,所用引物序列列于表1。使用的酶为SYBR Premix ExTaqⅡ(宝生物,北京 ),每个反应重复3次,所得结果采用Fold-change法进行分析。
1.2.4 大麦条纹花叶病毒 (BSMV)接种液制备 涉及的载体均购自北京信捷创辉生物科技有限公司。使用表1中的引物扩增目的基因片段,经测序验证后用无缝克隆试剂盒 (B632219,生工生物,上海 )将扩增产物连接到载体BSMV-γ上,将其与BSMV-α、BSMV-β线性化处理后用体外转录试剂盒(AM1340,Thermo Fisher,美国)进行体外转录。之后将上述BSMV-α、BSMV-β+BSMV-γ-目的片段、BSMV-γ的转录物各取10 μL混合,加入90 μL DEPC水和120 μL GKP Buffer,制成240 μL接种液。

表1 使用的qRT-PCR引物Tab.1 Primers for qRT-PCR used
1.2.5 小麦VIGS体系建立 当CH7124幼苗第2片叶展开时,滴加10 μL接种液并摩擦接种,之后保持湿润和黑暗24 h,移入正常生长环境,待第3片叶产生病毒斑表型,表明接种成功。当VIGS植株第4片叶展开时,剪取有病毒斑的叶片,一部分置于含有苯并咪唑的MS培养基上接种白粉菌E09,7 d后采用0~4级标准调查反应型[20],每个目的基因调查3株VIGS植株;另一部分样本提取总RNA,按照1.2.3描述的方法鉴定目的基因的表达水平。
1.2.6 基因序列分析 利用基因的表达序列比对小麦参考基因组(中国春IWGSCv1.0版本,http://wheat-urgi.versailles.inra.fr/)得到基因组序列,进而获得基因结构特征。将基因起始密码子前2 000 bp基因组序列递交PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/ )进行启动子元件分析。
2 结果与分析
2.1 转录组数据组装结果
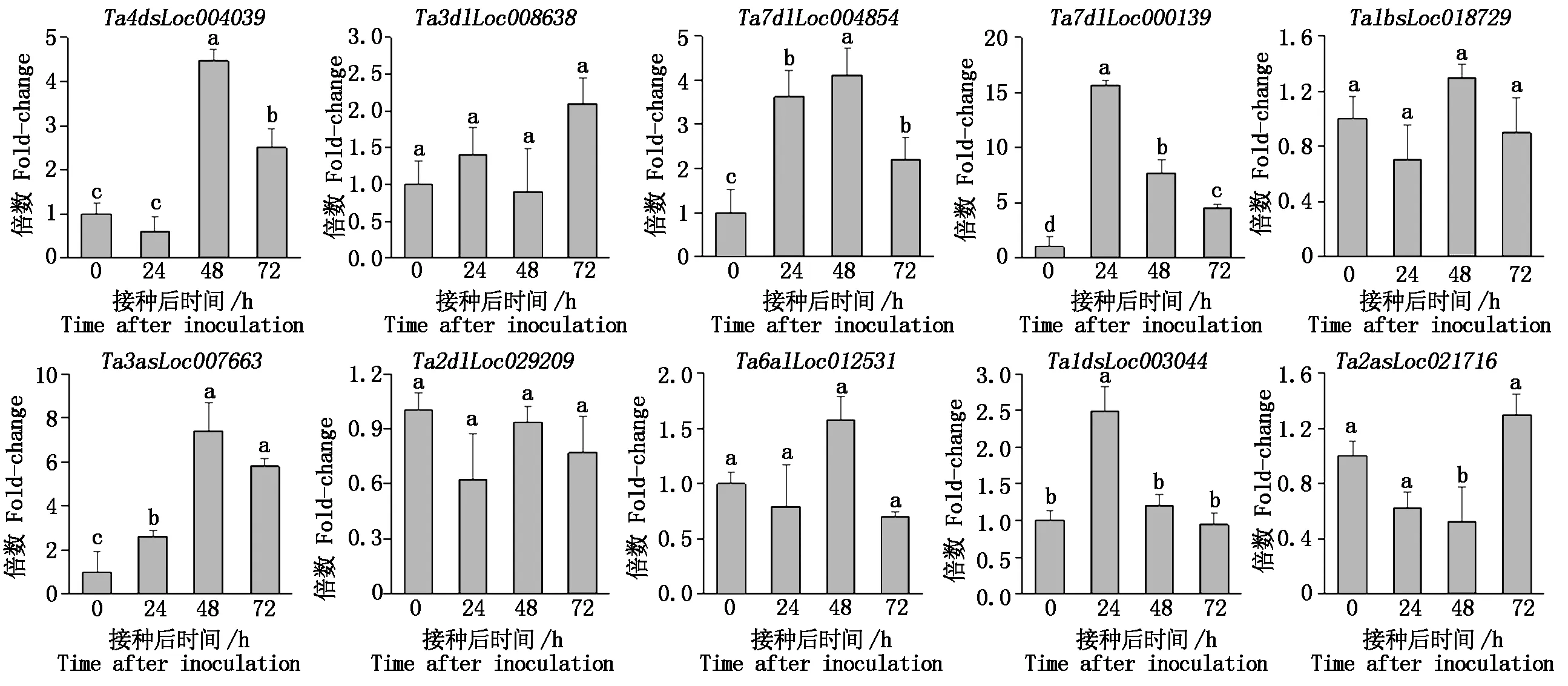
通过组装转录组数据,获得小麦在接种白粉菌4个时间点后的基因表达数据;根据FPKM值,将基因分为不表达 (FPKM=0 )、低表达 (FPKM≤2)、中表达(2 图1 小麦接种白粉菌后的转录组数据组装结果Fig.1 The assembly of transcriptome data for wheat after inoculation with Bgt 利用2 406条小麦NBS家族序列检索组装的转录组数据,共获得1 283条分布于21条染色体上的、具有表达数据的TaNBS(FPKM>0 ),占比53.3%;其中,在小麦4A和7D染色体上分布的TaNBS最多,各有101条,而4B和4D染色体分布较少,分别为16,15条 (图2)。 图2 具有表达数据的TaNBS在染色体上的分布Fig.2 Distribution of TaNBSs with expression data on wheat chromosomes 基于差异显著性分析,进一步筛选出395条接种Bgt后表达水平变化显著的TaNBS基因,这些基因可大致分为5类,第1类在接种后24 h内表达水平降低,之后持续升高;第2类在接种48 h内表达水平升高,之后下降;第3类在3个时间点表现出升-降-升的变化趋势;第4类在接种48 h内表达水平降低,之后上升;第5类在接种后持续上升(图3)。 图3 小麦接种白粉菌E09后表达水平变化差异显著的TaNBSFig.3 TaNBSs with significant changes in expression levels after inoculation with Bgt 从上述第5类基因中选择10个表达水平变化差异最为显著的TaNBS进行qRT-PCR验证,有3个基因在接种白粉菌24,48,72 h均保持上调,与转录组数据一致。其中,位于7D染色体的Ta7dlLoc004854在接种24,72 h显著上调(P<0.05),48 h显著上调(P<0.05);同样位于7D染色体的Ta7dlLoc000139在接种24,48,72 h均保持显著上调(P<0.05),但上调倍数呈下降趋势;而位于3A染色体的Ta3asLoc007663在接种24 h显著上调(P<0.05),48,72 h显著上调(P<0.05)(图4)。 其余基因的表达水平变化与转录组不一致。Ta4dsLoc004039在接种24 h 无显著变化,在48 h呈极显著(P<0.01)上调,随后在72 h显著下调(P<0.05);Ta1dsLoc003044仅在24 h显著上调(P<0.05);Ta2asLoc021716仅在72 h显著上调(P<0.05);Ta3dlLoc008638、Ta1bsLoc018729、Ta2dlLoc029209和Ta6alLoc012531的表达水平无显著变化(图4)。 使用倍数法分析表达数据,设0 h为对照;不同小写字母代表显著差异,P<0.05。图5同。The expression data are processed by the Fold-change method setting 0 h as control;different lowercase letters represent significant differences,P<0.05.The same as Fig.5. 利用BSMV侵染CH7124植株,分别诱导Ta7dlLoc004854、Ta7dlLoc000139和Ta3asLoc007663的表达水平下调,获得VIGS植株;qRT-PCR结果显示,VIGS植株中Ta7dlLoc004854、Ta7dlLoc000139和Ta3asLoc007663的表达水平与对照植株相比显著下调(图5)。剪取VIGS植株第4片叶进行离体接种白粉菌E09,结果如表2所示,VIGS植株BSMV-Ta7dlLoc004854和BSMV-Ta3asLoc007663对E09表现为免疫(IT=0),与未侵染BSMV的CK植株表型一致;而VIGS植株BSMV-Ta7dlLoc000139的叶片上出现零星孢子,其中,2株表现为高抗(IT=1),1株表现为中抗(IT=2)。推测Ta7dlLoc000139表达水平的降低引起了植株抗性减弱(图5)。 表2 VIGS植株离体接种白粉菌E09的反应型Tab.2 The infection type of VIGS plants inoculated with Bgt race E09 in vitro 序列分析表明,Ta7dlLoc000139全长4 042 bp,包含3个外显子和2个内含子,无可变剪切;在其起始密码子前2 000 bp区域内包含大量CGCG-Box、GATA-Box和CAAT-Box等调控元件,显示该基因的表达可能受到调控(图6)。 CK.未侵染BMSV的植株;1~3.侵染BMSV的植株。CK and number 1 to 3 refer to plants not inoculated and inoculated with BMSV,respectively. 图6 Ta7dlLoc000139的基因结构和启动子区调控元件预测Fig.6 Gene structure and prediction of regulatory elements in promoter region of Ta7dlLoc000139 鉴定抗病基因用于品种选育可有效缓解小麦白粉病病害。一些抗白粉病基因如Pm2、Pm8和Pm21,已成功应用于小麦生产。然而,由于小麦白粉菌种致病型多且变异快,大多数抗病品种在推广应用5 a左右会逐渐丧失抗性[21]。因此,广泛、持续地发掘小麦抗白粉病基因尤为重要。NBS基因在植物抵御病原菌入侵过程中发挥重要作用。目前,小麦全基因组中的NBS序列已被分离[16-17],但有关NBS家族基因受白粉菌侵染后转录水平变化的研究尚未见报道。本研究从小麦转录组数据中分离了1 283条具有表达水平的NBS序列,约有46.7%的NBS基因未表达,可能是由于其表达具有时期或组织特异性,或者受其他病原菌诱导,或者一些基因已经是失去功能的假基因,显示了多倍体物种中基因家族功能的复杂性。 由于已克隆的9个NBS类抗白粉病基因在受白粉菌侵染后均持续上调[3-11],本研究从转录组数据中选择受侵染24,48,72 h后表达水平均持续上调并且差异最大的10个TaNBS进行qRT-PCR验证,最终获得3个受白粉菌诱导的TaNBS。其中,Ta3asLoc007663位于小麦3A染色体,与抗白粉病基因Pm44[22]均位于短臂;而Ta7dlLoc004854和Ta7dlLoc000139所在的7D染色体尚无正式命名的Pm基因,目前只有TaRPP13-3被报道[23]。TaRPP13-3属于NBS家族,同样对白粉菌种E09表现为抗病,但是该基因位于7D短臂18 Mb的基因组位置,而Ta7dlLoc004854和Ta7dlLoc000139分别位于长臂717,632 Mb位置,不是同一基因。因此,Ta7dlLoc004854和Ta7dlLoc000139可能是2个新的白粉菌响应基因位点。 本研究利用VIGS技术下调Ta7dlLoc000139后,植株抗病性减弱,表明Ta7dlLoc000139与抗病性相关,可能是一个抗白粉病基因。该基因启动子区包含大量的调控元件,推测其表达水平会受到转录因子或者上游基因的调控。后续研究将利用遗传转化等技术对Ta7dlLoc000139进行功能验证,如最终证实其为抗白粉病基因,将为小麦抗病分子育种提供新的抗源。 本研究从小麦转录组数据中分离了395个差异表达TaNBS基因,利用qRT-PCR证实3个TaNBS在小麦抗病材料CH7124中受Bgt胁迫后持续上调,其中,Ta7dlLoc000139经VIGS下调后,植株抗性从免疫(IT=0)变为高抗(IT=1)或中抗(IT=2),推测Ta7dlLoc000139是1个新的抗白粉病基因。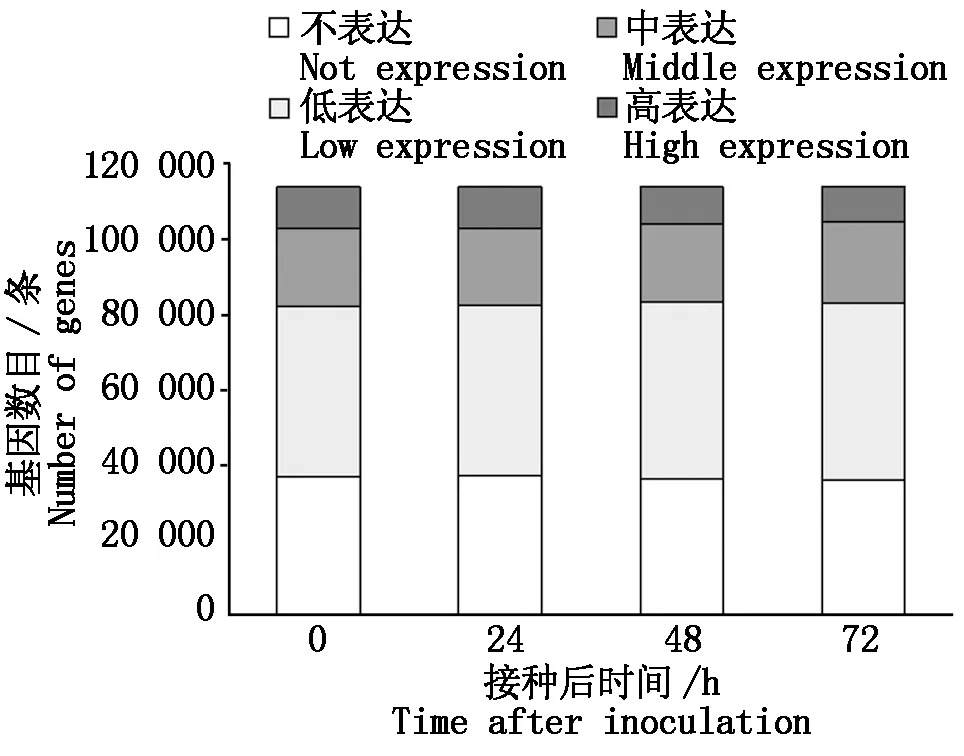
2.2 NBS序列的分离

2.3 TaNBS对白粉菌的响应

2.4 TaNBS的qRT-PCR验证
2.5 TaNBS的VIGS验证

2.6 Ta7dlLoc000139序列特征


3 结论与讨论
