马铃薯鲜粉污染菌的分离鉴定及抑制物筛选
2022-01-10魏雄博白永宏鲍壹江王亚洁任建芳陈国梁1b
魏雄博,白永宏,鲍壹江,王亚洁,刘 乾,任建芳,陈国梁,1b
(1.延安大学,a.生命科学学院;b.陕西省红枣重点实验室,陕西 延安 716000;2.延安职业技术学院,陕西 延安 716000)
在中国,粉条有千余年的加工历史,其含有丰富的碳水化合物、膳食纤维、蛋白质及钙、镁、铁、钾、磷、钠等矿物质,口感爽滑、老少皆宜,有和胃、健脾、益气之功效,深受广大消费者喜爱,在大众饮食中占据十分重要的地位[1,2]。但是干粉在食用时要提前浸泡,食用不便,与现代快节奏生活不相适应。冷鲜淀粉食品近年来在超市中越来越多见,在各大城市中鲜粉条也正在被消费者所接受,但鲜粉因其高水分,易发生变质,而保质期短,致使其销售半径小,货架期短,对产品的生产、销售及安全食用带来了不利的影响[3]。因此,探究引起鲜粉变质的菌类并找到相应的抑制物,对于其生产、销售具有重要的指导意义,而有关这方面的研究鲜见报到。为了筛选出合适的抑菌物,根据以往文献报道及前期研究的结果,筛选出柑橘精油、八角茴香精油、双乙酸钠和山梨酸钾4种抑菌物。植物精油这一天然保鲜剂其抗氧化性、抑菌活性常用于延长食品的保鲜及食品口感、风味的改良[4,5],研究表明柑橘精油和八角茴香精油有良好的杀菌、杀虫、抗氧化等生物活性[6-9],从而能够保护食品免受氧化变质,而且其食品安全性已经获美国食品药品管理局准许应用于食品领域[10]。双乙酸钠和山梨酸钾是新型高效的防霉、防腐剂,且无毒副致癌、致病因素,已经被广泛应用于国内外食品工业[11-14]。本研究开展马铃薯鲜粉中易染菌分离鉴定及抑制物筛选研究,以期为鲜粉条产业发展奠定一定的理论基础。
1 材料与方法
1.1 主要材料与试剂
各种污染变质的真空包装马铃薯鲜粉,由陕西省榆林市定边县润泽署业开发有限公司提供;2种已鉴定保藏的马铃薯鲜粉易染菌种(芽孢杆菌属、埃希氏菌属),由延安大学生命科学学院提供。
双乙酸钠、山梨酸钾均为食品级,上海罗恩试剂有限公司;PCR试剂盒,北京康为世纪生物科技有限公司;八角茴香及柑橘,购于农贸市场。
1.2 试验方法
1.2.1 细菌分离纯化 在无菌环境下取一定量的各类污染变质鲜粉条,剪碎、加无菌生理盐水充分摇晃,作为污染菌原液,然后接种到牛肉膏蛋白胨琼脂培养基上,在28℃下恒温培养24~48 h。从中挑选出生长形态和颜色不同的单菌落,再在牛肉膏蛋白胨琼脂培养基上进行划线、分离纯化。重复试验,直至获得单一菌落为止。
1.2.2 菌株的鉴定
1)生理鉴定。根据菌落形状、色泽等外在形态,初步筛出单菌落,并采用革兰氏染色法进行染色后在显微镜下观察鉴定[15]。
2)16SrDNA PCR扩增。将筛选出的单菌落培养至对数期作为扩增模板,扩增引物27F(5’-AGAGTTTGATCCTGGC TCAG-3’)、1492R(5’-GG⁃TACCTTGTTACGACTT-3’)[16]。PCR反应体系(25 μL):DNA模板2.5μL,Taq酶0.5μL,Buffer 2.5μL,dNTP 2μL,引物各1μL,ddH2O 15.5μL。PCR反应程序:95℃预变性5 min,95℃变性50 s,55℃退火50 s,72℃延伸1 min 30 s,30个循环,72℃补充延伸10 min,4℃保存。使用1%琼脂糖凝胶电泳检测,并对特异性扩增条带进行回收,将扩增产物交西北大学太白校区国家微生物检测中心测序。
3)系统发育树构建。获得DNA序列后,在NC⁃BI网站上(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行核酸数据比对分析,并用MEGA 5.0软件构建系统发育树[17],对其进行归类。
1.3 抑菌试验
1.3.1 抑菌物的筛选及制备 八角茴香精油粗提物的制备:取一定量干八角茴香于圆底烧瓶中加入去离子水(料液比1∶7),在160 W功率下微波提取30 min,得到无色挥发油,用无水Na2SO4干燥,4℃储藏备用[18]。
柑橘精油粗提物的制备:将新鲜橘皮洗净、烘干、粉碎,称取一定量置于蒸馏瓶中,加去离子水(料液比1∶16)及适量NaCl作为萃取助剂[19],提取2.5 h,将收集的馏出物经由石油醚萃取后水浴除去石油醚,即柑橘精油粗提物。
将2种精油粗提物、双乙酸钠、山梨酸钾,按照质量分数配成10%、20%、30%、40%、50%浓度梯度溶液,其中精油粗提物用无水乙醇作溶剂,双乙酸钠和山梨酸钾用无菌去离子水作溶剂。
1.3.2 抑菌效果的测定 采用滤纸片法测定抑菌效果,以十字交叉法测量抑菌圈大小。用无水乙醇、无菌去离子水做空白对照。抑菌圈直径(mm)=样品抑菌圈直径-空白对照,3次重复试验,取平均值。
2 结果与分析
2.1 菌株的鉴定
2.1.1 菌株的生理鉴定 对分离出的菌株经过形态学观察、革兰氏染色,初步筛选获得4种菌株,分别为L-1、L-2、L-3和L-4。由表1可知,L-1菌落颜色为粉红色,L-2菌落颜色为淡黄色,L-3和L-4菌落颜色为乳白色。L-1、L-2、L-4三株菌为杆状菌,L-3为球状菌。4种菌株菌落均不透明,且都为革兰氏阳性菌。

表1 4种菌株形态及理化特征
2.1.2 菌落PCR鉴定 以细菌的通用引物27F和1492R作为上下游引物,对马铃薯鲜粉贮藏期分离出的4株病原细菌的16s rDNA进行扩增,扩增得到的电泳检测结果只得到了L-2菌株的清晰稳定条带,片段约为1 500 bp(图1)。

图1 L-2菌株16Sr DNA电泳图谱
2.1.3 16SrRNA序列比对 将得到的测序序列用DNA-MAN软件进行拼接,得到所测样本的DNA序列后,在NCBI网站中进行BLAST蛋白质序列比对。经序列比对,该序列与多条已知的短小杆菌属(Cur⁃tobacterium)序列同相似性达到了99%~100%(表2),根据16SrRNA序列相似性达到99%以上则认为是同一个种[20],由此可以初步判定该DNA序列所代表的细菌L-2为短小杆菌属。根据序列的对比结果,利用MEGA 5.0软件建立系统发育树,进行系统发育学分析[21]。从图2可以看出,该菌隶属于短小杆菌属分支,这与序列比对分析结果一致。

图2 L-2菌株根据16Sr DNA序列构建的系统育树
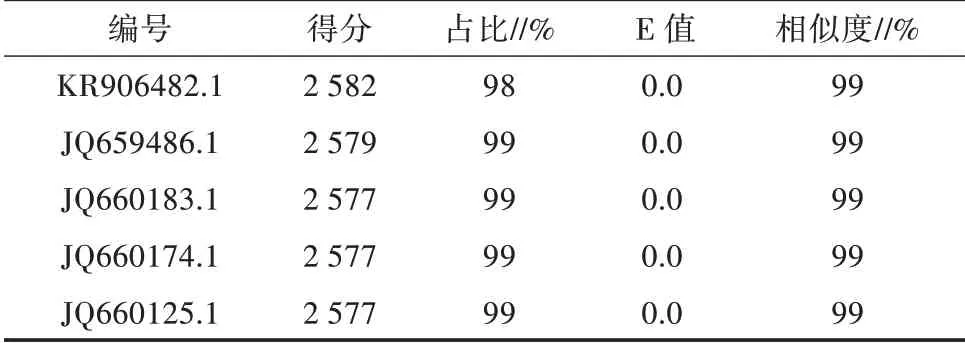
表2 L-2菌株DNA BLAST对比结果
2.2 添加物的抑菌效果
通过滤纸片法用短小杆菌属(C-1)、埃希氏菌属(E-2)、芽孢杆菌属(B-3)测试5种不同浓度的添加物抑菌效果。由表3可知,添加物溶液浓度与抑菌效果密切相关,4种抑菌物对3种菌的抑制圈直径都随着抑菌物浓度增加而增大,其中同等浓度下双乙酸钠对3种菌抑制效果最好。八角茴香精油、柑橘精油对于短小杆菌属的抑制作用随浓度增加提升较小,双乙酸钠和八角茴香精油对埃希氏菌属抑制效果随着浓度增加抑制效果增幅较大。4种抑菌物对病原菌抑菌效果依次为双乙酸钠>八角茴香油>山梨酸钾>柑橘精油。
3 小结
从污染的马铃薯鲜粉中筛选得到一株病原菌,经过16SrDNA分子鉴定并建立系统发育树鉴定该菌属于短小杆菌属(Curtobacterium)。而污染马铃薯鲜粉的病原菌可能与加工方式、包装技术、保藏时间等有关系[22,23],所以引起马铃薯鲜粉污染的菌株种类、数量有待进一步分离鉴定。经过抑菌圈数据对比,同等浓度下双乙酸钠对供试的3种易染菌的抑菌圈平均直径均大于其他3种抑菌物,其作为天然抑菌剂有比较好的研究前景,可进一步作为添加物进行鲜粉保鲜贮藏试验。
