分子对接、CRISPR/Cas9 技术筛选并验证DNA ligase IV 抑制剂
2022-01-08肖红卫
肖红卫
(动物胚胎工程与分子育种湖北重点实验室/湖北省农业科学院畜牧兽医研究所,武汉 430064)
分子对接技术可以有效地分析“蛋白-配体”的互作难题,正成为药物重新定位的有利工具。而作为新近发展的基因工程技术,CRISPR/Cas9 作为功能基因组学方法可以克服药物开发的限制。如何联合使用这两个技术进行药物筛选还尚未见报道。
基因编辑技术可以很方便地在DNA 链上产生DSB,并利用DNA 修复中的NHEJ 机制,在靶基因座位上产生突变;或者利用DNA 修复中的HDR 机制,把目的基因定点插入靶基因座位。该技术克服了传统转基因技术的整合随机、遗传不稳定等缺陷,具有很大的应用前景。尤其是在利用DNA 修复中的HDR 机制把目的基因定点插入靶基因座位的研究上,比如乳腺特异表达基因区、输卵管特异表达基因区或者血液白蛋白基因区,使畜牧业产生高附加值的蛋白[1]。由于在DNA 修复中NHEJ 与HDR的竞争,导致HDR 效率比较低,科学家们竞相筛选各种小分子化合物以期能够抑制NHEJ 通路依赖的DNA连接酶IV 活性,从而提高DNA 修复通路中的HDR效率[1]。
本研究通过用MSTN基因T11 位点序列截断的Firefly Luciferase 荧光素酶报告载体结合CRISPR/Cas9-gRNA-T11 载体共转细胞,并根据分子对接的结果筛选与SCR7 作用类似的小分子化合物,接着检测各个孔中Firefly Luciferase的量,没有用小分子化合物处理时,萤火虫荧光素酶被截断的位置发生NHEJ 修复,不能得到大量有活性的萤火虫荧光素酶;经过小分子化合物处理,抑制了细胞内的NHEJ,提高了HDR 效率,能得到大量有活性的萤火虫荧光素酶。以期筛选到DNA ligase IV的抑制剂,为下一步研究奠定基础。
1 材料与方法
1.1 试验设计
如图1 所示,设计3 个试验。
试验1:在萤火虫荧光素酶基因(Firefly Luciferase)中插入终止信号以及克隆自MSTN基因上可以被gRNA 识别的序列(以下命名为T11 位点)以截断萤火虫荧光素酶基因。用该载体在细胞上进行转染试验并对荧光素酶进行检测,此时,应该检测不到萤火虫荧光素酶。
试验2:把上述构建的荧光素酶报告载体与CRISPR/Cas9-T11 gRNA 载体进行混合转染,T11 gRNA 引导Cas9 蛋白切割萤火虫荧光素酶报告载体中截断萤火虫荧光素酶基因的终止信号后的T11 序列以产生DNA 断裂,并利用细胞自身的DNA ligase IV 对CRISPR/Cas9 引入的DNA 断裂进行修复。再对荧光素酶进行检测,此时检测到的萤火虫荧光素酶的量与正常状态下的DNA 修复关联,反映了单位时间内NHEJ依赖的DNA ligase IV的活力。
试验3:萤火虫荧光素酶报告载体与CRISPR/Cas9-T11 gRNA 载体进行混合转染后,在细胞培养基中添加筛选出来的小分子化合物,再对荧光素酶进行检测,此时检测到的萤火虫荧光素酶的量与受抑制条件下的DNA 修复关联,反映了单位时间内受抑制条件下NHEJ依赖的DNA ligase IV的活力。
通过3 个试验,验证所筛选出的小分子对DNA连接酶IV的抑制作用。
1.2 Firefly Luciferase 报告载体的设计
试验中所用的载体来自Akhtar Ali 博士,得到毕延震的授权使用。根据北京唯尚立德生物科技有限公司VK002SSA 活性报道质粒构建试剂盒说明书,在萤火虫荧光素酶的中间插入终止序列以及MSTN基因中的能被gRNA(GGCUGUGUAAUGCAUGUA UG)识别的位点序列(GGCTGTGTAATGCATGTATGTGG,本研究团队内部命名为T11 位点)。如图2所示。
1.3 CRISPR/Cas9 载体设计
pX330-hSpCas9 载体购自Addgene,将图2 中的MSTN T11 gRNA克隆进pX330-hSpCas9 载 体U6 启动子后面。
1.4 抑制剂的虚拟筛选
在本研究中,结合了基于对接的虚拟筛选方法,从前期建立的数据库中筛选DNA ligase IV 小分子抑制剂。已知SCR7 对DNA ligase IV 有抑制作用,因此在本研究中仅需寻找类似SCR7的能够与DNA ligase IV 结合的小分子化合物。筛选小分子化合物的策略如图3 所示。

图3 基于虚拟筛选策略
采用ACD ChemSketch 软件建一个小分子化合物库,用Accelrys Discovery Studio 2.5 软件进行虚拟筛选各个小分子与DNA ligase IV的互作,并从中找出与SCR7 作用类似的小分子化合物,结合实验室保存的各个小分子化合物,优选出SCR7、nocodazole、Fisetin 和Methylene blue 4 种小分子化合物进一步试验验证。虚拟筛选结果如图4 所示。
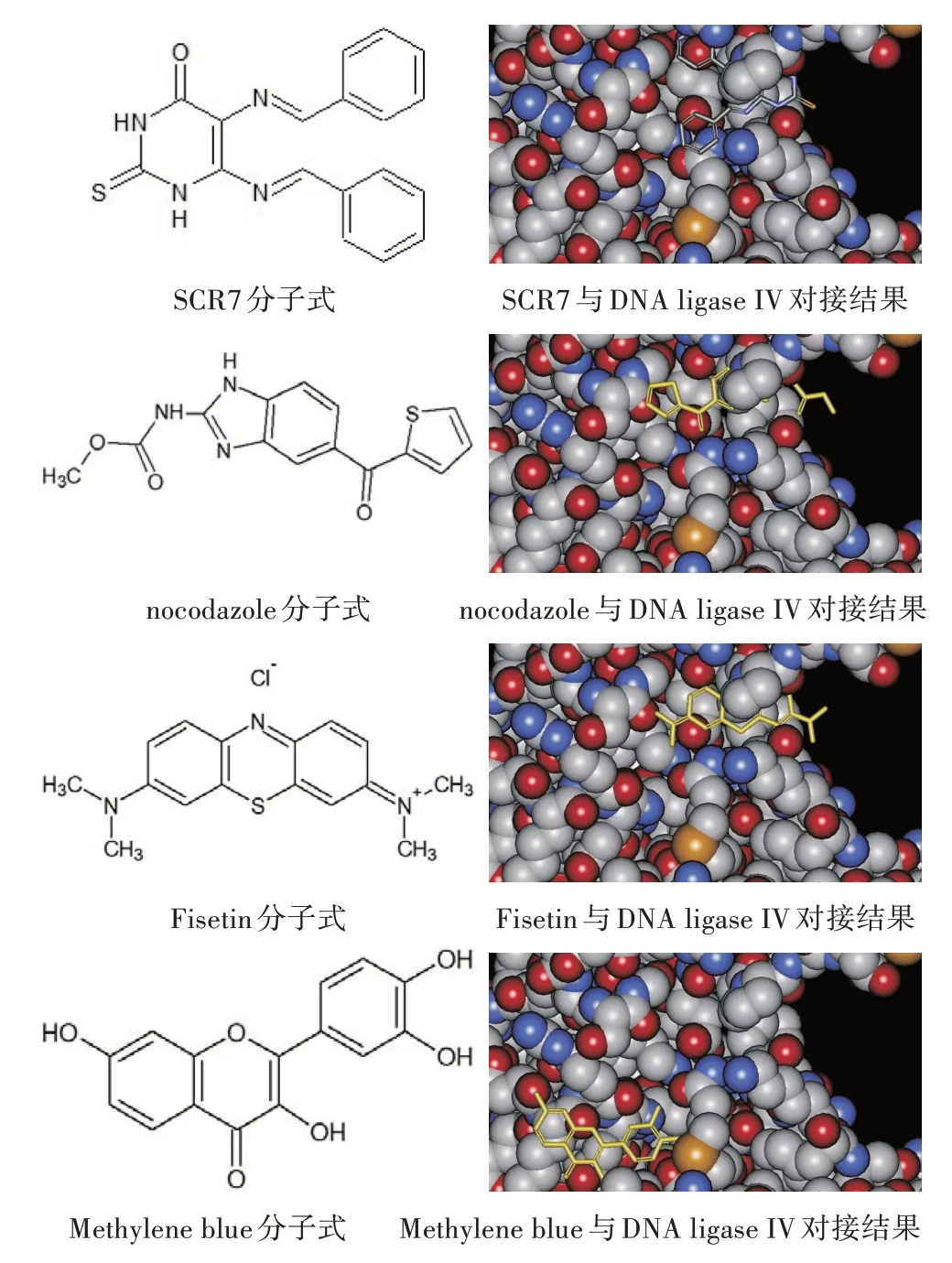
图4 抑制剂的虚拟筛选结果
1.5 细胞培养
HEK-293 细胞接种于96 孔板(2×104个/孔),每孔用DMEM+10% FBS 培养基500 μL,在5% CO2和95%空气、100%湿度的培养箱中培养,待细胞培养至70%的汇合度时,用Lipofectamine 3000 转染试剂将萤火虫荧光素酶报告载体质粒、CRISPR/Cas9-T11 质粒共转入HEK-293 细胞。转染6 h 后再加入小分子化合物(终浓度为10 μmol/L[2])处理24 h。
1.6 萤火虫荧光素酶检测
移去培养基上清,加入1×DPBS 清洗培养细胞,反复洗2 次,去掉清洗液,加入裂解液,将培养板在室温下轻缓晃动15 min 后把裂解液转移到检测离心管中。
取各个样品20 μL 加入到1.5 mL 离心管中,剩余样品保存到4 ℃备用。在样品中加入10 μL LARⅡ溶液,在Promega Modulus™单管型多功能检测仪上检测Firefly Luciferase。试验重复3 次。
2 结果与分析
在本试验中,参考Li 等[2]所用的SCR7 工作浓度,取试验浓度的下限值,避免细胞周期的影响。双荧光素酶检测结果如图5 所示。

图5 筛选出的小分子化合物验证结果
图5 用SSA-Luc 载体和CRISPR/Cas9 载体混转后,不加SCR7 处理后的检测结果是116.7,添加SCR7 处理后的检测结果是318。用1562 载体和CRISPR/Cas9 载体混转后,不加SCR7 处理后的检测结果是10 120,添加SCR7 处理后的检测结果是41 905.3,添加SCR7 后可以提高DNA 修复中的HDR效率3.14 倍。用1562 载体和CRISPR/Cas9 载体混转后,依次使用nocodazol、Methylene blue和Fisetin处理后的检测结果分别是65 256.3、53 713和77 058.3。
结果显示,添加小分子化合物SCR7、nocodazole、Fisetin 和Methylene blue 处理后,用Promega Modulus™单管型多功能检测仪分别检测萤火虫荧光素酶的量,萤火虫荧光素酶的表达量均得到了提高,荧光素酶的量直观地反映了这类小分子化合物对DNA ligase IV的抑制作用,没有小分子化合物参与的情况下,荧光素酶的量接近于本底,结果证明经过小分子化合物处理后基因编辑的效率提高了,验证了本试验设计的的成功。
3 讨论
CRISPR/Cas9 产生的DSB 被Ku70/Ku80 异二聚体识别后,该异二聚体结合在DSB两侧的DNA 末端,并活化DNA 依赖性蛋白激酶(DNA-PK)的催化亚基。DNA-PKcs 与Ku70 和Ku80 以及DNA 连接酶IV/XRCC4 复合物一起完成对DSB的修复[3,4]。作为NHEJ竞争通路的HDR 在细胞内的效率很低(<5%),大部分DSB 都由NHEJ 修复完成,因此,科学家们大都从DNA ligase IV 着手,从DNA ligase IV 基因的转录产物着手,利用siRNA 技术降低DNA ligase IV的表达量;或者从DNA ligase IV 蛋白着手,利用抑制剂或者靶向降解药物降低DNA ligase IV的活性或者细胞内DNA ligase IV的量,以期降低NHEJ 效率的同时提高HDR 效率。
Song 等[5]发现,NHEJ 抑制剂SCR7 可以提高2.3%的基因编辑效果。Srivastava 等[6]发现SCR7 可以抑制DSB 在无细胞修复系统中的连接。Maruyama 等[7]研究发现,SCR7的处理提高了HDR介导的基因组编辑效率,在对多个基因进行检测时,使用SCR7 处理最高可以提高基因编辑效率达19倍,并发现SCR7 处理适用于具有足够保守的NHEJ和HDR 机制的非哺乳动物细胞。Vartak 等[8]也发现,SCR7 通过抑制NHEJ 显著提高了精确基因组编辑的效率,并且在体外和体内均有利于无错误的同源重组途径。Chu 等[9]使用了抑制剂SCR7 将HDR的效率提高了4~5 倍。Ma 等[10]研究发现,与NHEJ途径相比,CRISPR/Cas9 介导的HDR 指导的精确遗传修饰效率相对较低,通过添加SCR7 来抑制DNA ligase IV 从而抑制NHEJ,可以增加HDR 介导的精确遗传修饰效率。Hu 等[11]研究发现,在使用ssODNs作为模板时,与没有SCR7 处理的细胞相比,SCR7 处理使转染细胞中的靶向插入效率提高了3 倍。而Lin 等[12]研究发现,将抑制剂SCR7 引入CRISPR/Cas9 系统促进了HSV-1 基因组中HDR 介导的基因置 换。Li 等[2]研究发现,小分子化合物SCR7、L755507 和白藜芦醇可使猪胎儿成纤维细胞的HDR效率提高2~3 倍。当用同源模板DNA 和CRISPR/Cas9 质粒转染并用小分子处理时,具有大DNA 片段整合的敲入猪胎儿成纤维细胞系的比率可以达到筛选细胞集落的50%以上,而用DMSO 处理的细胞组中敲入率为26.1%。经过对接试验发现,在DNA ligase IV 上存在可以结合DNA 以及SCR7 分子的结构域,并推测可以利用该结构域通过虚拟对接技术来筛选DNA ligase IV的抑制剂,筛选出来的小分子化合物可以用于提高基因编辑效率的试验验证。
根据Li 等[2]所用的小分子化合物与DNA ligase IV 结合的区域进行筛选,把虚拟筛选结果结合自建小分子化合物库筛选出来nocodazole、Fisetin、Methylene blue 等3 个SCR7 功能类似物。经过验证,这3个小分子化合物均可以实现抑制DNA ligase IV 活性的功能,为下一步研究奠定基础。
