高铁酸钾改性生物炭的制备及其对水体中Cd(Ⅱ)的吸附特性
2022-01-07王亚琢周翔修磊单锐袁浩然
王亚琢 ,周翔,修磊,单锐 *,袁浩然
1. 中国科学院广州能源研究所,广东 广州 510640;2. 南方海洋科学与工程广东省实验室(广州),广东 广州 511458;3. 山东高速鸿林工程技术有限公司,山东 济南 250014;4. 山东高速绿色生态发展有限公司,山东 济南 250014;5. 佛山市科恒博环保技术有限公司,广东 佛山 528225
近年来,电镀、采矿和电池制造等行业的发展导致了重金属镉(Cd(Ⅱ))的大量排放(Wang et al.,2019)。根据世界卫生组织的标准,镉是毒性最高的重金属之一,镉过度被人体摄入会导致骨骼和肾脏损害(Moynihan et al.,2017;Liu et al.,2018;王道涵等,2020)。因此,迫切需要有效的处理废水中的Cd(Ⅱ)的方法防止其对人体的危害。
目前,已经有多种受镉污染的废水处理技术,以减少重金属对环境的毒性,例如吸附、膜分离、超滤和电动修复等。在这些技术中,吸附技术由于其经济性、有效性、技术可行性以及可以从水中分离回收重金属受到了广泛关注(Ofomaja et al.,2010)。在众多吸附剂中,生物炭是一种廉价的富含碳的材料(Hansen et al.,2010;Zhang et al.,2016;郭琳颖等,2020),可在无氧或缺氧的条件下对生物质进行热解生产(Huang et al.,2017)。生物炭由于可塑性较强,可以在其表面获得较大的比表面积和多孔结构以及丰富的表面官能团(Yao et al.,2011;李佳霜等,2019),是有效的污染物吸附剂(Tan et al.,2015;Wongrod et al.,2018)。另外,由于大多数生物炭表面带负电(Fang et al.,2014),其去除Cd(Ⅱ)水溶液的能力可能相对较弱(Luo et al.,2018)。因此,学者们开发了多种改性方法以增强生物炭的吸附能力(Zhang et al.,2018;Khan et al.,2019;Wang et al.,2019;Liu et al.,2021;Xiang et al.,2021)。其中,铁(Fe)与其他金属的复合氧化物是常见生物炭的改性剂,由于其改性后的生物炭含氧官能团增多,且具有磁性,有利于生物炭对有害化学物质的吸附,以及便于吸附剂的回收而被应用于水中重金属的去除(Zhang et al.,2019)。例如,Yang et al.(2021)采用Fe/Zn复合氧化物改性的生物炭去除水中的 Cd(Ⅱ),主要的吸附机理是 Cd(Ⅱ)与碳酸盐沉淀,以及与含氧官能团的配位络合物;Yin et al.(2020)采用Fe-Mn改性生物炭吸附剂并研究了去除 Cd(Ⅱ)的能力和机理,研究表明,Fe/Zn生物炭表面上的CO32−、Fe-O、Zn-O 和含氧官能团与 Cd(Ⅱ)沉淀出 CdCO3、Cd(OH)2和CdO。
高铁酸钾(K2FeO4)是一种强氧化剂,具有有效氧化各种有机和无机化合物的能力,不仅可以作为磁性氧化铁的前驱体,而且可以作为氧化生物炭表面的改性剂(Hu et al.,2020;Yin et al.,2020)。因此,高铁酸盐可以直接制备高性能磁性生物炭,而无需额外的改性剂。然而,高铁酸盐改性生物炭复合材料尚未被应用于水中Cd(Ⅱ)的去除,而且,其吸附可行性和机理也不清楚。本研究合成了一种高铁酸钾改性磁性生物炭吸附剂(Fe-BC纳米复合材料),分析了溶液pH、吸附时间、初始浓度和吸附剂剂量等各种实验条件对其吸附的影响,并研究了Cd(Ⅱ)在Fe-BC纳米复合材料上吸附的机理。研究结果将有助于开发针对 Cd(Ⅱ)污染水的去污技术,对于污水重金属有效处理具有一定意义。
1 材料与方法
1.1 实验材料
花生壳(购于广东省广州市市场)、K2FeO4、Cd(NO3)2·4H2O、去离子水(AR,上海麦克林生化科技有限公司)。
1.2 生物炭的制备及改性
将花生壳清洗干净后置于烘箱内,105 ℃烘干至恒重后取出,冷却至室温后分别粉碎处理并过筛,将样品置于密封袋备用。将处理好的花生壳取1 g于烧杯中,然后加入6 g K2FeO4,并加入10 mL去离子水,放置于磁力搅拌器上搅拌24 h。将混合样品过滤烘干后放入管式炉中,在N2的惰性气氛下,控制仪器的升温速率为 10 ℃·s−1,在500 ℃的热解温度下热解2 h,制得K2FeO4改性生物炭(Fe-BC)。用去离子水反复洗涤至中性,并在60 ℃下干燥至恒重,将处理过的生物炭冷却研磨后密封保存,待用。为了对比生物炭改性前后的吸附性能,以未加入K2FeO4的条件下制备的生物炭(BC)作为对照。
1.3 生物炭的表征
选用场发射扫描电镜-能谱分析(scanning electron microscopy,SEM)(S-4800,日本日立)分析BC和Fe-BC表面形表特征;X射线衍射XRD(X’Pert Pro MPD,PANalytical(帕纳科))用于分析吸附剂晶体结构;傅立叶红外光谱 FTIR(TENSOR27,布鲁克)和X射线光电子能谱XPS(ESCALAB 250Xi,赛默飞世尔(中国)有限公司)研究其官能团种类与含量以分析其吸附机制;金属浓度分析仪ICP-OES(OPTIMA 8000型,珀金埃尔默仪器(上海)有限公司广州分公司)检测溶液中Cd(Ⅱ)质量浓度。
1.4 吸附试验
含 Cd(Ⅱ)溶液的配制采用逐级稀释法,先将Cd(NO3)2·4H2O溶于去离子水中,配制质量浓度为400 mg·L−1的 Cd(Ⅱ)溶液,后面根据具体实验再稀释至所需浓度。
1.4.1 初始浓度对吸附的影响
取10 mL质量浓度为20、40、65、100、150、200、300 mg·L−1的 Cd(Ⅱ)溶液于 15 mL 的离心管中,加入40 mg制备的Fe-BC,pH调至6。
1.4.2 pH值对吸附的影响
用 1 mol·L−1的 NaOH 和 HCl调节 200 mg·L−1Cd(Ⅱ)溶液 pH 分别为 3、4、5、6、7。
1.4.3 吸附剂质量对吸附的影响
吸附剂用量对 Cd(Ⅱ)吸附行为的影响实验设置吸附剂的添加量分别为20、40、60、80 mg。
1.4.4 吸附动力学实验
取初始质量浓度为 200 mg·L−1的 Cd(Ⅱ)溶液10 mL,调节pH=6,加入20 mg Fe-BC,设置吸附时间梯度为10、30、60、90、120、240、420 min,测定吸附后的Cd(Ⅱ)质量浓度。
1.4.5 吸附等温线实验
分析取10 mL梯度质量浓度为20、40、65、100、150、200、300 mg·L−1Cd(Ⅱ)溶液,加入 20 mg Fe-BC,调节pH=6,吸附时间设置为240 min。
1.5 数据处理方法
吸附量和去除率计算方法:
生物炭对污染物的吸附效果用吸附量 qe和去除率E来表示,其计算公式分别为

式中:
吸附达到平衡时,吸附量和污染物质量浓度分别用 qe(mg·g−1)和 ce(mg·L−1)表示;
c0——初始污染物的质量浓度,mg·L−1;
V——污染物的体积,mL;
m——加入生物炭的质量,g;
E——去除效率,%。
常用拟一级吸附动力学模型和拟二级吸附动力学模型来分析吸附过程并计算吸附速率。拟一级吸附动力学模型如公式(3)所示,拟二级吸附动力学模型如公式(4)所示。
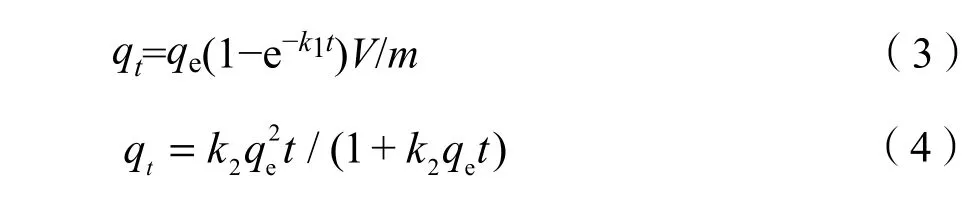
式中:
t——吸附时间,min;
qt——t时刻的吸附量,mg·g−1;
qe——平衡时的吸附量,mg·g−1;
k1——拟一级动力学方程的反应速率常数,min−1。
k2——拟二级动力学方程的反应速率常数,g·mg−1·min−1。
常用的吸附等温线模型为 Langmuir和Freundlich模型,Langmuir等温线模型如公式(5)所示,Freundlich等温线模型如公式(6)所示。

式中:
ce——吸附平衡时的吸附质浓度;
qm——Langmuir最大吸附量,mg·g−1;
kL——Langmuir常数,L·mg−1;
kF——吸附容量,mg·g−1;
nF——Freundlich常数。
数据和绘图采用软件Origin 2017处理。
2 结果与讨论
2.1 Fe-BC的表征分析
生物炭(BC)和改性生物炭(Fe-BC)的SEM代表性图像如图1所示。由图1a显示,生物炭的表面呈不规则长条状。经 K2FeO4改性后,生物炭分裂为尺寸更小的块状结构,并明显出现了很多小孔隙(如图1b所示)。

图1 BC和Fe-BC的SEM图Fig. 1 SEM images of BC and Fe-BC
图2为BC和Fe-BC的XRD图。BC的XRD图谱中约 24°的宽峰为典型的无定形碳衍射图谱(He et al.,2016;Ma et al.,2018)。Fe-BC 在 35.16°、50.48°、63.18°、67.35°处观察到新的衍射峰,对应了Fe2O3的衍射峰。该结果表明,K2FeO4纳米颗粒已加载到生物炭的表面上,可以使吸附剂便于回收利用。
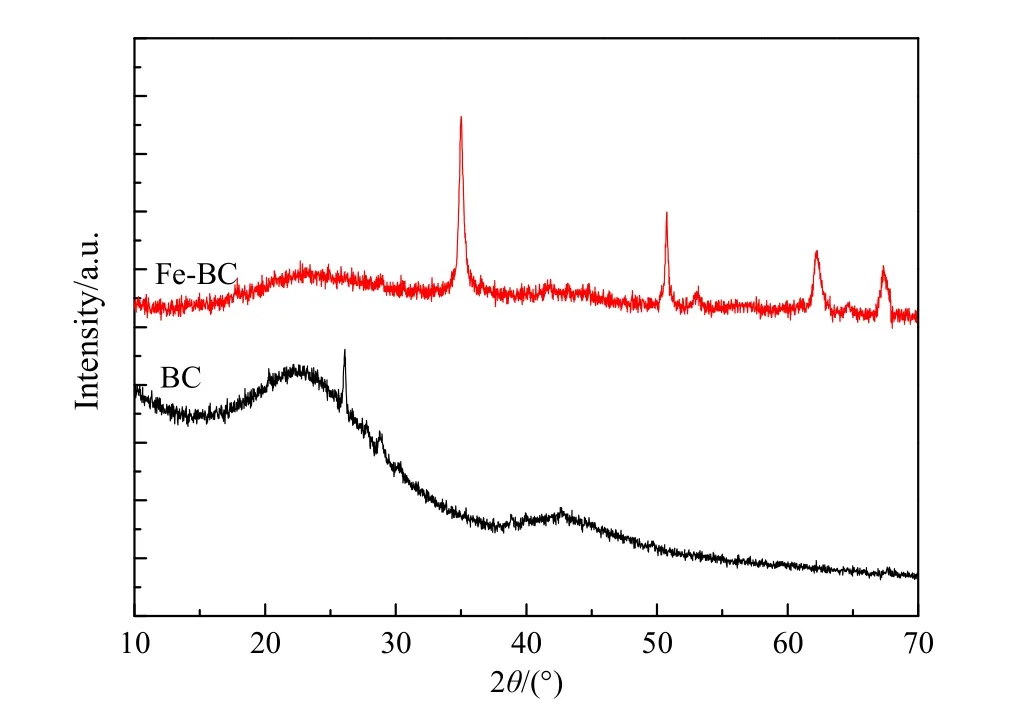
图2 BC和Fe-BC的XRD谱图Fig. 2 X-ray diffraction pattern of BC and Fe-BC
BC和Fe-BC的FTIR光谱如图3所示。在3000—3445 cm−1范围内的频带可能是由于−OH的拉伸振动所致(Droussi et al.,2009),BC在1421 cm−1峰和Fe-BC的1456 cm−1的峰归属于−CH2−,而约1646 cm−1的峰则代表芳族C=C和C=O拉伸振动(Aghababaei et al.,2017)。这些有机官能团的存在可归因于混合原料的木质素结构。与BC的FTIR光谱相比,Fe-BC的FTIR光谱中出现了约713 cm−1和565 cm−1的新峰,这两个峰可以识别为K2FeO4的红外吸收峰。因此,FTIR光谱结果与图2所示的XRD结果一致,进一步证实K2FeO4纳米颗粒在生物炭表面成功负载。

图3 吸附剂BC和Fe-BC的红外谱图Fig. 3 FTIR spectrums of BC and Fe-BC
2.2 反应条件对吸附的影响
溶液的pH值可影响BC和Fe-BC的表面电荷和离子化程度。考虑到金属的水解和沉淀作用,将吸附液pH调至3—7,水中Cd(Ⅱ)初始质量浓度为200 mg·L−1,吸附时间 300 min,吸附剂添加量为 4.0 g·L−1。由图4可知,溶液pH从3增加到6时,重金属的吸附性能提高。这可能是因为生物炭含有表面官能团,例如−COOH 和−OH(Zhang et al.,2017)。一方面是由于有机官能团的解离度随着溶液pH的升高而增加,这些官能团可能与Cd(Ⅱ)相互作用形成表面复合物;另一方面在pH较高的溶液中,吸附剂表面负电荷较多,由于静电吸引,有利于重金属离子的吸附。然而,当pH较高(pH=7)时,Cd(Ⅱ)可能以沉淀的形式析出,因此,在随后的实验中,选择pH 6.0作为Cd(Ⅱ)吸附的最佳pH值。

图4 pH对Fe-BC吸附Cd(Ⅱ)的影响Fig. 4 Effect of pH on the adsorption of Cd(Ⅱ) by Fe-BC
生物炭的添加量是影响重金属吸附量的重要因素,吸附剂添加量过少,吸附效率低,重金属残留多;吸附剂添加量过多,会造成吸附量减小,而且会增加后期分离吸附剂的成本。如图5所示(吸附时间 300 min,Cd(Ⅱ)初始质量浓度 200 mg·L−1,溶液pH为6),综合考虑吸附效率和吸附量,最佳吸附剂添加量为 4.0 g·L−1。
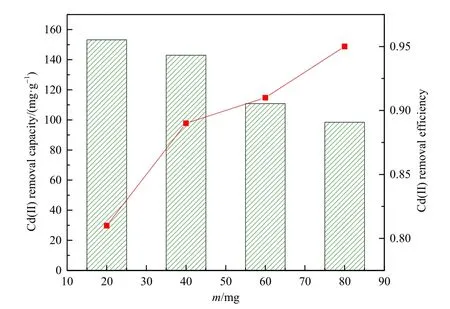
图5 Fe-BC添加量对吸附Cd(Ⅱ)的影响Fig. 5 Effect of Fe-BC dosage on Cd(Ⅱ) adsorption
2.3 吸附等温线和吸附动力学
为了进一步研究吸附过程,还对吸附动力学模型进行了研究。拟一级吸附动力学(PFO)和拟二级吸附动力学模型(PSO)分别代表了液固体系中的单核和双核吸附过程。在最初的2 h内Cd(Ⅱ)的吸附很快,然后变慢并在4 h内达到平衡(图6)。这是因为在最初的快速吸附阶段,生物炭表面上存在大量可用位点,随着吸附的进行,Cd(Ⅱ)积聚在生物炭的表面上,导致吸附速率降低(Tan et al.,2015)。表1为运用拟一级和拟二级动力学对实验数据进行拟合的结果。由表可知,拟二级模型的相关系数(r2)为0.9962,接近于1,并且高于拟一级模型的相关系数,这表明生物炭对重金属的去除过程中,化学吸附占据主导地位,主要是 Cd(Ⅱ)与吸附剂表面官能团的络合(Yang et al.,2021)。

图6 Fe-BC对Cd(Ⅱ)的吸附动力学研究Fig. 6 Adsorption kinetics of Cd(Ⅱ) by Fe -BC
吸附等温线模型体现了水体污染物的初始浓度和吸附剂对污染物的负载的数量的变化情况,反映了生物炭与污染物之间的作用类型。Langmuir模型是由吸附质在开放表面的单分子层物理吸附得到,Freundlich模型适用于吸附剂非均匀表面的多分子层吸附平衡的模拟。由图7和表1可知,Fe-BC对Cd(Ⅱ)的吸附量随着Cd(Ⅱ)浓度的增大而增加,随着温度的升高吸附量也呈现上升的趋势。Fe-BC对 Cd(Ⅱ)的吸附较 Freundlich模型更符合Langmuir模型(r2=0.9858)。因此可以得出,Fe-BC对Cd(Ⅱ)的吸附是单分子层吸附过程(Zhang et al.,2019)。
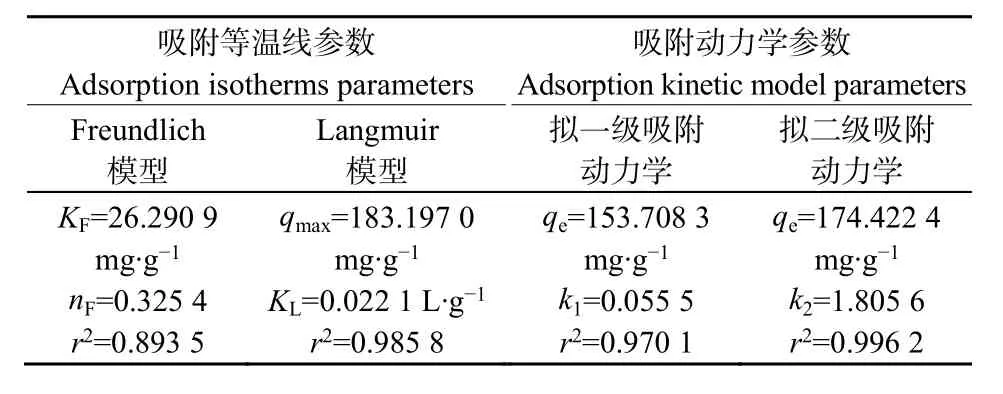
表1 吸附等温线和吸附动力学模型参数Table1 Adsorption isotherms and adsorption kinetic model parameters

图7 Fe-BC吸附Cd(Ⅱ)的等温线模型图Fig. 7 Isotherm model diagram of Fe-BC adsorption of Cd(Ⅱ)
2.4 吸附机制分析
为了确定Cd(Ⅱ)在吸附剂上的吸附机理,采用FTIR和 XPS研究 Fe-BC吸附 Cd(Ⅱ)的表面态。Fe-BC吸附后的FTIR和全范围XPS光谱分别如图8和图9所示。与原始Fe-BC样品的红外光谱相比(图3),在Fe-BC光谱中,Cd(Ⅱ)的吸附在3400 cm−1处观察到了较弱的谱带。这可能是由于Cd(Ⅱ)吸附后Fe-BC表面上与Fe相关的羟基的去质子作用(Li et al.,2018)。振动峰值出现在1646 cm−1和 1654 cm−1处,这归因于C=C/C=O 和−CH2−的振动(Yang et al.,2009)。此外,通过XPS研究了Fe-BC与Cd(Ⅱ)吸附的化学成分。在扫描光谱中清楚地识别出O 1s、Cd 3d、N 1s(图9)。Cd(Ⅱ)的存在进一步验证了Cd(Ⅱ)在Fe-BC上的吸附。结合 Fe-BC对 Cd(Ⅱ)吸附反应条件的讨论及吸附动力学和吸附等温线的研究,可以发现该吸附是基于单层表面的吸附,以化学吸附为主、物理吸附为辅。Fe-BC具有吸附速率快、吸附容量大、吸附效率高、化学稳定性好的优点,且其制备简单、经济环保。
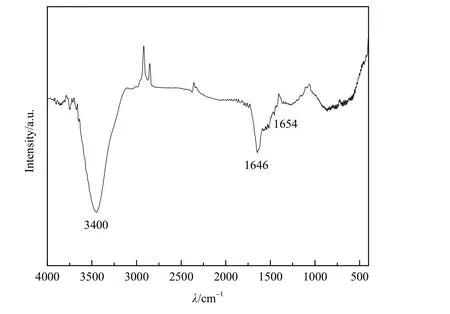
图8 Fe-BC吸附Cd(Ⅱ)之后的红外谱图Fig. 8 FTIR spectrum of Fe-BC after adsorption of Cd(Ⅱ)

图9 Fe-BC吸附Cd(Ⅱ)之后XPS谱图Fig. 9 XPS spectrum of Fe-BC after Cd(Ⅱ) adsorption
2.5 Fe-BC的可重复利用性
为了研究 Fe-BC的可重复使用性,使用 0.5 mol·L−1氢氧化钠解吸 Fe-BC 对 Cd(Ⅱ)的吸附(Huang et al.,2016)。由图10可知,吸附剂对Cd(Ⅱ)的吸附量为 153.28 mg·g−1,吸附能力随着循环次数的增加而逐渐降低,Fe-BC在第 4次脱附-吸附实验中对 Cd(Ⅱ)的吸附量达 79.38 mg·g−1,而到第 6 次循环中 Cd(Ⅱ)吸附量降为 36.72 mg·g−1。吸附容量的下降趋势可归因于吸附剂材料物理和化学性质的变化,如特定表面积和孔体积的减少以及官能团的消耗。此外,Cd(Ⅱ)可以通过解吸浓缩进行再利用。再生实验结果表明,Fe-BC可重复使用,且对Cd(Ⅱ)具有较好吸附效果。

图10 Fe-BC吸附Cd(Ⅱ)六次吸附-解吸对吸附量影响Fig. 10 Effect of six adsorption desorption cycles on adsorption capacity of Cd(Ⅱ) by Fe-BC
3 结论
本文利用 K2FeO4的强氧化性成功制备了一种改性生物炭纳米复合材料(Fe-BC),对其吸附废水中Cd(Ⅱ)的吸附效果及机理进行了研究,并得到了以下结论:
(1)当溶液pH=6,吸附剂添加量为4.0 g·L−1,Cd(Ⅱ)的初始质量浓度为 300 mg·L−1时,吸附剂对Cd(Ⅱ)的吸附量达到最大(153.28 mg·g−1),吸附过程能够在2 h内完成。当溶液pH较高时,Cd(Ⅱ)以沉淀的形式析出。
(2)Fe-BC在第4次脱附-吸附实验中对Cd(Ⅱ)的吸附量仍能达到79.38 mg·g−1,该结果证实了该改性生物炭具有较好的重复利用性能。
(3)该吸附过程满足拟二级动力学模型和Langmuir等温吸附模型,表明Fe-BC对Cd(Ⅱ)的吸附过程是单分子层化学吸附,以化学吸附为主、物理吸附为辅。
(4)FTIR、XPS、SEM 等表征手段表明改性剂 K2FeO4改善了生物炭表面的孔径结构,并增加了C=C、C=O和−OH官能团的数量,从而提高了吸附效果。
