调强放疗中剂量引导的自适应处方剂量优化方法
2022-01-07尹楚欧杨鹏张盛元崔凤洁王宁宇顾少娴胡金有吴章文勾成俊
尹楚欧,杨鹏,张盛元,崔凤洁,王宁宇,顾少娴,胡金有,吴章文,勾成俊
辐射物理及技术教育部重点实验室/四川大学原子核科学技术研究所,四川成都610064
前言
调强放射治疗(Intensity Modulated Radiation Therapy, IMRT)根据肿瘤靶区和危及器官(Organ At Risk,OAR)的三维解剖关系,通过不同照射方式对射束强度进行调节,以达到提高肿瘤区域剂量,降低危及器官剂量的目的[1-6]。根据优化过程的不同,IMRT技术的优化分为正向优化和逆向优化。逆向优化IMRT 技术是现阶段放射治疗技术的主流,其计划设计过程根据靶区与周围紧要器官和正常组织的三维解剖关系,依据理想的靶区剂量分布与OAR 的剂量限值,经验性地输入相关参数,然后经过多次优化得到最接近理想剂量分布的计划方案[7-9]。
根据优化对象的不同,IMRT 又分为基于器官的优化和基于体元的优化。基于器官的优化是把处方剂量和权重因子给定在器官水平上,特定器官内的所有体元在目标函数中被平等对待。因为这些参数与最终剂量分布之间缺乏明确的关系,所以确定这些参数本质上是一个“猜测”游戏,经常需要多次试错过程,计划质量和计划设计效率非常依赖物理师的临床经验[10-12]。
与基于器官的优化不同,基于体元的优化直接调整目标函数中与每个体元相关的参数(包括权重因子和处方剂量),前期有研究结果表明,与基于器官的优化方式相比,基于体元的优化方式能得到更优的剂量分布[13-15]。然而,由于基于体元的优化模型中,需要通过试错法手动调整的参数数量急剧增加,计划质量和效率都无法得到保证,为此,有学者提出自动优化目标函数中的参数。Zarepisheh 等[16]提出一种剂量-体积直方图(Dose Volume Histogram,DVH)引导的自动调整体元权重的优化算法,用于优化初始计划,他们将该算法应用于头颈病例和前列腺病例,结果表明,优化计划的DVH优于初始计划的DVH。麦燕华等[17]提出将临床对感兴趣区域剂量约束的重视程度量化为约束优先级列表,然后以此为依据对剂量进行调整,逐步得到满足当前约束的最优计划。他们选用6 例临床宫颈癌IMRT 计划,使用该方法重新生成优化计划,并与临床原始计划比较,结果显示,优化计划在取得与临床计划相当的靶区覆盖率和均匀性的同时,危及器官受照射量明显减少,计划质量得到有效提高。Zarepisheh 等[13]提出了一种新的优化算法,通过让计划者在最初的计划之上交互地调整DVH 曲线和等剂量曲线,使计划修改为更理想的计划之后,算法将自动调整优化参数,引导计划向理想剂量分布发展,得到最接近计划者期望的计划。他们将该算法应用于一系列患者临床病例,结果表明,该优化算法能够使计划者交互式地微调计划,显著提高治疗计划的质量。
与上述研究不同,本研究的思路首先由计划者经验性地输入权重参数,然后引入基于体元剂量引导的自适应处方剂量优化算法(Adaptive Prescribed Dose Optimization Algorithm,APDOA),通过比较体元实际剂量和处方剂量之间的差距,快速进行体元处方剂量的迭代优化,获得能够用于临床的治疗计划。下面将介绍APDOA的具体实现方法及病例测试结果。
1 材料与方法
1.1 APDOA
在本研究中,采用临床常见的二次目标函数来量化体元实际剂量与处方剂量之间的差距:
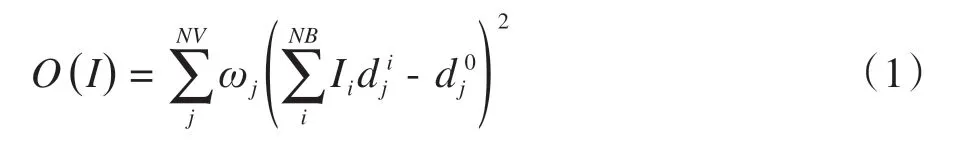
其中,dj=表示第j个体元实际受到的照射剂量,NV表示体元的个数,NB表示射束的个数,ωj表示第j个体元的权重,Ii表示第i个射束的强度,d ij表示单位强度的第i个射束贡献给第j个体元的剂量,d0j表示体元的处方剂量。
有多种算法可以对式(1)的目标函数进行优化,在本文中,采用分子动力学方法进行优化,其具体原理在前期的文章中有详细的表述,在此处仅简单描述[18-20]。
式(1)对第k个射束的强度Ik求导,并令其为0,即:
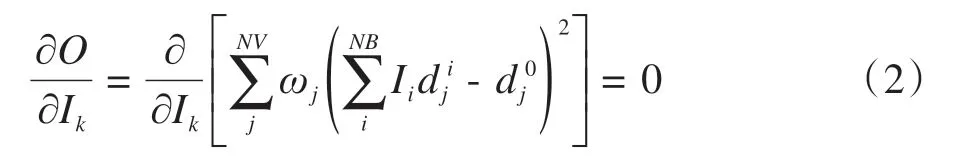
经过推导,得到:

其中,
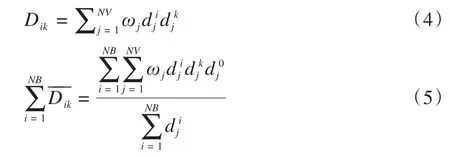
可以看出,体元的处方剂量d0j直接关系到优化的射束强度,从而影响到剂量分布,因此,体元的处方剂量d0j是至关重要的。
在之前已实现的常规处方剂量设置方法(Conventional Prescribed Dose Setting Method,CPDSM)中,将靶区的平均剂量设置为处方剂量;对于OAR,它们的处方剂量设置为0,且不会随着迭代次数的变化而变化。由于OAR的处方剂量设置过于严格,并且靶区的处方剂量设置也较为单一,CPDSM仅适用于某些简单的病例,对于较为复杂的病例,这种处方剂量设置方法并不能满足临床治疗要求。但是在APDOA 中,每一次迭代优化,靶区和OAR 的处方剂量都在发生变化。对于靶区,如果
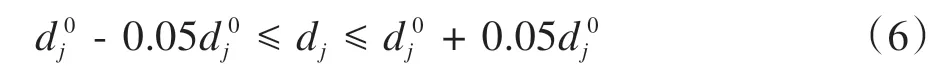
则下一次迭代中,靶区的处方剂量更新为:d0j=dj,否则,选择最接近d0j的剂量作为下一次迭代的处方剂量。
对于OAR,有两种给定处方剂量的方式,分别是最大剂量限值和剂量-体积限值,对于前一种方式,有:

对于后一种方式,OAR的处方剂量由下式确定:

1.2 测试病例
将CPDSM和APDOA集成到Fonics三维放射治疗计划系统(3D-TPS)中,首先使用CPDSM进行初始计划设计,并将对应的计划标记为C计划,然后采用APDOA重新优化C计划生成新的计划,并标记为A计划。当目标函数值连续10次没有明显优化或者迭代次数达到设置的最大优化次数30次时,优化过程自动终止。
为了验证APDOA 的可行性和算法性能,选择了两个病例,分别是临床肺癌病例和美国医学物理学家协会(American Association of Physicists in Medicine,AAPM)TG-119 号报告中的C 形测试例(第一类)[21],计划设计和优化均在Fonics 3D-TPS 上进行。并通过比较两种计划的DVH 曲线,剂量均匀性等临床关注的指标,来验证APDOA 的可行性和性能。
对于肺癌病例,采用7 个照射野,角度分别是190°、330°、0°、30°、50°、140°和160°,射线为6 MV X射线,处方剂量为60 Gy。对于C 形测试例(第一类),采用9 个照射野,角度分别是200°、240°、280°、320°、0°、40°、80°、120°和160°,射线为6 MV X 射线,处方剂量为50 Gy。
2 结果
用下列公式描述两个计划中参数变化的百分比:

对于肺癌病例,在A计划和C计划均完成之后,将两个计划的计划靶区(PTV)95%体积获得的剂量(D95)归一到处方剂量,即D95=60 Gy。从图1中可以看出,剂量归一化之后,A计划中,PTV的剂量均匀性提高。心脏、双肺和脊髓的剂量均降低,尤其是脊髓最大剂量Dmax明显减少。根据表1的数据可知,脊髓最大剂量减少达到21.7 Gy。通过比较两个计划的DVH曲线和剂量学参数,可以知道,APDOA算法能够对C计划进行再优化,得到计划质量更高的计划。达到保证靶区剂量足够高的情况下,OAR剂量尽量低的目标。最终得到的A计划所有参数均满足剂量目标。
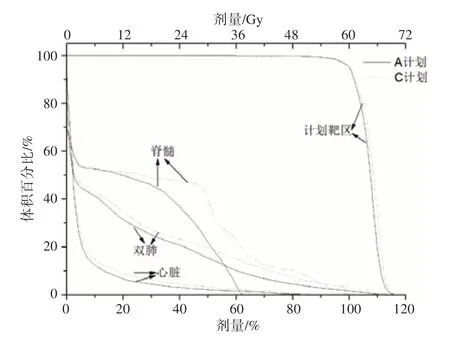
图1 肺癌病例的剂量-体积直方图Fig.1 Dose-volume histogram of lung cancer case
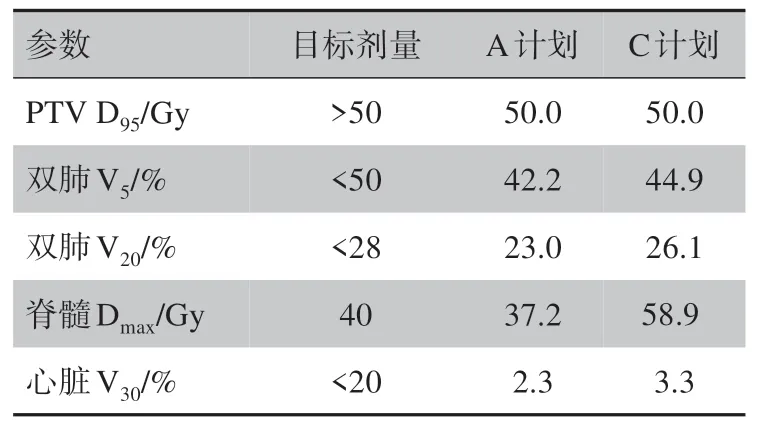
表1 归一后的肺癌病例的剂量学参数Tab.1 Dosimetric parameters of lung cancer case after normalization
对于C形靶区(第一类)测试例,将两个计划的D95归一到处方剂量,即D95=50 Gy。从图2可以看出,在A计划中,PTV的剂量均匀性提高,PTV的最大剂量减少约2%,中心圆柱体Core的剂量明显减少。由表2可知,相对于C计划,在A计划中,中心圆柱体Core D10降低了16.1%。原本未满足剂量目标的参数(PTV D10和Core D10),经过APDOA优化之后,均满足剂量目标。详细的剂量学参数见表2。A 计划的所有参数均满足AAPM TG-119号报告提出的剂量目标。
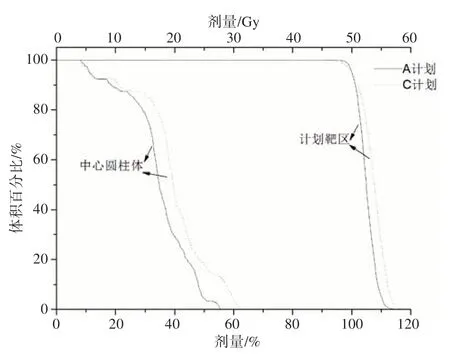
图2 C形靶区(第一类)的剂量-体积直方图Fig.2 Dose-volume histogram of C-shape target area(the first class)
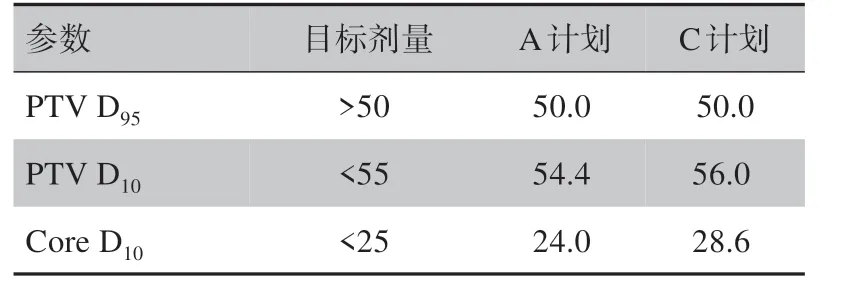
表2 归一后的C形靶区(第一类)测试例的剂量学参数(Gy)Tab.2 Dosimetric parameters of C-shape target area(the first class)after normalization(Gy)
3 讨论和结论
事实上,优化计划在一定程度上符合为靶区和紧要器官设置的规定和约束,但几乎不能满足所有要求。因此,通常需要多次调整参数,以获得可接受的解决方案。此外,在常规优化中改变体元或者器官权重一定程度上可以提高计划的质量,但是并不能改变和扩大优化解空间,这也为寻找到“更优”解带来阻碍[13]。在本研究中,总体思路是在计划者经验性确定一组权重因子后,根据各种临床情况下迭代过程中计算的剂量自动确定处方剂量,更好地适应临床目标。为了评估APDOA算法的性能,我们比较了两种计划的DVH曲线等参数。可以看出,与CPDSM相比,APDOA算法优化的所有病例PTV剂量分布变得更加均匀。并且PTV热点减少,危及器官的剂量也明显减少。这些结果表明,本文提出的APDOA算法满足临床治疗需求,可以集成在TPS中用于临床治疗。
研究中权重因子是计划者依据经验输入并进行微调的,这将限制APDOA 在更大的解空间中寻找最优解的能力,因此得到的优化计划可能只是在对应解空间中的最优解,而并非是全局最优解。并且,由于是人为地输入权重因子,会带来相应的误差,这都是在下一步工作中需要解决的问题。因此,在更进一步的研究中,将引入基于体元的权重因子的自动优化,将体元权重优化和体元处方剂量优化同时考虑在优化算法中,转变为一个多目标优化问题,这样才能有效扩大解空间,得到最优计划[22-25]。另外,在某种程度上来说,本文仅仅是提出了放射治疗领域优化问题中的局部优化而非全局优化,但本文提出的方法和展示的思路对其他模式的放射治疗优化存在一定的启发意义,也对其他存在优化问题的领域和方向具有启发意义,而不是仅仅是放射治疗领域。