局部晚期食管鳞癌放疗的实际剂量分布误差追踪评价
2022-01-07刘懿梅彭应林邱波李绮雯张俊刘慧邓小武吴德华
刘懿梅,彭应林,邱波,李绮雯,张俊,刘慧,邓小武,吴德华
1.南方医科大学南方医院放疗科,广东广州510515;2.中山大学肿瘤防治中心/华南肿瘤学国家重点实验室/肿瘤医学协同创新中心,广东广州510060
前言
食管癌是一种常见的消化道恶性肿瘤,居全球恶性肿瘤发病率的第7 位,死亡率的第4 位,每年全球食管癌新发病例约32 万,其中一半以上发生在我国[1]。我国食管癌的病理类型绝大部分为鳞状细胞癌,早期食管癌缺乏特异性症状,诊断较困难,大部分患者确诊时已为中晚期,仅20%可行根治性切除,其余80%无法手术患者依靠放疗及其他治疗。对不可手术或不愿手术的局部晚期食管癌患者,同步放化疗为标准的治疗模式。随着放疗技术的发展,局部晚期食管癌的5年生存率由传统放疗技术的6%~10%提高到适形调强技术的25%~30%,而其治疗失败的主要原因是局部复发和肿瘤未控[2-5]。新兴的三维适形放疗(Three-Dimensional Conformal Radiotherapy, 3DCRT)和调强放疗(Intensity-Modulated Radiotherapy,IMRT)等现代先进放疗技术可精确确定和照射肿瘤靶区,在保证肿瘤靶区获得根治剂量的同时,有效降低周围正常组织受照射剂量,从而提高食管癌放疗的效果[6-8]。然而,食管癌放疗过程存在体位固定重复性较差导致的摆位误差,治疗期间肿瘤退缩和呼吸运动造成肿瘤靶区和危及器官(Organs-at-Risk, OAR)的位移以及内部器官的运动、形变、物理密度和生物改变等,这些不确定因素会导致实际治疗的照射剂量及生物效应与计划设计产生较大的偏差,从而影响疗效[9-12]。本研究针对上述食管癌精确放疗中存在的问题,于每周第5次治疗结束后重新进行模拟CT 扫描、勾画靶区和OAR,计算实际照射剂量并进行形变追踪累加,评估放疗过程中肿瘤退缩、呼吸运动、解剖结构的改变和位移等因素引起的剂量偏差,探讨重新设计和修改放疗计划的必要性和时机,为开展食管癌自适应放疗(Adaptive Radiotherapy,ART)提供参考和指导。
1 材料与方法
1.1 患者选择
本研究纳入2016年1月 至2017年3月在中山大学肿瘤防治中心放疗科行根治性同步放化疗的局部晚期食管鳞状细胞癌患者13例,全为男性,确诊时的中位年龄为61 岁。7 例采用IMRT 技术,6 例采用3DCRT 技术。患者临床基线信息详见表1。肿瘤位于颈段食管者有2例、胸上段5例、胸中段6例。临床分期为III 期8 例、IVA 期2 例、IVB 期3 例。纳入标准为:组织病理学证实为食管鳞状细胞癌;不可手术或拒绝手术的III~IVB 期(AJCC/UICC 第六版分期);既往未有胸部放疗史;ECOG 0~1 分。本研究得到广东省胸部肿瘤防治研究会伦理委员会的批准(NO.201512002),所有入组的患者均签署知情同意书。
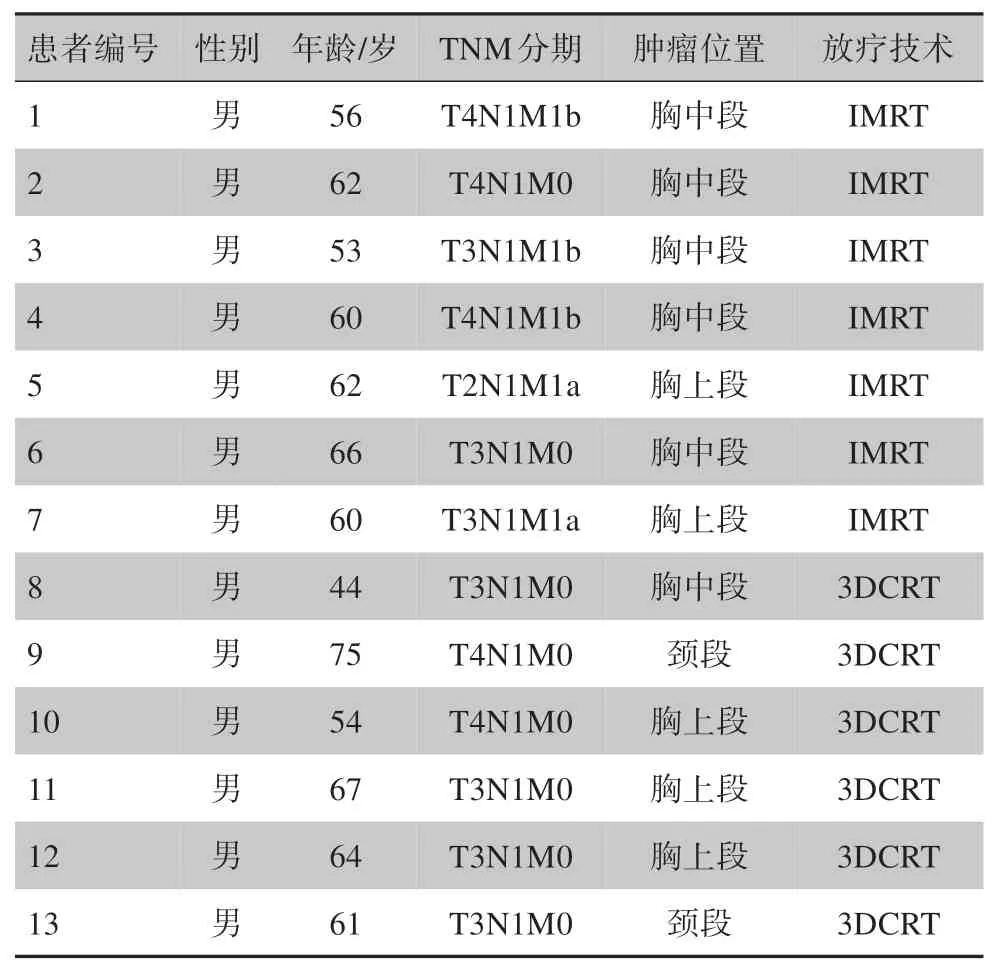
表1 患者临床基线信息Tab.1 Clinical characteristics of patients
1.2 图像采集
1.2.1 计划CT 扫描采用大孔径16 排螺旋CT 模拟定位系统(Brilliance Big Bore, Philips Healthcare)进行4DCT 扫描获取计划CT。患者取仰卧位并以真空垫体模固定。CT 扫描电压140 kV、电流250 mAs,扫描和重建层厚均为5 mm、层距为3 mm。将获得的患者计划CT 图像传输至放疗计划设计系统(Monaco,V5.11,Elekta AB),由放疗医师和剂量师分别进行靶区/OAR勾画和计划设计。
1.2.2 重复模拟CT 扫描(1 次/周)于放疗疗程中的第5、10、15、20 和25 次治疗后当天重复CT 扫描,扫描条件和扫描范围与治疗计划CT 扫描时一致。将获得的患者重复CT 扫描图像传输至放疗计划设计系统,再次勾画靶区和OAR,并计算原放疗计划在重复CT图像上的剂量分布。
1.3 靶区和OAR勾画
由同一名医师在患者的计划CT 图像和每周的重复CT 图像上勾画靶区与OAR。肿瘤靶区(Gross Tumor Volume,GTV)包括食管原发病灶和阳性淋巴结区域。临床靶区(Clinical Target Volume, CTV1)包括GTV 在左右和前后方向外扩0.5 cm、头脚方向外扩1.5 cm的区域,以及阳性淋巴节站。预防照射区域CTV2包括食管旁淋巴结和第2、4、7 站纵隔淋巴节;颈段和上段食管癌病例的锁骨上区,下段食管癌病例的贲门周围淋巴结、左胃动脉旁及胃小弯周围淋巴结也包括在CTV2。计划靶区体积(Planning Target Volume, PTV)在CTV1和CTV2左右前后方向外放0.5 cm,头脚方向外放1.0 cm 得到PTV1和PTV2。OAR勾画包括脊髓、心脏和双肺。
1.4 放疗计划设计和疗程中的剂量评估
1.4.1 治疗计划设计分别采用IMRT和3DCRT两种技术进行计划设计。剂量处方均为PTV1:64 Gy/32 F;PTV2:46 Gy/23 F。分两段进行照射,A段计划(PlanA)处方为PTV1:46 Gy/23 F,PTV2:46 Gy/23 F;B段计划(PlanB)处方为PTV1:18 Gy/9 F。剂量学要求:95%处方剂量覆盖95%的PTV,充分考虑正常组织耐量,当靶区剂量覆盖与OAR限量难以平衡时,优先考虑OAR限量。剂量计算应考虑照射区组织密度差异(即肺和骨组织空气密度)给予组织不均匀性校正。
1.4.2 疗程中的剂量评估在重复CT 图像上重新计算原治疗计划的剂量分布。保持原治疗计划设计的等中心位置,将PlanA 计划通过QA 模式重新计算到第5、10、15 和20 次治疗后的重复CT 图像上,分别生成单次治疗的QA剂量QDA2、QDA3、QDA4和QDA5。然后将PlanB 计划重新计算到第20 和25 次的重复CT图像上,分别生成单次治疗的QA剂量QDB5和QDB6。
1.5 照射剂量累加和比较
假定每周内的治疗剂量分布和第一周内的靶区和器官形变导致的剂量变化均可以忽略。从第二周起,每周使用上周末次治疗后的重复CT 重新评估实际治疗剂量分布,并通过形变配准软件(MIM Vista,V6.6.6)将各周的实际照射剂量进行形变累加计算。将各周的累加实际照射剂量Dtreated与相应的计划累加剂量Dplanned进行比较,每周比较两者之间的剂量学差别并评估是否需要调整计划。疗程结束时的总累加剂量可以用式(1)和式(2)表达:
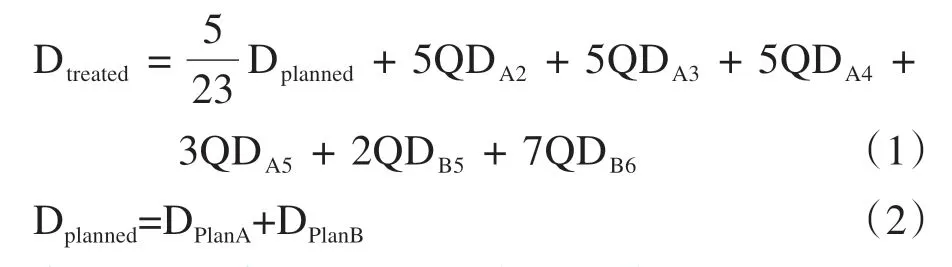
1.6 放疗过程中靶区和OAR的剂量学变化
1.6.1 靶区的剂量学评价参数比较每周治疗后实时剂量和原始计划的计划靶区体积(PTV1和PTV2)覆盖率(包括V98%和V95%)和Dmean等。V98%和V95%分别为接受98%和95%处方剂量的PTV体积,V98%和V95%分别为接受98%和95%处方剂量的靶区百分体积;Dmean为平均剂量。
1.6.2 OAR 的剂量学评价参数对于串联器官,如脊髓,评价指标为D1cc(1 cc 体积所受最大剂量)。对并联型器官如肺和心脏的评价指标为Dmean。
1.6.3 剂量偏差比(Dose Deviation Rate,DDR)每周实际累积受照剂量(Dtreated)与计划剂量(Dplanned)的偏差百分比见式(3):

其中,Dtreated,i为器官剂量学参数(i)的实际累积受照剂量;Dplanned,i为对应器官剂量学参数(i)的计划剂量。
1.6.4 偏差阈值发生分析对实际治疗剂量的偏差评估中,靶区和OAR 分别评价欠剂量(负偏差)和超剂量(正偏差)。根据临床剂量学要求,分别设置肿瘤靶区、OAR 每周累积剂量偏差的预警阈值和干预阈值为-3%和-5%(PTV)、+3%和+5%(OAR),并统计偏差大于阈值的病例数。
1.7 统计学方法
利用SPSS 24.0 软件,用非参数Wilcoxon 带符号秩检验方法进行数据统计学分析,P<0.05 为差异有统计学意义。
2 结果
2.2 靶区的剂量学变化
2.2.1 计划靶区体积覆盖率的变化PTV1和PTV2实际治疗的处方剂量覆盖率指标(V95%和V98%)随放疗次数的增加均有不同程度的下降。完成第20次治疗时,PTV1的V95%和V98%分别由计划的95.75%±3.65%和91.15%±5.47%下降到94.55%±3.73%和89.99%±5.52%,平均下降-1.65%±2.09% 和-2.35%±2.82%;PTV2的V95%和V98%分别由计划的93.12%±4.49%和87.24%±6.82%下降到90.07%±5.27% 和82.50%±7.05%,平均下降-3.23%±4.64%和-5.39%±4.16%。全程治疗结束时,PTV1的V95%和V98%下降到93.12%±3.91% 和87.99%±5.17%,平均下降-2.73%±2.82%和-3.32%±4.15%;PTV2的V95%和V98%下降到97.04%±2.45% 和95.97%±3.43%,平均下降-1.88%±1.44%和-1.94%±1.45%。以上所有考察的剂量学参数变化均有统计学意义(P<0.05),详见表2。
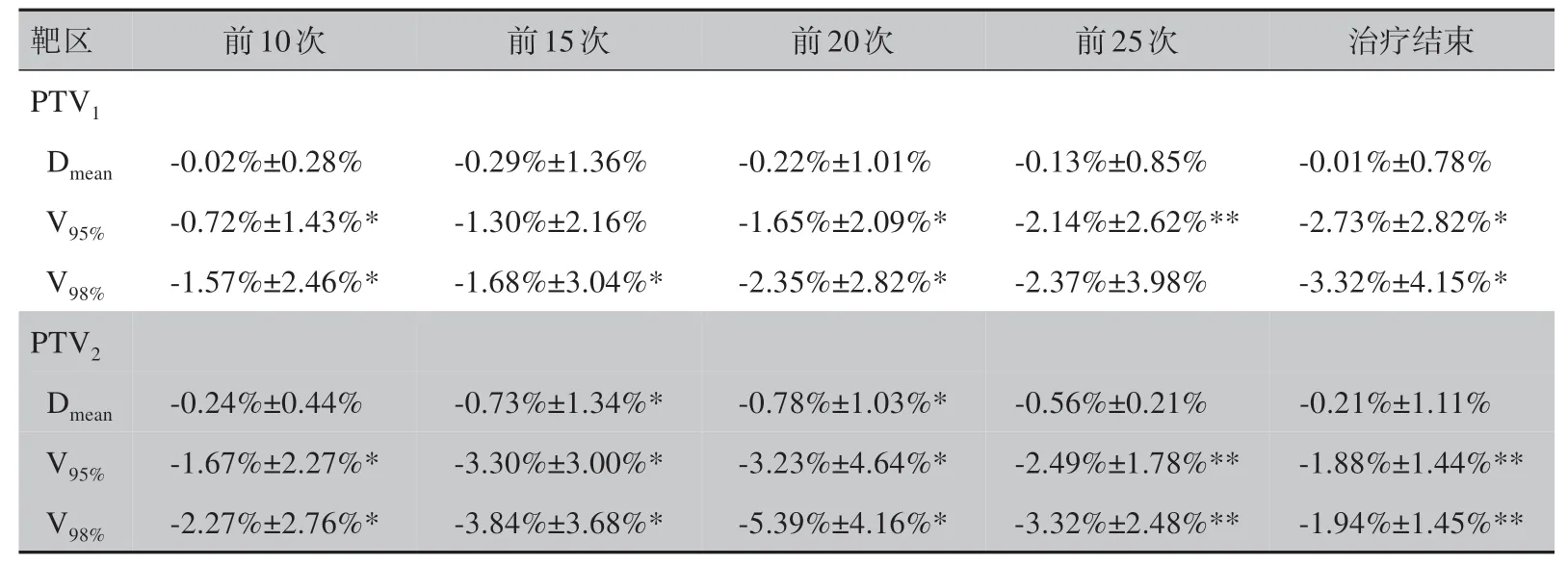
表2 靶区的累加剂量与原计划剂量的比较Tab.2 Comparison of accumulated target dose with that in the original plan
2.2.2 靶区剂量学偏差阈值分析针对计划靶区体积PTV1和PTV2,对13 例患者每周的累积剂量进行评估,分别统计Dmean、V95%和V98%的负偏差大于3%和5%的病例数(表3)。PTV1和PTV2的Dmean在前15 次治疗后均有1 例患者的实际治疗剂量偏差超出-3%,分别达到-4.48%(PTV1)和-4.63%(PTV2)。在第10次治疗后,PTV1的处方剂量覆盖率参数V95%和V98%分别有1 例和2 例出现大于5%的负偏差,最大偏差分别为-5.31%(V95%)和-7.14%(V98%);PTV2的处方剂量覆盖率有2 例发生大于5%的负偏差,最大偏差分别为-8.33%(V95%)和-9.97%(V98%)。前20 次治疗后,PTV1和PTV2的V95%负偏差超出3%的分别有4例和7例,负偏差超出5%的分别有1 例和5 例。随着二段推量计划PlanB的执行,PTV2的处方剂量覆盖率有所提升,至全程治疗结束时,仅有2 例患者的V95%发生超出3%的负偏差,4 例患者的V98%发生超过3%的负偏差;但是PTV1的处方剂量覆盖率仍在不断降低,至治疗结束时,其V95%和V98%仍有2 例和4 例负偏差超出了5%的临床干预阈值,最大偏差分别达到-9.16%(V95%)和-11.44%(V98%)。

表3 计划靶区剂量学偏差阈值分析Tab.3 Threshold analysis on dosimetric deviations of PTV
2.3 OAR的剂量学变化
2.3.1 OAR剂量学参数变化和偏差比较随着放疗的进行,心脏Dmean的偏差不明显,但双肺Dmean和脊髓D1cc的实际受照剂量逐渐大于计划剂量。至放疗结束时,相对于计划剂量,双肺Dmean和脊髓D1cc实际受照剂量分别从计划值(17.90±2.78)Gy 和(47.04±3.21)Gy增加至(18.27±3.18)Gy 和(49.02±3.96)Gy;DDR 分别为1.84%±3.83%和4.25%±5.72%,其中脊髓D1cc受照剂量增加明显且有统计学意义(P<0.05)。详见图1和表4。

图1 食管癌放疗中OAR剂量参数的平均变化趋势Fig.1 Average change trend of organs-at-risk dose parameters during radiotherapy for esophageal carcinoma
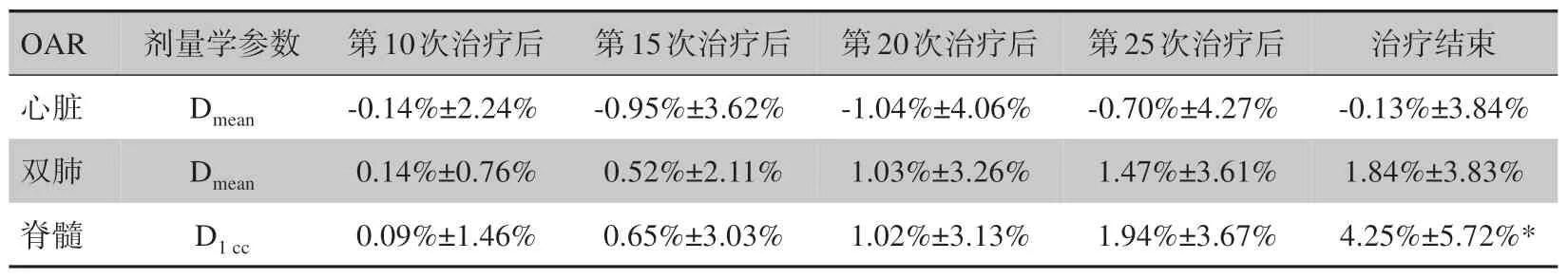
表4 OAR剂量的偏差百分比Tab.4 Dose deviation rate of organs-at-risk dose
2.3.2 OAR 剂量学偏差阈值分析针对双肺Dmean、脊髓D1cc和心脏Dmean,对13 例患者每周的累积剂量进行评估,分别统计正偏差发生大于3%和5%的病例数(表5)。在前15 次治疗后,双肺Dmean和脊髓D1cc均有1 例患者出现大于5%的正偏差,分别为5.20%和5.09%。随着放疗的进行,其偏差越来越大,至放疗结束,最大偏差分别达到13.35%和15.21%。其中,心脏Dmean在治疗20 次后出现1 例偏差大于5%的病例。随着治疗的进行,脊髓D1cc的偏差越来越大,且偏差大于3%和5%的病例数不断增加,至治疗结束时,分别增加到6 例(接近50%的病例数)和5例。
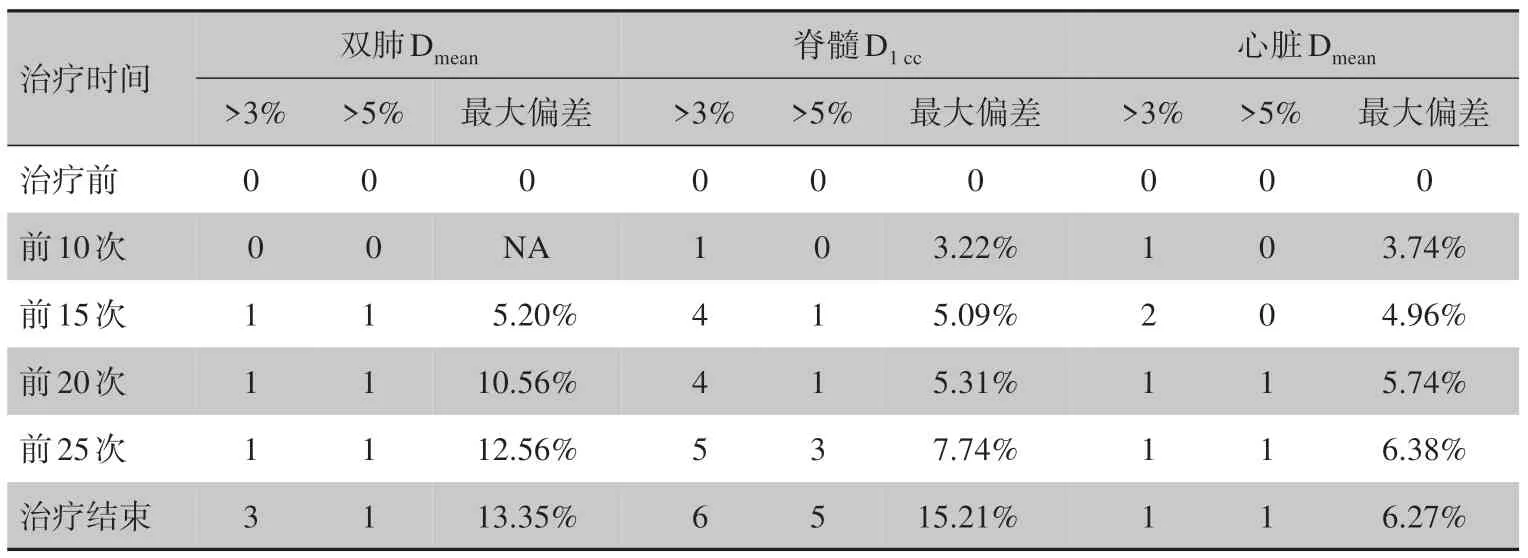
表5 OAR剂量学偏差阈值分析Tab.5 Threshold analysis on dosimetric deviations of organs-at-risk
3 讨论
既往的研究显示放疗过程中多种不确定因素可导致靶区剂量的降低和脊髓、肺、心脏等OAR的过度照射,分次治疗内的不确定因素有解剖结构的位移[13-14]、内部器官运动形变以及正常的呼吸运动等[15-16],分次治疗间的不确定因素包括摆位误差[17]、肿瘤退缩或进展[18]、因体质量下降致骨性标志位置的变化等[19]。图像引导放疗(Imaging-Guided Radiotherapy,IGRT)是继3DCRT和IMRT之后一项新兴的放疗技术,在治疗前或治疗中利用各种影像设备如电子射野影像系统(Electronic Portal Imaging Device,EPID)、千伏级锥形束CT(Cone Beam CT, CBCT)、兆伏级CT(Megavoltage Computed Tomography,MVCT)等对肿瘤及正常器官进行实时的监控,通过与模拟定位CT图像比较,必要时通过位置校正来引导本次治疗或后续分次治疗,可以在一定程度上减少剂量误差。然而,IGRT技术并不能完全避免因形变和器官相对位置改变等导致的靶区和OAR剂量误差。在IGRT基础上,Yan等[20]提出ART的概念,经过20余年的研究发展,ART技术已逐步成熟并开始应用于临床。ART主要目标是在患者治疗过程中通过引导图像评判患者解剖和生理变化,分析分次治疗与原计划设计之间的差异,及时修改或重新计划,指导后续分次治疗,实现高度精确的个体化放疗,包括离线ART和在线ART两种方式。ART在前列腺癌[21-23]、膀胱癌[24-25]、头颈部恶性肿瘤[26-27]的治疗效果已被初步证实。Nuver等[21]对19例前列腺癌患者采用离线ART,结果显示CTVPTV的外扩边界可从10 mm缩至7 mm,PTV体积减少30%,前列腺的靶区剂量覆盖率并未减少,而直肠Dmean可以得到降低。Brabbins等[22]将ART应用于280例前列腺患者,通过每周根据疗程中的CT图像和电子射野成像引导再计划设计,在不增加生殖泌尿系统和胃肠道毒性的情况下,使前列腺的总剂量得到安全提升。Burridge等[24]通过kV-CBCT引导在线ART治疗20例膀胱癌患者,可使PTV外扩边界从15 mm安全地减少至10 mm,显著地减少了患者接受高剂量的小肠体积。Ahn等[26]对23例头颈部恶性肿瘤患者IMRT的第11、22和33次治疗时重新进行模拟CT扫描,发现部分患者的PTV处方剂量覆盖率明显下降或脊髓、脑干、腮腺等OAR的受照剂量超出临床限制值,有65%(15/23)的病例需要在治疗中段进行重新计划干预。
目前针对食管癌ART 的研究报道仍很少。Hawkins等[28]利用CBCT 引导的离线ART 技术,通过治疗首周的4次CBCT及此后每周一次的CBCT进行评估,并根据评估结果分别进行两次计划修正,结果显示PTV体积平均减少了51.6%,同时PTV的处方剂量覆盖率V95%由95.6%提高到96.8%,而肺V20和心脏Dmean也显著减少(15.6 Gyvs10.2 Gy 和26.9 Gyvs20.7 Gy)。同样地,Sriram等[29]报道了kV-CBCT引导的食管癌ART可显著降低双肺和心脏的受照剂量。
CBCT图像的低对比度分辨率和较低空间分辨率对靶区和正常组织器官的精确勾画产生一定的困难,故本研究没有采用CBCT引导方式,而是在每周第5次治疗结束后重新进行模拟CT扫描及勾画,通过形变软件对剂量进行追踪累加,得到接近真实的实际治疗剂量分布,并与原始计划进行比较,评估治疗过程中肿瘤靶区和OAR的剂量学变化,探讨ART的必要条件和时机。我们的前期研究结果显示,放疗第一周(5次治疗后)后靶区体积改变不明显,随后每周的靶区体积明显逐渐退缩[30]。放疗40 Gy(20次治疗后)时与放疗前比较,GTV体积平均缩小29.21%,CTV1缩小10.34%,之后肿瘤体积缩小的速度减缓。随着靶区体积的缩小,其中心点的位移矢量ΔD变大,而OAR几何中心到放疗计划等中心的间距则变小。第四周治疗结束后(40 Gy),GTV、CTV1几何中心的平均偏差ΔD分别为(0.74±0.36)cm和(0.71±0.35)cm。因此建议在第2~4周进行IGRT,并评估其剂量学变化,决定是否需要重新计划。结合前期研究基础,本研究对食管癌放疗的剂量学变化进行分析,结果显示肿瘤靶区PTV1和PTV2的处方剂量覆盖率(V95%和V98%)随着放疗的进行均有不同程度的下降。值得注意的是,在20次治疗后,PTV1的平均处方剂量覆盖率仅为94.55%,未能达到临床治疗的需要(V95%>95%)。Nyeng等[31]指出在食管癌放疗过程中由于分次治疗间解剖结构的位移导致部分患者出现靶区覆盖率下降以及心脏受量增加,提出当疗程中CTV的V95%下降>1%或PTV的V95%下降>3%时,应该选择ART进行及时的计划调整。此外,本研究统计了入组病例中PTV剂量发生负偏差大于3%和5%的例数,结果显示,在前10次治疗后,分别有1例的PTV1和和2例的PTV2发生了V95%的负偏差超出5%的情形,分别达到-5.31%和-8.33%;15次治疗后,PTV1和PTV2的V95%分别有2例和6例负偏差超出3%,1例和3例的负偏差超过5%;20次治疗后,PTV1和PTV2的V95%负偏差大于3%的例数分别增加到4例和7例(超过总例数13例的50%),并且负偏差超出5%的例数分别为1例和5例,PTV2的V95%最大负偏差甚至达到接近于10%(-9.38%)。这个结果提示我们,在食管癌放疗的整个疗程中,从第10次到第20次之间,可能需要借助在线影像进行患者的几何位置和剂量学偏差验证,评估是否需要进行ART的再计划,以保证患者的靶区得到足够的剂量覆盖。
本研究的结果显示,放疗过程中双肺Dmean和脊髓D1cc也有不同程度的增加,其中脊髓D1cc的变化具有统计学意义(P<0.05)。15次治疗后,双肺Dmean和脊髓D1cc均有1例患者发生大于5%的正偏差;随着治疗次数的增加,发生OAR剂量正偏差的例数也更多,尤其是脊髓D1cc的偏差越来越大,且正偏差大于3%和5%的病例数不断增加。至治疗结束,D1cc正偏差大于3%和5%的例数分别增加到6例和5例。提示在治疗15次后应评估患者OAR的剂量学偏差,必要时修改计划以防止重要OAR受到过量照射而出现并发症。
食管癌放疗过程中因靶区体积退缩、靶区几何中心点发生位移等可能导致靶区剂量覆盖率下降以及OAR 受照剂量增加。实施ART 可以减少这种偏差,但最佳的ART 时间节点目前尚无定论。Karaca等[32]选择在第15 和25 次(放疗共约36 次)进行ART的计划调整;Ahn 等[26]重复扫描CT 的时间节点为第11、22 和33 次(共33 次)。本研究中,靶区剂量覆盖率以及脊髓D1cc和双肺Dmean几乎都在第2~3 周治疗结束后才出现明显变化,故采取ART 评估的时机是第10次治疗后,重新计划的时间节点可为第3或4周结束时,即第15或20次放疗结束时(共32次)。
本研究存在着一定的局限性,目前获得的样本量还较少,且为单中心治疗经验,结果仍需要大样本量的多中心临床试验进一步验证。后续将进一步开展ART的对照研究,对ART计划的剂量优势作进一步的深入评估,并对临床疗效和并发症评估开展相应的随访研究。
4 结论
局部晚期食管鳞癌放疗过程中可能出现靶区剂量覆盖率的明显下降及脊髓、肺等OAR 实际受照剂量增加等情况,建议在治疗10 次后实施实施影像和剂量学评价,必要时进行计划调整,以保证靶区剂量覆盖的同时,降低OAR的受照剂量增加的风险。