陆地棉L-D1等位基因特异性分子标记的开发及应用
2022-01-07姜辉郑锦秀王永翠张超王秀丽陈莹高明伟王家宝柴启超赵军胜
姜辉,郑锦秀,王永翠,张超,王秀丽,陈莹,高明伟,王家宝,柴启超,赵军胜*
(1.山东省农业科学院经济作物研究所,济南 250100;2.汶上县第一中学,山东 济宁 272500)
陆地棉属于喜光作物,良好的冠层结构可使中下部获取更多光能,缓解蕾铃脱落及烂铃问题,为实现高产优质目标奠定基础[1-2]。针对不同生态条件及种植方式,我国西北内陆、黄河流域和长江流域三大棉区棉花分别形成了独具特色的群体结构[3],为各棉区棉花单产的提高奠定了基础。近年来,随着高效轻简化植棉技术的深入研究及不断应用,群体的冠层结构需要进一步优化[4-7]。
棉花冠层结构受到外界因素的影响,但主要与本身的生物学特性如叶形、叶倾角、果枝长度、果枝夹角等[8-10]密切相关。叶形主要分为常态叶、亚鸡脚叶、鸡脚叶和超鸡脚叶4种类型。鸡脚叶棉在澳大利亚大面积种植,在部分棉区的种植面积接近50%[11]。在我国西北内陆棉区,鸡脚叶棉光能利用效率高,皮棉产量达到超高产水平(3 500 kg·hm-2以上)[12-13],亚鸡脚叶棉在黄河流域和长江流域棉区均表现出产量优势[14-15]。
L-D1位点是调控陆地棉叶形的主要位点,Andres等[16]将该位点定位在陆地棉15号染色体短臂5.4 cM区间内,通过共线性分析发现该区间对应雷蒙德氏棉2号染色体337 kb的区域,包含34个候选基因,推测其中的2个HD-ZIPⅠ转录因子基因Gorai.002G244000和Gorai.002G244200为候选基因。Zhu等[17]利用棉花SNP63K芯片将定位区间进一步缩小,推断Gorai.002G244000是陆地棉鸡脚叶基因L2o的同源基因,并发现非互易同源重组在叶形等位基因起源中发挥了重要作用。Chang等[18-19]通过图位克隆获得了L2o的序列,分析发现常态叶基因编码区有8 bp和1 bp的2个缺失,基因沉默及过表达分析表明L2o调控叶形的发育,并且与KNOX1基因共同调控叶形。Andres等[20]对L-D1位点4个复等位基因编码区和启动子区域的多态性进行了分析,发现编码区和3’端非翻译区的差异位点均存在于常态叶基因l2中,5’端非翻译区的差异位点全部为单核苷酸多态性 (Single nucleotide polymorphism,SNP)位点,l2中6个,L2o和L2s各1个;同时发现L2o和L2s启动子区域的133 bp的串联重复序列与基因表达量的升高密切相关。He等[21]发现海岛棉中亚鸡脚叶基因L2e的表达与植物激素信号密切相关,其中油菜素内酯对叶形的影响最大。
L-D1位点的4个复等位基因彼此间是不完全显性遗传关系。朱伟等[15]利用超鸡脚叶、鸡脚叶和正常叶棉花不育系及其恢复系为亲本创制的F1代材料的叶形可分为超鸡脚叶、鸡脚叶、中鸡脚叶、大鸡脚叶和常态叶5类,一些叶形形态极为相似,难以准确区分,同时各种叶形在后期才能基本稳定,这给种质的早期鉴定及育种应用带来一定困难。前人研究发现L-D1等位基因在启动子区域存在较为丰富的多态性[14],本研究通过深入分析L-D14个等位基因启动子区域的多态性位点,设计特异性分子标记,为不同叶形基因的鉴定及分子辅助选择提供依据。
1 材料与方法
1.1 试验材料
以超鸡脚叶形种质R132163、鸡脚叶形T586和亚鸡脚叶形S131189为父本,分别与常态叶品种鲁棉研28号(LMY28-N,基因型为l2 l2)杂交,再以常态叶鲁棉研28号为轮回亲本经过连续6代回交和1代自交得到具有鲁棉研28号遗传背景的超鸡脚叶鲁棉研28号(LMY28-S,基因型为L2sL2s)、鸡脚叶鲁棉研28号(LMY28-O,基因型为L2o L2o)、亚鸡脚叶鲁棉研28号(LMY28-Su,基因型为L2u L2u)近等基因系。将LMY28-S、LMY28-O、LMY28-Su分别与LMY28-N杂交,F1基因型分别为L2s l2、L2o l2和L2u l2。以上材料均由山东省农业科学院经济作物研究所种植及保存。
本试验于2020年在山东省农业科学院经济作物研究所试验站(山东临清)进行,试验材料种植4行区,大小行种植,大行行距90 cm,小行行距72 cm,行长8m,株距20 cm,常规大田管理。
1.2 叶片形态参数的测量
测量近等基因系不同叶位叶片的主裂片长度(L1)和宽度(b1)、叶片长度(L)和宽度(b)[14],按照以下公式计算主裂深度比(Main lobe depth ratio,rL)及主裂宽度比(Main lobe w idth ratio,rb):rL=L1/L,rb=b1/b。
1.3 棉花基因组DNA提取
选取苗期嫩叶,利用CTAB法提取基因组DNA[22],利用Nanodrop 2000和琼脂糖凝胶电泳检测DNA的浓度与纯度。
1.4 L-D1等位基因启动子克隆及序列分析
在CottonFGD数据库(https://cottonfgd.org/)中提取陆地棉TM-1基因组中l2(基因ID:Gh_D01G2042.1 )起始密码子前约4 kb的启动子序列,利用Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物 (正向引物:GGTTCCAAGCCTCTCCACT,反向引物TCGTGGATACGATCTTCCCT),分 别 以LMY28-S、LMY28-O、LMY28-Su和LMY28-N的基因组DNA为模板进行PCR(Polymerase chain reaction,聚合酶链式反应)扩增,目的条带经1%(质量分数)琼脂糖凝胶电泳后分离,用胶回收试剂盒进行回收纯化,连接至pMD20T克隆载体并转化大肠杆菌感受态,筛选获得阳性克隆后送至北京擎科新业生物技术有限公司进行测序。利用BioEdit软件进行序列分析。
1.5 分子标记检测
分子标记检测所用的PCR及酶切过程参考试剂说明书。PCR所用的GoTaqDNA聚合酶反应体系购自普洛麦格生物技术有限公司,引物由北京擎科新业生物技术有限公司合成,NlaⅢ内切酶购于纽英伦生物技术有限公司,MfeⅠ内切酶购于宝日医生物技术有限公司。酶切产物用8%(质量分数)非变性聚丙烯酰胺凝胶进行电泳分离,用快速银染法染色观察。
1.6 数据统计分析
利用DPS 7.05 和MS Excel软件进行数据统计分析。
2 结果与分析
2.1 近等基因系主茎叶叶裂变化
由图1可以看出,棉花叶片叶裂的形成是一个渐变的过程,叶裂深度随叶位的增加逐渐加深,最后稳定。LMY28-S、LMY28-O、LMY28-Su和LMY28-N的第1片和2片真叶均无叶裂,第3片真叶开始出现叶裂,第4片至第8片真叶叶裂不断加深,从第9片叶开始叶裂深度基本保持不变,各叶位叶裂深度比均以LMY28-S最大,其次 为LMY28-O和LMY28-Su,LMY28-N最 小。从9叶期开始,LMY28-O、LMY28-Su和LMY28-N叶片的主裂深度比分别为0.94 、0.75 和0.58 。LMY28-S叶裂深度自第7片叶开始保持不变,主裂深度比为1(图2)。
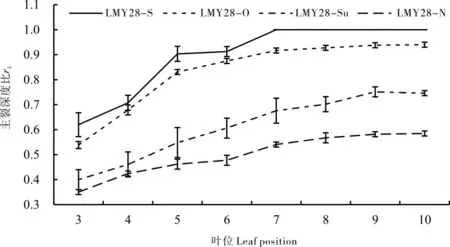
图2 4个近等基因系主茎不同叶位叶片的主裂深度比Fig.2 rL of leaf at different positions in four near isogenic lines
L-D1复等位基因的不同组合形成相似的叶形。如图3所示,超鸡脚叶的LMY28-S和常态叶LMY28-N杂交F1的叶形(图3A)与纯合的鸡脚叶LMY28-O叶形(图3B)极为相似,主裂深度比和主裂宽度比差异均不显著(图3G~H);亚鸡脚叶LMY28-Su和常态叶LMY28-N杂交F1的叶形(图3C)与纯合的亚鸡脚叶LMY28-Su叶形(图3D)也极为相似,二者的主裂深度比和主裂宽度比的差异均不显著(图3G~H)。
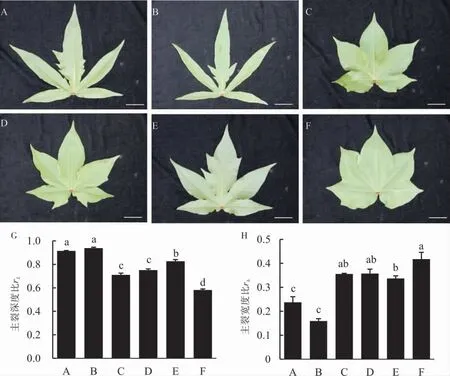
图3 不同材料第9片叶的形态Fig.3 Morphology of the ninth leaf of different cotton lines
2.2 L-D1等位基因启动子克隆及序列分析
克隆获得L-D1位点4个等位基因4 kb左右的启动子片段,序列分析发现2个缺失和24个SNPs(表1和附图1)。2个缺失分别为133 bp和14 bp,其中133 bp缺失于L2u和l2启动子区域。14 bp缺失位于L2s、L2o和L2u的启动子中。
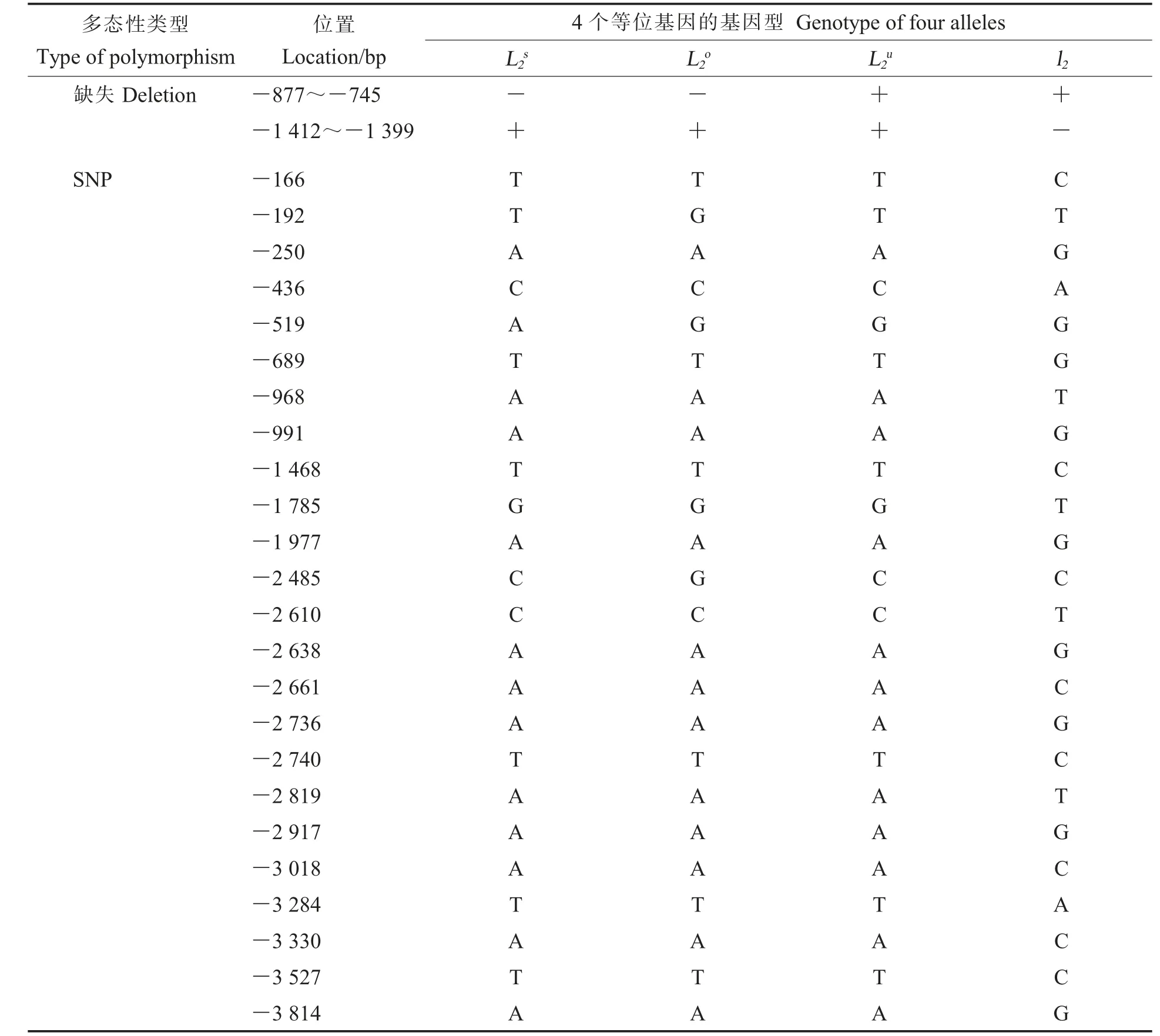
表1 L-D1等位基因启动子区域的差异位点Table 1 Polymorphism of L-D1 alleles promoter region

图1 4个近等基因系主茎不同叶位叶片形态变化Fig.1 Morphology of leaves at different positions in four near isogenic lines
L2s中有1个SNP,L2o中有2个SNP,其 它21个SNPs位点均位于l2中。SNP位点可用于开发酶切扩增多态性序列(Cleaved amplified polymorphic sequence,CAPS)标记或者衍生酶切扩增多态性序列标记(Derived cleaved amplified polymorphic sequences,dCAPS)标记,分析24个SNPs位点所在区域的序列,结合限制性内切酶信息发现-166 bp、-2 638 bp、-2 917 bp这3个位点所在区域分别包含NlaⅢ、CviAⅡ、A luⅠ的酶切位点,而其它位点可通过点突变与前后序列形成不同的内切酶切位点,如-192 bp和-519 bp的SNP可以通过突变分别形成MfeⅠ和NlaⅢ的酶切位点(表2)。
2.3 L-D1等位基因特异分子标记设计及检测
根据序列差异设计引物(表2),特异性鉴定各等位基因。利用l2基因编码区的8 bp缺失[20]设计分子标记InDel_8,是l2的特异分子标记(图4)。根据-192 bp处的SNP设计dCAPS_192标记,能将L2o同L2s、L2u、l2区分开,可作为L2o的特异分子标记(图4)。利用-519 bp处的SNP位点,在正向引物端引入了1个碱基替换(A替换为C),形成NlaⅢ的酶切位点,设计dCAPS_519标记可将L2s同L2o、L2u、l2区分开,可作为L2s的特异分子标记(图4)。

表2 L-D1叶形等位基因的特异分子标记Table 2 The specific DNA markers for L-D1 alleles
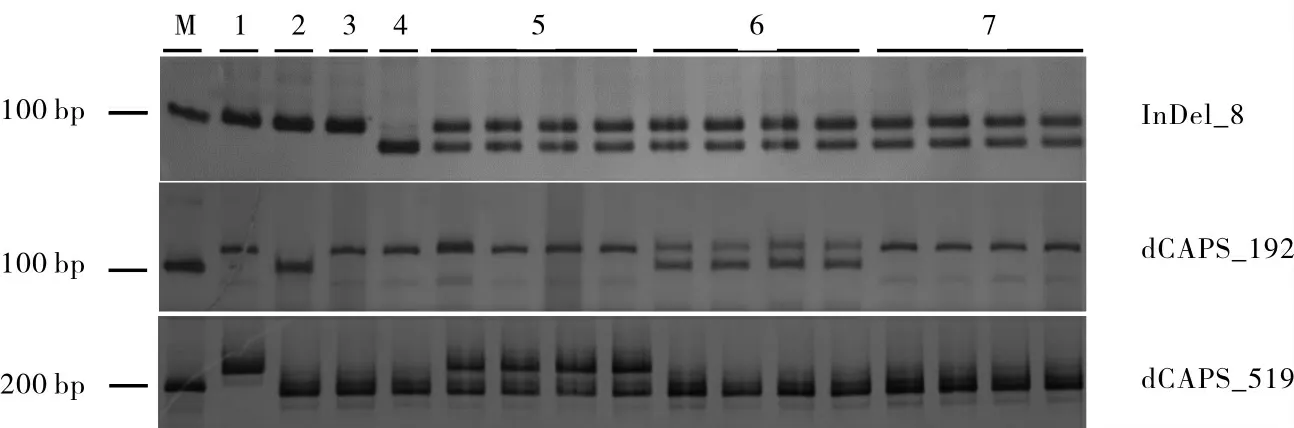
图4 不同叶形材料中L-D1等位基因的检测Fig.4 Detection of L-D1 alleles in different leaf shape materials
3 讨论
叶片不仅是作物最重要的光合器官,也是作物冠层结构的重要组成部分,因此一直是作物高光效育种研究的重点。在选育适于机械化收获的棉花品种过程中,叶形及冠层光合改良被视为提高光能向生物产量转化的关键因素[23-25]。在禾本科作物水稻和玉米中已发现多个与叶倾角[26-31]、叶片宽度[32-33]、卷曲度[26,34-35]及披垂度[36]等叶形性状相关的基因,为高光效品种培育提供了基因资源。棉花属于阔叶作物,且具有无限生长习性,叶片形状、枝条长度及角度变化比禾本科作物更复杂,这给棉花的冠层结构改良带来很大难度。
L-D1位点是目前可用于棉花冠层改良的重要基因资源。与其它控制叶形的基因位点不同,该位点包含4个复等位基因,两两组合可形成4种纯合叶形、6种杂合叶形,为从叶形的角度改良棉花冠层结构提供了多种选择[15]。但是由于4个复等位基因彼此间是不完全显性关系,组合后可生成相似的叶形,如纯合超鸡脚叶棉花与常态叶棉花杂交F1的叶形与纯合鸡脚叶极为相似,纯合鸡脚叶棉花和与常态叶棉花杂交F1的叶形与纯合亚鸡脚叶极为相似。在近等基因系转育过程中,我们发现纯合亚鸡脚叶棉花与常态叶棉花杂交F1的叶形与纯合亚鸡脚叶也极易混淆,因此需要借助于分子标记对其中的等位基因进行检测,准确鉴定不同叶形及其基因型。
基于插入缺失突变的共显性标记是区分纯合和杂合基因型的理想标记。图位克隆分析发现L-D1位点是1个HD-ZIP转录因子基因,l2基因5’端非翻译区、编码区和3’端非翻译区分别有6个、4个和1个特异性SNP,同时第3个外显子含有1个8 bp缺失;L2o和L2s在5’端非翻译区均含有1个特异性SNP和1个133 bp的重复序列[18-20]。为了获得可能的差异序列,本研究克隆了4个等位基因起始密码子上游4 kb左右的序列,经测序:在l2中新发现16个SNPs和1个14 bp的插入。基于l2第3个外显子中8 bp的缺失成功开发出l2特异分子标记InDel_8;基于14 bp的插入(缺失)未开发出标记,可能与其中脱氧腺苷酸含量较高有关(附图1)。
在棉花育种过程中,分子标记辅助选择主要针对遗传背景和关联性状。对遗传背景的选择是利用分子标记对棉花新品种进行复壮提纯和纯度检验[37-38],而关联性状的分子标记辅助筛选主要是基于基因定位、关联分析或者图位克隆获得与目标基因紧密连锁的分子标记或者功能标记。虽然紧密连锁的分子标记可以提高携带目标性状单株的筛选效率[39-40],但是由于交换的存在导致其筛选准确率低于基于目标基因内部序列开发的功能标记,因此功能标记是进行分子辅助选择的理想标记。本研究设计的功能标记,可保证对相应等位基因鉴定的准确性。
4 结论
L-D1位点的4个复等位基因可以调控棉花形成多种形态相似的叶片,本研究利用等位基因启动子及编码区的插入缺失突变、SNP开发了特异性分子标记,可准确鉴定4个等位基因,为L-D1等位基因的鉴定及其在棉花冠层改良中的育种应用提供技术支撑。
附件参见http://journal.cricaas.com.cn
附图1L-D1等位基因启动子序列比对分析
Fig.S1 Multiple sequence alignment of promotes ofL-D1alleles
