一株溶磷真菌的鉴定及其促生特性研究
2022-01-07艾加敏余天飞郑超超郭旻皓邓振山
李 静,艾加敏,余天飞,边 丹,郑超超,郭旻皓,邓振山
(1. 延安大学生命科学学院,陕西 延安 716000;2. 西北大学生命科学学院,陕西 西安 710069)
0 引言
【研究意义】磷作为植物生长发育不可或缺的元素,是植物根际生态位中经常出现的生长限制性养分,在农业生产中具有重要的地位。研究发现,由于理化性质问题导致土壤中磷的有效性降低,仅有0.1%的有效磷可以溶解在土壤中被植物吸收[1],这对植物的生长有着很大的影响。农业生产中常常通过施用磷肥或含磷量较高的复合肥来满足作物生产所需。但磷肥的过度使用会使环境养分流失,这会减少生物多样性并加剧气候变化,从而造成了一系列生态环境污染问题。针对这些问题,越来越多的研究者试图寻找高效溶磷微生物来提高农业中对磷的利用。【前人研究进展】长期以来,许多具有磷溶解能力的微生物被分离得到,这些能够通过溶解和转化使低效磷转为植物可吸收利用的有效磷的微生物,称为溶磷微生物(Phosphate-solubilizing microorganisms)[2]。它们能够通过改善植物磷营养而促进植物生长。目前为止,已经发现诸多具有溶磷能力的微生物种类,包括细菌、真菌和放线菌[3-5]。这些溶磷微生物能够有效提高土壤中有机酸的含量、降低土壤的酸碱度[6],通过螯合作用和离子交换反应等[7],溶解和转化难溶性磷,增强植物对磷素的吸收,从而促进植物的生长,减少磷肥滥用所带来的一系列问题。如许昌超等[8]从土壤中筛选出一株青霉菌株P6,发现其不仅能够提高土壤中的有效磷含量,还能促进小白菜生长和提高钙镁磷肥的肥效。朱德旋等[9]从北方寒地根际土壤中分离出一株高效溶解无机磷细菌,为微生物肥料的开发提供优良菌种。DA SILVA等[10]从南极地衣中分离的细菌被证明具有溶解磷酸盐的潜力,有助于减少化肥的使用。总之,植物通过微生物的参与来协调其发育,以优化磷的捕获并调节植物的总体生长。【本研究切入点】目前,有关溶磷微生物的研究较多,但均集中在以细菌为主的研究上,而关于具有溶磷作用真菌的遗传特征,在很大程度上都是未知的,特别是专门针对小麦田土壤溶磷真菌的研究更是鲜有报道。鉴于此,本文通过探明一株具有高效溶磷能力的真菌菌株及其促生效应,以揭示其溶磷策略和促生特性。【拟解决的关键问题】从小麦田土壤中分离得到一株具有溶磷能力的真菌R3,通过形态观察和ITS序列分析对菌株进行鉴定,采用液体培养测定菌株对Ca3(PO4)2、AlPO4和FePO43种不同磷源的溶解能力,并通过盆栽试验测定其对小麦生长的影响,以期为农业生产中微生物菌剂的开发提供资源。
1 材料与方法
1.1 供试培养基及试剂
供试培养基包括PDA培养基[11]和无机磷培养基[12]。主要试剂包括5 mg·L-1标准磷溶液;钼锑抗显色剂;0.2%二硝基酚指示剂;2 mol·L-1NaOH溶液;0.5 mol·L-1H2SO4溶液。
1.2 样品采集
土样于2019年6月采自陕西省延安市宝塔区河庄坪镇的小麦田(36°63′97″N,109°32′07″E,暖温带大陆季风性气候),在刚收割完小麦的田地按5点采样法进行采集,选取一个中心点,向周围等距等角扩散至4个点,用无菌铲采集深度10~20 cm的土壤,装入已灭菌的密封袋中带回实验室,置于4 ℃冰箱中保存备用。
1.3 溶磷菌的分离筛选
称取10 g供试土壤于250 mL三角瓶中(含90 mL无菌水及少量玻璃珠),160 r·min-1振荡30 min,制成土壤悬液。取100 μL于灭菌的离心管中,在无菌操作台进行梯度稀释至10-5,取10-3、10-4、10-5稀释液各30 μL,采用梯度稀释法分别涂布至无机磷固体培养基上,每个稀释梯度重复3次,28 ℃恒温培养5~7 d。挑取有透明圈产生的菌落,反复纯化至少3次,转接于试管斜面上,4 ℃冷藏备用[10,13]。同时将纯化的菌株3重复分别接种于无机磷固体培养基上,28 ℃培养5~7 d,记录溶磷圈的直径比(D/d)。
结合定性结果,选出本试验中具有明显溶磷效果的一株真菌,对其进行进一步的研究。
1.4 溶磷菌的鉴定
1.4.1 形态学特征鉴定 将菌株接种于PDA固体培养基培养,观察菌落的形状、颜色和大小等,依据魏景超《真菌鉴定手册》[14]对其形态学特征进行描述。
1.4.2 DNA提取和鉴定 用PDA培养基活化菌株后,采用改良CTAB法[15]进行DNA的提取。然后选用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGC GG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR扩增体系25 μL:模板1.5 μL,2×PCRTaqMaster Mix 12.5 μL,正反引物各1 μL,灭菌双蒸水9 μL。扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸90 s,30次循环;72 ℃再延伸10 min[16]。然后用1%的琼脂糖凝胶验证PCR产物,将有条带的菌株送至北京擎科生物有限公司进行测序。将获得的基因序列提交到NCBI和已知序列进行比对,并申请GenBank菌株登录号,运用MEGA X软件,选用邻接法(Neighbourjoining)构建系统发育树[17]。
1.5 菌株对不同磷源的溶解能力
为了检测菌株对不同无机磷源的溶解能力,选用Ca3(PO4)2、AlPO4和FePO4分别作为培养基中的无机磷源,其他成分保持不变。将溶磷定性效果明显的菌株接种至PDA液体培养基中,28 ℃、160 r·min-1摇床培养7 d,用无菌水调成含量为1×108cfu·mL-1的菌悬液,以1∶100(V/V)比例接种至含有不同磷源的无机磷液体培养基中,28 ℃、160 r·min-1摇床培养7 d,每24 h取一次样,12000 r·min-1离心10 min取上清液,利用钼锑抗比色法[18]测定有效磷含量,同时记录菌液pH,每组试验3个重复。试验以不接种菌液的无机磷液体培养基作对照。
1.6 菌株对小麦的促生效果盆栽试验
于宝塔区河庄坪镇小麦田地内采集盆栽试验所需土壤,采回后过筛,灭菌,分装至塑料盆(上口径15 cm×高12.5 cm×底径10.5 cm)中,每盆1 kg。菌悬液的制备同1.5。选取相对饱满的小麦种子,具体处理方法参照文献[19]进行。
试验设置6个处理:①以Ca3(PO4)2为无机磷源的接菌处理;②以AlPO4为无机磷源的接菌处理;③以FePO4为无机磷源的接菌处理;④以Ca3(PO4)2为无机磷源的不接菌对照处理;⑤以AlPO4为无机磷源的不接菌对照处理;⑥以FePO4为无机磷源的不接菌对照处理。每处理3个重复。
将每种无机磷源按照0.5 g·kg-1的用量均匀混合至土壤中[8]。将露白的种子播种于各处理花盆中,每盆30粒,出苗后定苗为10株。孢子悬液(1×108cfu·mL-1)按照10 mL·kg-1的用量灌根施加到土壤中。每隔3 d给所有处理浇灌一次无菌水,30 d后测定小麦的株高、根长、鲜重、干重和叶绿素含量等农艺指标。同时测定土壤有效磷含量和pH。
1.7 数据分析
运用 Microsoft Excel 2010 进行数据处理。运用软件SPSS Statistics 26.0进行统计学分析。运用Graphpad Prism 8进行统计作图。
2 结果与分析
2.1 溶磷真菌的筛选
通过初筛,发现1株平板溶磷效果较好的真菌,编号为R3。将菌株R3接种至无机磷培养基上培养72 h,可观察到平板上出现明显的溶磷圈(图1)。设置5个重复进行确认,结果显示溶磷圈直径D平均值为27.99 mm,菌落直径d平均值为19.26 mm,D/d为1.45。
2 .2 溶磷菌的鉴定
2.2.1 形态学特征鉴定 将真菌菌株R3接种于PDA培养基上,放入恒温箱于28 ℃培养,4 d时测得菌落直径为21.95~35.54 mm,菌落表面中心为青绿色,周围为白色,无渗出液,背面为淡黄色(图2)。8 d时测量,菌落直径41.33~48.68 mm,菌落表面中心为黄绿色,有渗出液,周围为白色,背面为淡黄色(图3)。普通光学显微镜下观察,可见分生孢子梗细长,顶部呈帚状,对称,分生孢子梭形(图4)。
图3 菌株R3的菌落培养特征(8 d PDA培养结果)Fig. 3 Colony characteristics of cultured R3 on PDA for 8 days
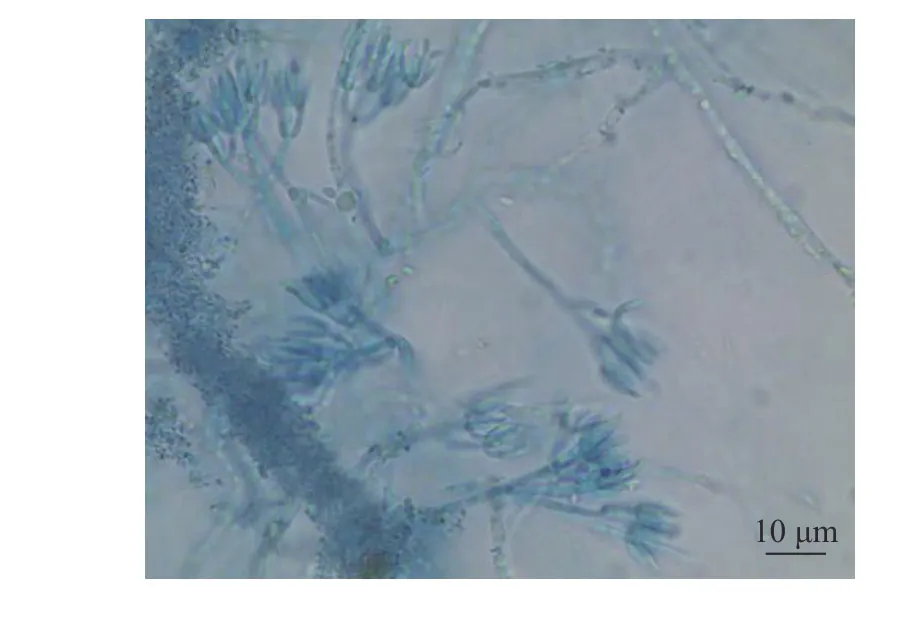
图4 菌株R3形态特征(×400)Fig. 4 Morphological characteristics of strain R3(×400)
2.2.2 菌株分类鉴定 将菌株R3的ITS序列提交至NCBI的GenBank 数据库,获得菌株登录号为MZ031393。从GenBank中选择与R3序列同源性在98%以上的真菌序列,通过Mega X软件,采用Neighbor-joining法构建系统发育树。结果表明(图5),菌株R3与产红青霉菌(Penicillium rubens)同属一个分支,同源性达到100%,故可判断该菌株归属为青霉菌Penicilliumsp.。

图5 基于ITS序列同源性构建菌株R3的系统发育树Fig. 5 Phylogenetic tree of R3 constructed based on homology of ITS sequence
2.3 菌株R3对不同磷源的溶解能力
图6-A显示了菌株R3在以Ca3(PO4)2、AlPO4和FePO4为磷源的液体培养基中的溶磷量变化趋势。结果显示,菌株R3对3种不同磷源的溶解能力均呈先升高后逐渐稳定的趋势。其中,对Ca3(PO4)2的溶解能力在第4天时最高,为328.79 mg·L-1;对AlPO4的溶解量在第4天达到顶峰,为95.99 mg·L-1;对FePO4的溶解量在第5天时最高,为75.39 mg·L-1。溶磷量Ca3(PO4)2>AlPO4>FePO4,可见菌株R3对Ca3(PO4)2有较强的溶磷能力。
图6-B显示了菌株R3对不同磷源培养基pH的影响,总体呈先下降后平稳的趋势。以Ca3(PO4)2和FePO4为磷源的培养基在第4天后趋于稳定,以AlPO4为磷源的培养基在第5天后趋于稳定。
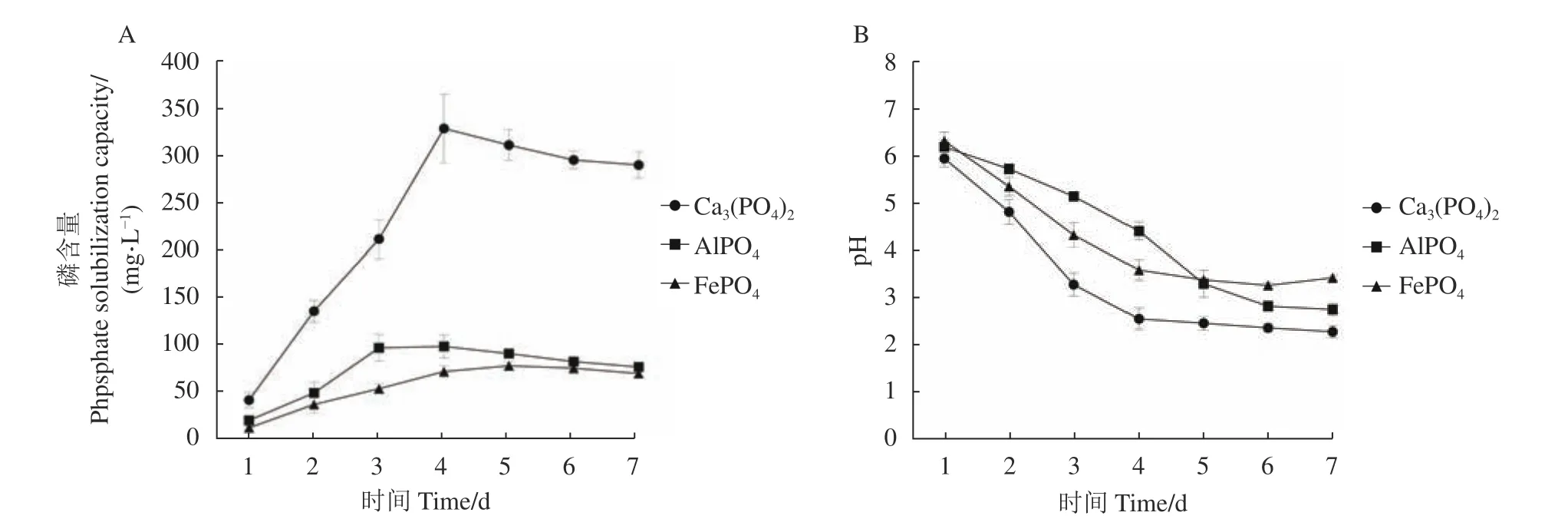
图6 菌株R3的溶磷量及pH变化Fig. 6 Phosphorous solubilization by R3 with changing medium pH
2.4 菌株对小麦的促生效果盆栽试验
表1显示了菌株R3处理的小麦在室外培养30 d后的农艺性状。结果表明:与未接菌的对照组相比,接种R3菌液后小麦幼苗的农艺性状均有所增加。在株高、根长、鲜重和叶绿素含量方面分别提高了18.23%~35.65%、27.63%~50.44%、37.99%~50.94%和9.59%~19.57%。其中,菌株R3在以Ca3(PO4)2为磷源的处理中对小麦的促生效果最好,与对照相比,小麦的株高、根长、鲜重和叶绿素含量分别提高了35.65%、50.44%、50.94%和19.57%。菌株R3在不同难溶磷源处理中对盆栽小麦的促生效果表现为Ca3(PO4)2>AlPO4>FePO4。
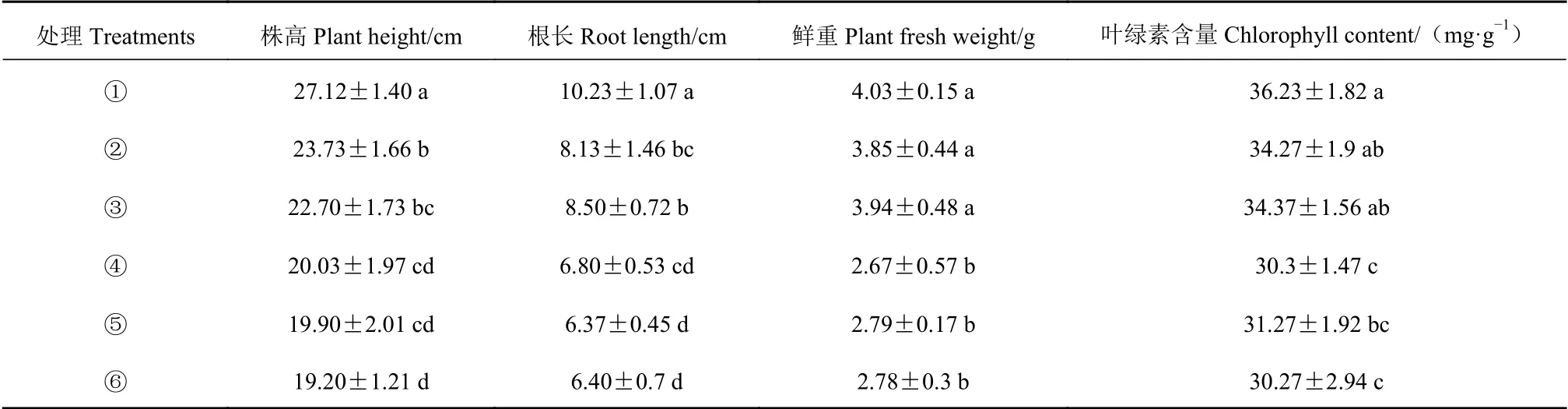
表1 真菌菌株R3菌处理的小麦幼苗的农艺性状Table 1 Agronomic traits of wheat seedlings in presence of growth-promoting R3
3 讨论与结论
目前,已有许多关于溶磷青霉菌的研究报道,包括P.oxalicum[20]、P.aculeatum[21]、P.bilaiae[22]和P.brocae[8]等。本试验从小麦田土壤中筛选得到一株具有溶磷能力的P.rubens菌株,目前尚未发现关于该种青霉菌在溶磷方面的报道。赖鉴添等[23]从甘蔗叶堆肥中筛选出一株具有高效溶磷及促生功能的菌株DC30-2-P1,在无机磷培养基28 ℃培养7 d,测得菌落直径为55.33 mm,溶磷圈直径达65.33 mm,D/d为1.18;赵龙飞等[24]从大豆根瘤中筛选得到的菌株DD291,菌落直径仅为4.20 mm,溶磷圈直径却达到39.70 mm,定性表现具有很强的溶磷能力。本研究通过平板定性试验,发现菌株R3在无机磷培养基上的溶磷圈直径为27.99 mm,菌落直径为19.26 mm,D/d为1.45,具有较好的溶磷能力。
大量研究表明,同一菌株对不同难溶性磷酸盐的溶解能力不同,普遍现象是对磷酸钙的溶解能力大于磷酸铝和磷酸铁。吕俊等[16]从马尾松根际土中分离得到的伯克霍尔德菌WJ27对4种难溶性磷酸盐的溶解能力依次为Ca3(PO4)2>AlPO4>FePO4>CaHPO4·2H2O。李豆豆等[25]从番茄根际土壤中筛选的解磷真菌PSF1对Ca3(PO4)2的溶解量最大,为869.62mg·L-1,其次为AlPO4、FePO4。王丹等[26]研究发现出芽短梗霉F4对4种难溶性磷酸盐溶磷能力大小依次为磷酸铝>磷酸铁、磷酸钙>磷矿粉,溶磷量均超过200 mg·L-1,表现出较强的溶磷能力。本研究发现菌株R3对Ca3(PO4)2的溶解能力最高达328.79 mg·L-1;对AlPO4和FePO4的最高溶解量分别为95.99 mg·L-1和75.39 mg·L-1,溶磷量Ca3(PO4)2>AlPO4>FePO4。此外,菌株R3对不同磷源培养基pH总体呈先下降后平稳的趋势。这可能是因为菌株R3在液体培养过程中产生了某些有机酸导致培养基的pH下降,其具体机制还需进一步深入研究。
溶磷真菌对植物具有显著的促生作用[27]。本试验以小麦作为供试材料,对溶磷菌R3的促生效果进行验证。盆栽结果显示,与未接菌的对照组相比,菌株R3对小麦的株高、根长、鲜重和叶绿素含量等均有促进作用,尤其是以Ca3(PO4)2为磷源时,小麦鲜重可提高50.94%。说明其能有效促进作物生长,可为微生物肥料的开发提供优质的种质资源。
