云南野生牛肝菌中重金属的生物有效性及健康风险评估
2022-01-06李梦莹保欣晨马娇阳
李梦莹,王 坤,保欣晨,马娇阳,田 稳,于 淼,郭 磊,向 萍,*
(1.西南林业大学生态与环境学院,云南 昆明 650224;2.西南林业大学生命科学学院,云南 昆明 650224)
云南作为中国和世界的野生食用菌主产区,有“野生食用菌王国”的美誉,全省16个地州均有野生菌分布,全国约70%的野生食用菌产自云南[1]。据统计,云南野生菌年均量50万 t左右,产值达100多亿 元,其中多种野生菌远销美国、日本等40多个国家和地区,年出口创汇达1.2亿 美元[2]。在云南出口的野生食用菌中,牛肝菌占绝对比重,其出口量占全国牛肝菌出口总量的71%,创汇金额占全国总额的65%,是全国最大的野生牛肝菌产地[3]。野生食用菌出口已成为云南省食用菌产业的重要组成部分,对云南地区经济发展、农民脱贫增收具有十分重大的社会意义。
云南属于土壤背景值较高的地区,加之近年来云南城市化和工业化进程的加快,野生食用菌受到各种重金属污染物的威胁,因此云南野生食用菌的质量是一个值得关注的重要问题,也引起了人们对其健康风险的广泛关注和担忧[4]。因有害物质超标问题,国家和地区陆续出台了一系列“绿色壁垒”措施,影响了云南野生食用菌的产业化发展和出口创汇。有研究表明牛肝菌富含人体所需的多种微量元素,但也会富集一些对人体有害的重金属元素如镉(Cd)、铅(Pb)和铬(Cr)等,其生物富集金属离子的能力和积累重金属的能力也受到环境因素的影响[5-6]。因此准确评估云南牛肝菌中重金属超标的人体健康风险和危害,对有效控制重金属暴露、保障民生健康和推动云南野生食用菌产业的可持续发展具有重要意义。
现有的健康风险评价模型大多基于污染物总量,而非人体实际吸收剂量,因此很难精准评估其人体健康风险和危害[7]。虽然现有评价模型能快速预测出污染物的潜在风险,但其预设认为污染物进入人体胃肠道后100%被吸收,然而并不是所有摄入的污染物都是生物可利用的,这样很可能会高估人体摄入量[8]。因此,研究人员开发出体外消化模拟实验,可以很好地模拟人体胃肠道,如生理原理提取法(physiologically based extraction test,PBET)、生物可给性研究(solubility bioavailability research consortium,SBRC)、欧洲生物可给性标准法(unified barge method,UBM)、体外胃肠道法(in vitrogastrointestinal,IVG)等[9-10]。尽管体外胃肠模拟法得到了广泛的应用,但是由于其缺乏人体肠道细胞成分,因而很难准确模拟胃肠道的生理功能。近年来,为了克服体外胃肠模拟法的不足,研究者们纷纷建立了体外胃肠模拟法结合Caco-2细胞模型的复合体系用于模拟人体对重金属生物有效性研究,并证实与体外胃肠模拟法相比,复合体系更科学合理[11]。但是应用体外胃肠模拟法结合Caco-2细胞模型对云南牛肝菌中重金属的生物有效性开展的研究仍然鲜见报道,大多数研究是对新鲜牛肝菌进行的,而关于干牛肝菌中重金属含量的研究是缺少的。牛肝菌的出口比重高达85%以上,鉴于新鲜的牛肝菌含水量高、组织脆嫩、不易久放,在运输过程中新鲜牛肝菌的损伤也较大,对其产业的发展不利,所以将牛肝菌制成干品已成为现在出口及日常食用的常见形式,且干牛肝菌的商业化和消费量也是逐年增加[12-14]。根据研究显示,新鲜菌类在干燥的过程中不会造成其营养价值的显著损失,但由于水分的流失,这一过程明显提高了酚类化合物、碳水化合物和蛋白质的含量,所以这一脱水过程对金属元素或许也有同样的效果[15]。
针对以上研究动态和存在的问题,本研究以云南主产区(楚雄、曲靖、大理和普洱)不同野生干牛肝菌(按颜色分为白牛肝菌、黑牛肝菌、红牛肝菌和黄牛肝菌)为研究对象,分析其Cd、Pb和Cr的总含量;采用SBRC法测定干牛肝菌中Cd、Pb和Cr的生物可给性含量;结合Caco-2细胞探究食用后被吸收重金属的情况;运用估计每日摄入量(estimated daily intake,EDI)公式对不同模拟方法得出的牛肝菌中重金属含量进行健康风险程度的比较;最后更深入分析食用重金属含量高的牛肝菌对人体肠道细胞的影响。研究结果可为准确评估干牛肝中重金属超标的人体健康风险提供理论依据,也为其提供新的思路,对推动云南干牛肝菌的产业发展具有重要意义。
1 材料与方法
1.1 材料与试剂
不同野生干牛肝菌(白牛肝菌、黑牛肝菌、红牛肝菌、黄牛肝菌)采集于云南4个主产区(楚雄、曲靖、大理和普洱),于当地市场购买。
人结肠腺癌Caco-2细胞 美国模式菌种收集中心(American Type Culture Collection);浓硝酸(优级纯)美国默克公司;30%过氧化氢(分析纯) 天津风船化学试剂科技有限公司;猪胆盐 上海麦克林生化科技有限公司;胰酶 上海源叶生物科技有限公司;最低基础培养基(minimum essential medium,MEM)、胎牛血清、pH值为7.2~7.4的0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)、0.25%(质量分数)胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液 武汉普诺赛生命科技有限公司;青霉素-链霉素溶液 美国HyClone公司;3516型6 孔细胞培养板 美国康宁公司;十二烷基硫酸钠 北京索莱宝生物科技有限公司;甘氨酸、BCA蛋白定量试剂盒、总RNA快速提取液、cDNA第一链快速合成试剂盒、2×SYBR Green qPCR Master Mix试剂 南京翼飞雪生物科技有限公司;GBW10048(GSB-26)芹菜标准物质中国地球物理地球化学勘查研究所。
1.2 仪器与设备
ICAPQR电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)仪、Forma™ Steri-Cycle™二氧化碳培养箱 美国赛默飞世尔科技公司;TS-100倒置显微镜 日本尼康公司;SpectraMax Plus 384酶标仪 美国分子仪器公司;Q5000超微量核酸蛋白测定仪 美国Quawell公司;LightCycler 480 II荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪瑞士罗氏集团。
1.3 方法
1.3.1 牛肝菌预处理、元素含量的测定与质量控制
牛肝菌预处理:将4个主产区的不同干牛肝菌置于冷冻干燥机中干燥至恒质量,用瓷研钵磨粉碎后过100 目标准筛,常温保存于聚乙烯自封袋备用。
根据美国环境保护局方法3050B,用浓硝酸和30%过氧化氢消化样品(0.10 g,干质量),参考文献[9]使用ICP-MS法测定牛肝菌中重金属(Cr、Cd和Pb)的含量(均以干质量为计,后同),每个处理有3个重复,为保证仪器测量结果的准确性,选择GBW10048(GSB-26)芹菜标准物质进行控样,其结果在合理区间内。
1.3.2 生物可给性测定
模拟胃液和模拟模拟胃液和模拟肠液的均参考文献[16]配制,其pH值以12 mol/L盐酸溶液、NaOH饱和溶液调节。本研究采用SBRC法将20 mL模拟胃液(30.03 g/L甘氨酸,pH 1.5)加入装有1 g牛肝菌粉末的50 mL离心管中,混匀后37 ℃下以150 r/min速度摇动1 h模拟胃消化,然后立即将混合物以4 000 r/min的速度离心10 min收集上清液,向离心后的残渣中加入20 mL模拟肠液(1.75 g/L胆盐、0.5 g/L胰酶,pH 7.0),然后在37 ℃下以150 r/min的速度摇动4 h模拟肠消化,然后在4 000 r/min下离心10 min,收集上清液。两次离心后的上清液经0.45 μm过滤器过滤后通过ICP-MS测定模拟胃液和模拟肠液中的重金属含量[9]。模拟胃液、肠液的空白品均纳入质量保证范围,每个样品中重金属的胃和肠道生物可给性定义为模拟胃液和模拟肠液中的重金属含量(生物可给性含量)占消化前总含量的百分比。
1.3.3 生物有效性含量测定
将Caco-2细胞以106个/mL的密度接种于6 孔板中培养,待14 d后形成单层,将1.3.2节离心后的模拟肠液与MEM基础培养基等体积混合暴露Caco-2细胞4 h,然后用4 ℃的PBS冲洗细胞两次,去除细胞外结合的重金属,再加入2 mL质量分数1%十二烷基硫酸钠溶液裂解,收获细胞裂解液。取出20 μL细胞裂解液采用BCA蛋白定量试剂盒和酶标仪进行蛋白含量测定,将剩余裂解液放入消解管中,加入5 mL 75%(体积分数)硝酸和1 mL 30%(体积分数)过氧化氢消解。冷却后,使用蒸馏水(屈臣氏)将所得溶液稀释至10 mL,通过ICP-MS测定最终溶液中重金属的含量[9]。最终将细胞内的重金属(Cr、Cd和Pb)含量记为生物有效性含量,单位为μg/mg,结果以蛋白质量计。
1.3.4 人体健康风险评估
根据1.3.1节、1.3.2节计算出来的干牛肝菌中重金属总含量C1/(mg/kg)、生物可给性含量C2/(mg/kg)、生物有效性含量C3/(μg/mg)及其牛肝菌平均消费量W/(g/d)按下式计算重金属EDI。如果EDI大于1,则可能对人体健康产生不利影响[17]。
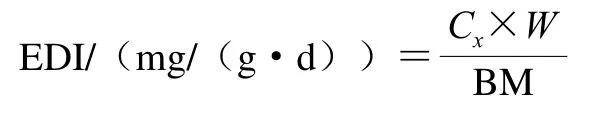
式中:Cx表示C1、C2、C3;W是18~65 岁成人(100 g/d)或7~14 岁儿童(55 g/d)的牛肝菌平均消费量;BM是成人(55.9 kg)或儿童(32.7 kg)的平均体质量。W和BM参考中国营养学会编著的《中国居民膳食指南2016》。
1.3.5 实时荧光定量PCR分析肠道细胞炎症相关基因表达
将模拟肠液与MEM基础培养基等体积混合暴露Caco-2细胞4 h(37 ℃)后,用总RNA提取试剂提取Caco-2细胞中的总RNA,超微量核酸蛋白测定仪测量RNA的浓度和质量,纯化后的RNA通过试剂盒转录成cDNA,用2×SYBR Green qPCR Master Mix和引物对白细胞介素-8(interleukin-8,IL-8)的基因进行实时荧光定量PCR,并采用2-ΔΔCt方法计算基因的相对表达量,反应循环设置为:先95 ℃、10 min,再以两步法(95 ℃、15 s,60 ℃、1 min)进行40个循环[18]。循环结束后,设置从65 ℃以0.5 ℃/s匀速升温97 ℃并连续采集荧光值,获取熔解曲线,以检查引物扩增的特异性。引物来自哈佛大学PrimerBank(表1),内参基因为GAPDH。

表1 实时荧光定量PCR引物Table 1 Primers for real-time polymerase chain reaction used in this study
1.4 数据处理与分析
数据采用平均值±标准差表示,所有数据均使用Excel软件进行处理。采用Origin 2018绘图,通过GraphPad Prism Version 8.0软件进行数据的统计学分析。
2 结果与分析
2.1 云南主产区牛肝菌中重金属污染特征
如图1所示,云南各主要产区不同干牛肝菌中Cr、Cd和Pb范围分别为0.7~2.2、31.5~51.1 mg/kg和1.1~4.9 mg/kg。3 种重金属元素中干牛肝菌的Cd含量最高(平均41.5 mg/kg),其次是Pb(平均2.4 mg/kg)和Cr(平均1.2 mg/kg)。不同主产区中干牛肝菌重金属含量之和最高的为普洱-红牛肝菌34.4 mg/kg、楚雄-红牛肝菌54.5 mg/kg、曲靖-黄牛肝菌50.2 mg/kg和大理-黄牛肝菌51.3 mg/kg。GB 2762—2017《食品安全国家标准 食品中污染物限量》对食用菌及其制品中Cr、Cd和Pb的含量做出了限定,分别不得超过0.5、0.2、1 mg/kg(其限量标准中未对食用菌中Cr作规定,故使用新鲜蔬菜的标准)。由于本研究的干牛肝菌是由新鲜牛肝菌脱水加工制成的干制品,需根据Wang Xuemei等得出新鲜蘑菇干物质质量分数约为10%进行换算[19]。假定新鲜牛肝菌中水分质量分数为90%,则标准限量中Cr、Cd和Pb含量的上限为5、2、10 mg/kg。由图1可知,在测定主要产区的不同干牛肝菌中Cd含量全部超过限量值(平均含量约是限量值的20 倍),Cr和Pb含量在安全范围内。由此可见,相对于其他元素,干牛肝菌中Cd更容易被富集。有研究发现Cd含量在菌类中含量也很高(可高达50 mg/kg),在未受污染的地区生长的牛肝菌中Cd含量最高可达5 mg/kg[20]。Jarzyńska等[21]研究也发现牛肝菌类中Cr、Pb和Cd富集系数平均值为0.10、0.02和5.90,表明Cd相对其他两种元素更容易被累积。不同的研究也表明牛肝菌中Cd含量(8.9~129.1 mg/kg)和富集系数较高,具有一定的富集能力,尤其是黑牛杆菌[22-23]。而不同干牛肝菌中Cr含量普遍偏高,且差异较小,可能与新鲜牛肝菌制成干品的方法有关,常用的干燥方法有自然干燥、热风干燥、真空冷冻干燥等,其中高温干燥可使有毒元素转化,其过程中水分和其他可溶化合物的损失而使其浓度升高,会导致其含量变化[24-27]。除此之外,牛肝菌中重金属的含量还与生长环境有关系,如鲍长俊[28]在研究曲靖和普洱地区的灰褐牛肝菌中发现,曲靖地区的牛肝菌含Cd含量较高,与该区工业污染较为严重密切相关。
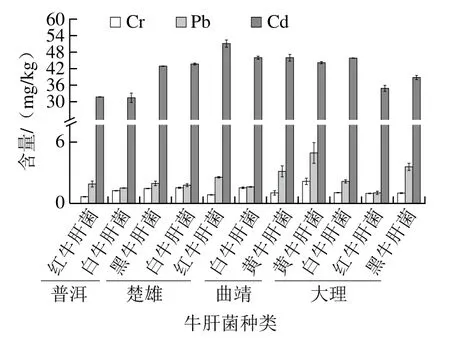
图1 不同牛肝菌中Cr、Cd和Pb的分布特征Fig. 1 Mean contents of Cr, Cd and Pb in wild edible dried bolete from four main production areas of Yunnan
新鲜可食用的牛肝菌种类很多,也很容易混淆,尤其是市场上出售的干牛肝菌会把易混淆的牛肝菌掺在一起出售,因此将本研究干牛肝菌的重金属数据与文献进行了比较(表2)。
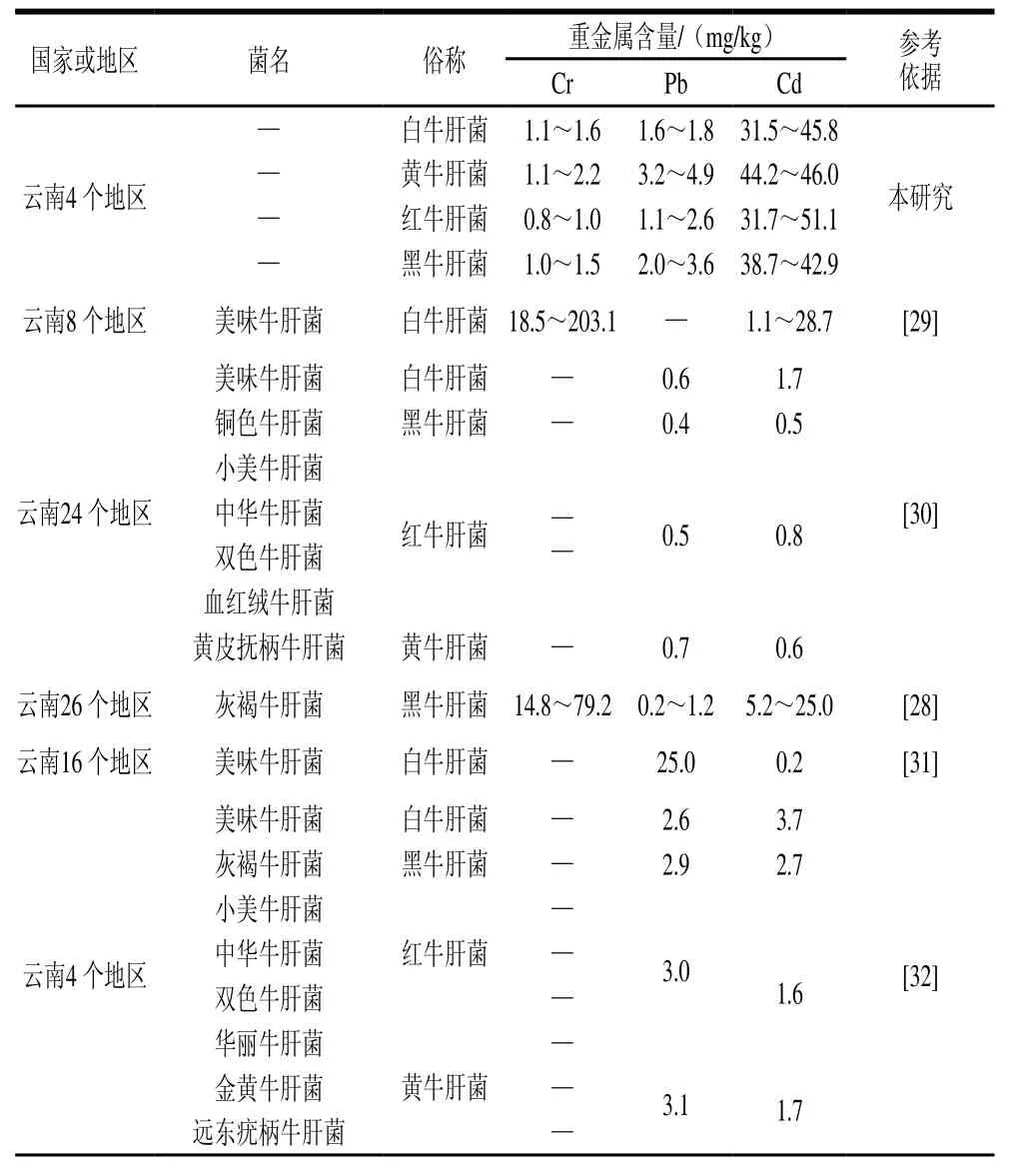
表2 野生食用牛肝菌中重金属含量与文献资料的比较Table 2 Contents of heavy metals in wild edible bolete compared to literature data
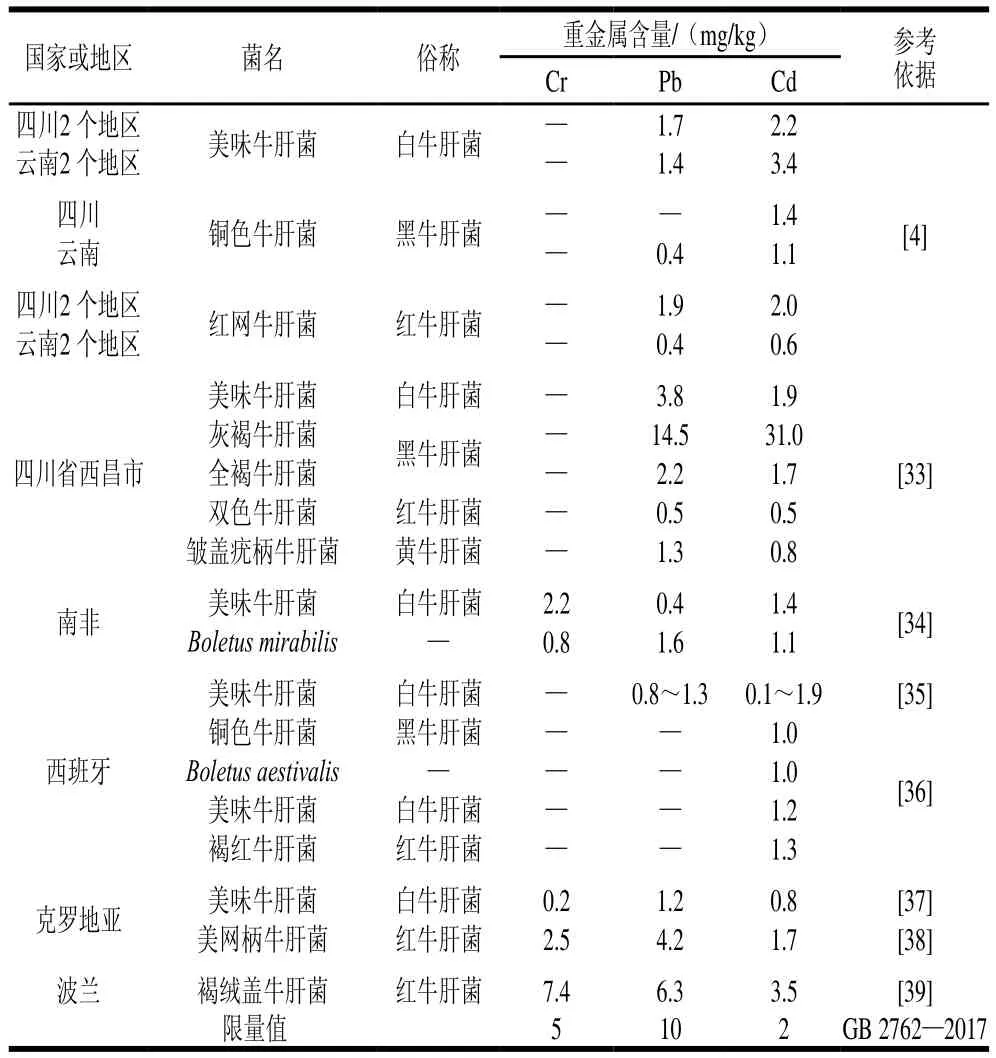
续表2
云川地区牛肝菌中重金属含量普遍超过限量值,而国外的牛肝菌相对较为安全,与不同地区土壤重金属背景值有关[30,34,39-40]。其中云南、四川地区的Cr含量普遍较高,与本研究结果不一致,但与国外的牛肝菌中Cr含量相似,可能是周围环境污染所致,工业排放的废气和废水是环境中Cr的主要来源,如杨美智子[41]研究云南省曲靖花山地区牛肝菌发现其含量高达18.7 mg/kg,与该地区有工业园区有关,而牛肝菌中Pb含量都在1.0~4.0 mg/kg范围内,可能是因为采集地远离工业采矿区,受到公路汽车尾气的的影响小,所以其含量较低。值得注意的是本研究中干牛肝菌Cd的平均含量约是GB 2762—2017标准限量值的20 倍,为了更为准确地评估其人体健康风险,本研究借鉴了目前国际上广泛使用的生物有效性进行进一步的评估。
2.2 基于SBRC法测定干牛肝菌中重金属的生物可给性的结果
基于SBRC体外模拟法中干牛肝菌的重金属生物可给性如图2所示。模拟胃液中Cr、Cd和Pb的平均生物可给性分别为18.2%、3.1%和17.0%(3 种重金属的平均生物可给性为12.8%),在模拟肠液中分别下降到15.3%、0.6%、5.5%(3 种重金属的平均生物可给性为7.1%),说明重金属在胃肠消化中可能被人体吸收。本研究中生物可给性较低,可能是重金属没有完全溶出,因此不会在胃肠中积累,对人体造成健康风险。先宏等发现食用香菇中Cd的生物可给性在胃消化阶段(12%)比肠消化阶段(6%)高[42]。Chiocchetti等研究发现西班牙市场上干菌类Cd的平均生物可给性为18%,而Pb的生物可给性低于仪器检出限,虽然与本研究结果不一致,但该研究也指出,干菌类中重金属生物可给性低可能是由于样品的消化率本来就低或者是与在消化过程中干菌类释放的其他元素形成了低溶解度的化合物[35]。而与蔬菜类的研究对比发现蔬菜类的生物可给性普遍都高,如Hu Junli等[43]研究香港蔬菜中Cd、Cr和Pb的生物可给性分别为14%~71%、7.1%~25%、5.7%~18%(胃阶段)和8.3~20%、16%~42%、39%~64%(肠阶段)。同样,Fu Jin等[44]报道,Pb(小白菜)在胃和肠消化阶段的生物可给性分别为9%和19%,Cd分别约为65%和40%(PBET)。Mnisi等[45]使用PBET胃肠模拟法测量了斯威士兰叶菜中Cd、Cr和Pb的生物可给性分别为63.4%、59.1%、61.1%(胃阶段)和23.3%、31.6%、29.6%(肠阶段)。蔬菜类的生物可给性比本研究普遍都高的原因可能在于样品消化过程中,由于各种因素的影响,金属在不同胃肠道系统以及不同种类中的生物可给性差异大,这些因素包括不同样品中是否存在竞争离子、蛋白质和矿物质,以及使用的不同胃肠模拟方法的物理和化学条件等[46]。
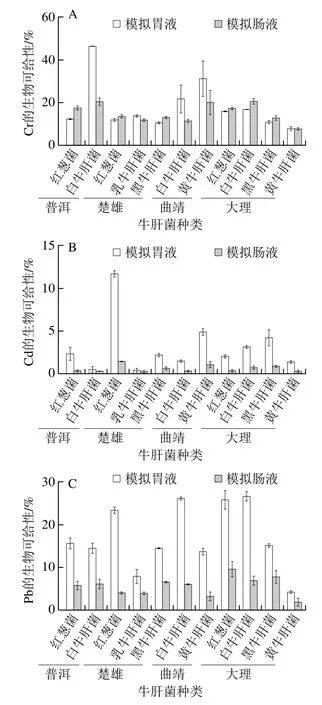
图2 不同地区干牛肝菌中Cr(A)、Cd(B)和Pb(C)的生物可给性Fig. 2 Bioaccessibility of Cr (A), Cd (B) and Pb (C) in wild edible dried bolete from four areas of Yunnan
总的来说,模拟胃液中Cr、Cd和Pb的生物可给性明显高于模拟肠液。胃液的低pH值可能会导致金属与碳水化合物和蛋白质之间的化学键断裂,从而导致金属在胃中大量释放,但在肠阶段中不会出现此现象[47]。与其他研究中Pb的生物可给性相比,本研究中Pb在人体胃肠道中的生物可给性较低可能是由于肠壁上其他物质与铅离子结合后抑制了其穿过细胞膜[44]。营养元素也可能影响生物可给性,研究表明,营养元素(如Ca)的缺乏也会导致Cd在人体肠壁的累积[46]。研究发现,与大多数重金属相比,Cr对胃蛋白酶的亲和力更强,可能会导致其生物可给性高[48-49]。干牛肝菌中重金属生物可给性受多种因素的影响,如纤维素酶和植酸盐的超细纤维、植物螯合素、营养特性、微生物生理过程、金属种类及其形态等[50-52]。因此,重金属的生物可给性不仅取决于基质,还取决于元素的化学形态和所用的体外方法。
2.3 基于肠道细胞的生物有效性含量结果
基于胃肠模拟方法得到的人体重金属生物可给性差异大,而被人体肠道实际吸收重金属的剂量(生物有效态)才是诱发人体健康效应的关键因子。因此,使Caco-2细胞分别暴露于不同地区干牛肝菌中生物可给性含量最高的模拟肠液,生物有效性含量结果如表3所示。Cr、Pb和Cd在肠道细胞中只有Cd被肠道细胞吸收积累,生物有效性含量范围在0.60~1.90 μg/mg之间,平均值为1.10 μg/mg。牛肝菌重金属健康暴露风险与重金属有效态含量紧密相连,虽然牛肝菌中重金属总量很高,但Caco-2细胞吸收累积的重金属含量却很低,说明其健康风险较低。方勇等[11]建立体外模拟消化/Caco-2细胞模型来测定大米中Pb的生物有效性,发现经胃肠消化后籼米中Pb的生物可给性均高于粳米,生米经胃、肠消化生物有效性程度均高于蒸煮后的大米。Beri等[53]研究不同品种的甜玉米生长在受污染的Cd土壤中通过将模拟体外消化方法与Caco-2细胞模型相结合来评估,结果表明,甜玉米中Cd生物有效性低,因此不会对人类造成不良的健康影响。Lei Ji等[54]利用体外消化/Caco-2细胞模型评估中国10 种小麦粉中Fe的生物有效性,为植物育种方面能够筛选出铁生物强化小麦品种。这些研究从侧面反映出建立了体外模拟消化/Caco-2细胞模型是测定本研究中重金属生物有效性的一种有效的方法,可为研究重金属的毒性提供一种新思路和手段。
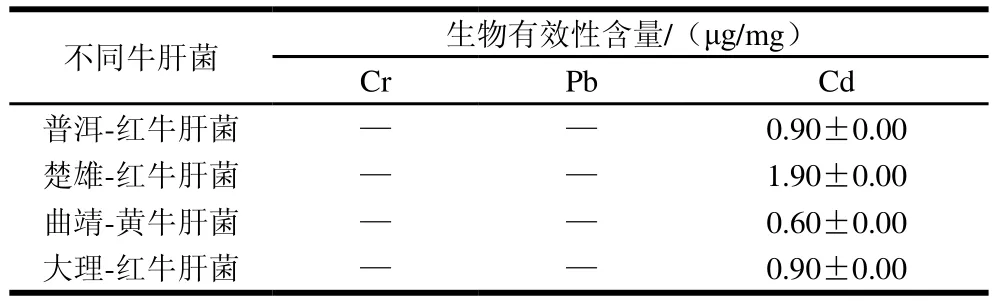
表3 基于Caco-2细胞的Cr、Cd和Pb的生物有效性含量Table 3 Bioavailable concentrations of Cr, Cd and Pb based on Caco-2 cells
2.4 基于目标重金属总含量、生物可给性含量和生物有效性含量的健康风险评估结果对比分析
现有食品健康风险评估方法多基于重金属的总量,但是越来越多的研究表明基于人体生物有效性的健康风险评价可以更准确地评估人体实际暴露剂量,预测健康危害程度。因此本研究根据干牛肝菌中目标重金属含量、生物可给性含量、生物有效性含量,借助EDI评价模型分别进行了分析评估对比,结果如表4所示。成人(7.42)和儿童(6.98)的Cd EDI都大于1,表明对人类健康有潜在的健康风险。以重金属元素Cd的生物可给性数据进行分析,发现生物可给性EDI为0.02~0.04,远小于1,无健康风险;而根据生物有效性含量估算的EDI更低,为0~0.000 2,表明不存在健康风险。基于以上模型评估发现,如果以重金属总含量作为健康风险评估依据,会高估其人体健康风险,而结合体内和细胞方法,基于生物可给性含量和生物有效性含量进行评估,可以更好地研究牛肝菌中重金属的人体健康风险,得出人体真实的有效参数,利用评价公式能更准确、更快速的预测健康风险。
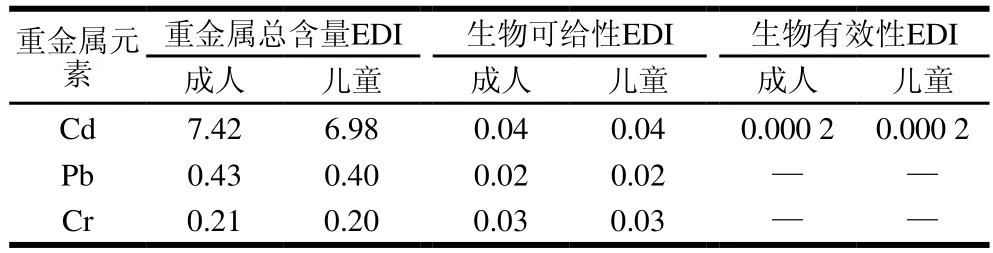
表4 基于重金属总含量、生物可给性含量和生物有效性含量估算干牛肝菌重金属EDITable 4 Estimated daily intake of heavy metals from wild edible dried bolete based on total heavy metals contents, bioaccessible concentrations and bioavailable concentrations mg/(g·d)
2.5 牛肝菌经模拟肠液消化后对Caco-2细胞IL-8基因表达的影响
作为一类可食用真菌,绝大多数牛肝菌非但对身体无害,反而可明显提升机体的免疫能力,改善机体的微循环等,但仍有少数的牛肝菌对身体有明显的毒害作用,中毒早期出现消化道症状,进而突出表现为精神和神经的症状等,消化系统上最常见的反应是肠胃炎等症状[55]。而炎症是免疫系统的一种保护性非特异性反应,可由多种因素触发,在机体防御中起着重要作用,为了验证干牛肝菌中生物有效态重金属是否对肠道构成健康风险,选取了炎症因子IL-8[56]。IL-8是一种重要的炎性细胞趋化因子和活化因子,有研究表明IL-8在肠道黏膜的表达量升高,说明肠炎症状朝着不利的方向发展,从而进一步加重炎症反应,因此IL-8在肠炎发病中起着十分重要的作用[57-59]。基于上文提及的生物有效性评价并没有健康风险,为了更深入探究食用重金属含量高的干牛肝菌在肠道是否会有炎症发生,因此测定IL-8在其中的基因表达量。由图3可知,与模拟肠液-空白组相比,实验中不同牛肝菌经模拟肠液消化后对Caco-2细胞IL-8的表达量均极显著下调(P<0.01),进一步说明牛肝菌经模拟肠液消化后不会刺激Caco-2细胞启动IL-8因子,表明食用重金属含量高的干牛肝菌在肠道消化4 h后没有引起明显的危害效应。
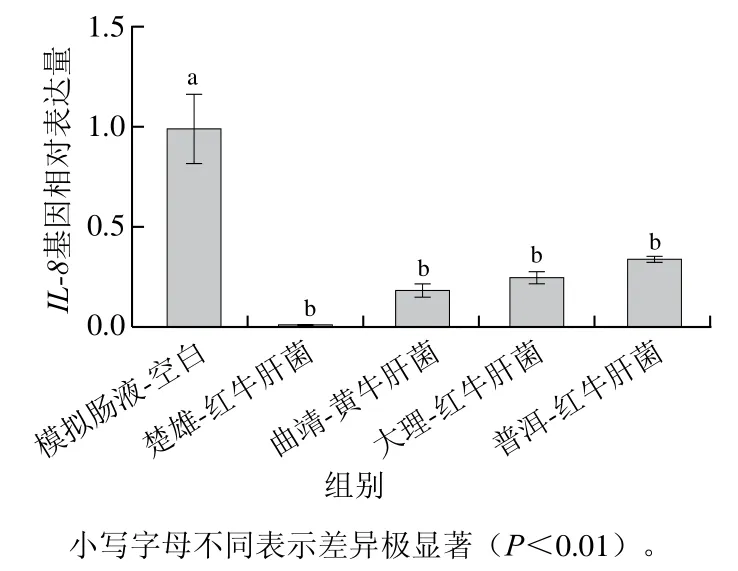
图3 Caco-2细胞IL-8基因相对表达量Fig. 3 Relative gene expression levels of IL-8 in Caco-2 cells
3 结 论
干牛肝菌中Cr和Pb含量在国家标准范围内,但Cd的平均含量约是限量值的20 倍,干牛肝菌对Cd的吸收能力比较强。用SBRC法测定出干牛肝菌中3 种重金属在模拟胃液和模拟肠液中的平均生物可给性分别为12.8%、7.1%,而肠道细胞吸收重金属的能力也较低。本研究应用EDI对干牛肝菌中重金属的总含量进行了人体健康风险评价,Cd的EDI大于1,儿童的相关风险(6.98)与成人(7.42)相当,随后利用干牛肝菌中重金属的生物可给性含量和生物有效性含量来修正EDI公式,发现其EDI小于1,方法上的改进说明使用人体肠道细胞评估其健康风险会更加准确。为进一步验证重金属含量高的牛肝菌粉末可能的健康风险,本研究选取炎症因子IL-8测定其基因表达量是否会引起炎症反应,结果表明食用干牛肝菌可能不存在健康风险,更准确的结果还需进一步研究,但从侧面也反映出SBRC体外胃肠模拟结合人体Caco-2细胞模拟能比较准确评估牛肝菌中重金属对人体的健康风险,可为研究其准确性提供一种新思路和手段。
