金针菇膳食纤维改性、理化性质及抗氧化、降血脂活性
2022-01-06刘学成王文亮弓志青王延圣崔文甲宋莎莎贾凤娟
刘学成,王文亮,弓志青,王延圣,崔文甲,宋莎莎,张 剑,贾凤娟
(山东省农业科学院农产品加工与营养研究所,山东省农产品精深加工技术重点实验室,农业农村部新食品资源加工重点实验室,山东 济南 250100)
膳食纤维(dietary fiber,DF)被称为“第七大营养素”,是天然存在的或者合成的碳水化合物的聚合物,主要存在于植物细胞壁中,不能被人体消化吸收,也不能为人体提供能量,但其对于人体膳食平衡起到至关重要的作用。按照是否溶于水可将DF分为可溶性膳食纤维(soluble dietary fiber,SDF)和不可溶性膳食纤维(insoluble dietary fiber,IDF)[1]。SDF能够吸附糖类和脂类物质,降低血糖、血脂、胆固醇等指标水平,降低心脑血管病、糖尿病和某些癌症的发病风险[2-4]。IDF主要由纤维素和木质素组成,能够增加餐后饱腹感,其吸水性强并能促进胃肠蠕动,具有预防便秘和一定的减肥功效[5]。金针菇(Flammulina velutipes)学名毛柄金钱菌,俗称冬菇,野生金针菇一般生长于腐树干上,呈金光色,是一种食药两用的食用菌[6],金针菇中的DF含量丰富,同时富含SDF和IDF,具有一定的抗氧化和抗衰老功效,因此研究金针菇DF对产品开发利用具有非常重要的参考价值[7]。
SDF具有更强的生理活性,因此SDF含量越高,DF品质越好,高品质DF中的SDF相对含量应在10%以上,否则只能作为食品充填剂[8]。天然植物DF中的SDF含量普遍较低,因此对DF进行改性,将部分IDF通过一定的方法转变为SDF,以提高SDF的比例是十分必要的。本课题组通过前期预实验对金针菇DF进行提取,发现金针菇DF得率为38.6%,其中SDF占总DF的8.2%,具有通过改性提高SDF含量的空间。目前DF的改性方法主要包括物理改性、化学改性、生物改性等[9-11]。此前对金针菇DF研究主要集中在提取阶段,而对其改性研究和生理活性应用研究较少,故本实验以提取的金针菇DF为原料,对其进行改性处理,分别采用纤维素酶法和高温蒸煮法处理金针菇DF,在单因素试验基础上得到最佳改性工艺优化参数。此外,对两种改性方法处理的金针菇DF进行理化性质测定,并通过扫描电子显微镜观察和傅里叶变换红外光谱分析,选出较优的改性方法。最后,建立高脂肥胖小鼠模型,通过饲喂改性后的金针菇DF饲料,探究改性DF对小鼠血脂和血清抗氧化指标的影响。
1 材料与方法
1.1 动物、材料与试剂
雄性昆明小鼠(3~4 周龄)购自武汉塞维尔公司(生产许可证号:SYXK(鄂)2017-0013)。
小鼠1022基础饲料、小鼠H10060高脂饲料 北京华阜康公司。
纤维素酶(比酶活力50 000 U/g) 上海源叶生物科技有限公司;压榨玉米油 山东鲁花集团有限公司;盐酸(分析纯) 烟台莱阳市精细化工厂;氯化钠(分析纯) 天津市申泰化学试剂有限公司;氢氧化钠(分析纯) 天津市科密欧化学试剂有限公司;胆固醇(分析纯)、邻苯二甲醛(分析纯) 国药集团化学试剂有限公司;95%乙醇(分析纯) 天津富宇精细化工有限公司;丙酮(分析纯) 烟台远东精细化工有限公司;无水葡萄糖 山东西王药业有限公司;甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,TC)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
LDZ-50KB立式压力蒸汽灭菌锅 上海申安医疗器械厂;GZX-9240MBE电热鼓风干燥箱、SHZ-A恒温水浴振荡器 上海博迅实业有限公司;SCIENTZ-10N冷冻干燥机、SB25-12DTD超声波清洗机、JY92-IIn超声细胞粉碎机 宁波新芝生物科技股份有限公司;电子天平 美国OHAUS公司;ZN-20L小型粉碎机 北京兴时利和科技发展有限公司;CR22DIII高速冷冻离心机 日本日立公司;Epoch酶标检测仪 美国BioTeK公司;Chemray 240全自动生化分析仪 深圳雷杜生命科技有限公司;Nexus傅里叶变换红外光谱仪 美国Thermo Nicolet公司;MSP-2S离子溅射仪 美国IXRF公司;SU8010扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 金针菇DF粉制备工艺流程
金针菇烘干粉碎→液料比30∶1加水溶解→利用0.1 mol/L的NaOH和HCl溶液调节pH值为7→105 W超声处理20 min→加入质量分数1.5%复合蛋白酶(酶活力10 000 U/g)→50 ℃恒温水浴振荡酶解→95 ℃高温灭酶→加入质量分数2.0%α-淀粉酶(酶活力5 000 U/g)→55 ℃恒温水浴振荡酶解2 h→95 ℃高温灭酶→加入4 倍体积95%(体积分数)乙醇溶液醇沉2 h→沉淀用丙酮洗涤→抽滤冷冻干燥→金针菇DF粉
1.3.2 改性金针菇膳食纤维制备
1.3.2.1 纤维素酶法改性
取干燥的DF粉2.0 g于锥形瓶中,按照一定的液料比加水混匀,加入一定量的纤维素酶,55 ℃水浴振荡一段时间,95 ℃高温灭酶5 min,冷却后5 000 r/min离心15 min,保留上清液,加入4 倍体积的95%(体积分数)乙醇溶液醇沉2 h,抽滤乙醇保留白色絮状物,并用丙酮洗涤两次,抽滤除去乙醇,冷冻干燥所得SDF产品即为纤维素酶改性金针菇DF[12]。
1.3.2.2 高温蒸煮法改性
取干燥的DF粉2.0 g于锥形瓶中,按照一定的液料比加水混匀,放入蒸煮灭菌锅中在一定温度下处理一段时间,冷却后5 000 r/min离心15 min,保留上清液,加入4 倍体积的95%(体积分数)乙醇溶液醇沉,抽滤乙醇保留白色絮状物,并用丙酮洗涤两次,抽滤除去丙酮,冷冻干燥所得SDF产品即为高温蒸煮改性金针菇DF[13-15]。
1.3.3 单因素试验
1.3.3.1 纤维素酶法改性单因素设计
准确称取2.0 g样品,分别探究液料比(25∶1、30∶1、35∶1、40∶1、45∶1)、纤维素酶用量(0.5%、1.0%、1.5%、2.0%、2.5%,以体系总质量计)、纤维素酶酶解时间(0.5、1.0、1.5、2.0、2.5 h)对SDF得率的影响。SDF得率为改性后样品质量和样品初始质量的百分比。
1.3.3.2 高温蒸煮法改性单因素设计
准确称取2.0 g样品,分别探究液料比(25∶1、30∶1、35∶1、40∶1、45∶1)、蒸煮温度(105、110、115、120、125 ℃)、蒸煮时间(20、30、40、50、60 min)对SDF得率的影响。
1.3.4 正交优化试验设计
采用L9(34)正交试验优化DF改性工艺条件,以SDF得率为评价指标,分别探究纤维素酶和高温蒸煮两种方法对DF改性效果的影响,确定纤维素酶改性和高温蒸煮改性的最佳工艺参数,试验因素水平设计分别见表1和表2。
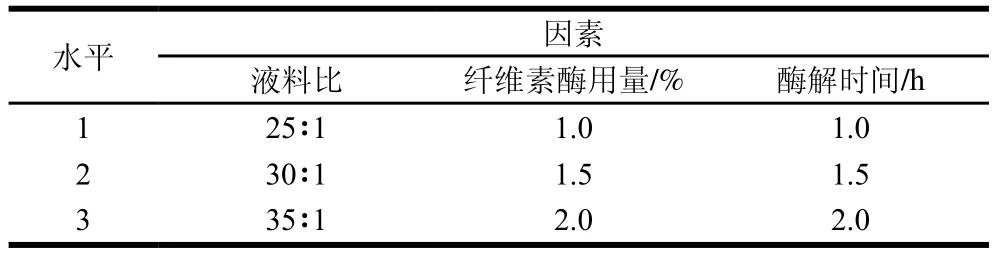
表1 纤维素酶改性DF正交试验因素水平Table 1 Code and level of independent variables used for orthogonal array design for optimization of DF modification by cellulase

表2 高温蒸煮改性DF正交试验因素水平Table 2 Code and level of independent variables used for orthogonal array design for optimization of DF modification by high-temperature cooking
1.3.5 金针菇膳食纤维改性前后理化性质测定
1.3.5.1 阳离子交换力测定
取1.0 g改性前后干燥DF粉,浸泡在0.1 mol/L的盐酸溶液中24 h,之后离心除去盐酸(3 000 r/min、10 min),用蒸馏水多次洗涤沉淀,保证溶液pH>4,用质量分数10% AgNO3溶液滴定除去溶液中Cl-,过滤并将滤液干燥,将干燥样品悬浮于50 mL NaCl溶液(0.3 mol/L)中,再连续搅拌24 h,离心(5 000 r/min、10 min),上清液用0.01 mol/L NaOH溶液滴定,直至pH值基本不再变化,在滴定过程中,通过比较相同pH值下所消耗的NaOH体积,NaOH体积越小,则阳离子交换能力越强[16],通过绘制体系pH值-NaOH消耗体积关系图,能够观察到不同样品阳离子交换能力变化的趋势。
1.3.5.2 葡萄糖吸收能力测定
将1.0 g改性前后干燥DF粉(m/g),至100 mL浓度为100 mmol/L的葡萄糖溶液中(原始溶液葡萄糖物质的量记为n1/mmol),37 ℃水浴振荡6 h,5 000 r/min离心15 min,取上清液,采用二硝基水杨酸比色法在540 nm波长处测定上清液中葡萄糖的吸光度并计算其物质的量(n2/mmol),按式(1)计算葡萄糖吸收能力[17]。
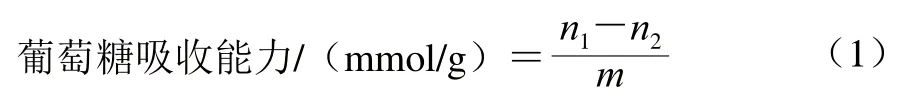
1.3.5.3 胆固醇吸附力测定
取市售鲜鸡蛋蛋黄,加入9 倍质量的蒸馏水搅打成乳液匀浆,利用邻苯二甲醛法测定乳液中胆固醇质量,记为m1/g。准确称量1.0 g改性前后干燥DF样品,记为m/g,按液料比25∶1加入上述稀释后蛋黄液,搅打均匀,室温振荡摇匀4 h,5 000 r/min离心15 min,取上清液,测定上清液中胆固醇质量,记为m2/g,胆固醇吸附力按公式(2)计算[18]。
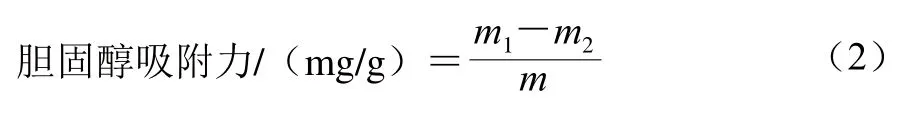
1.3.6 微观结构观察
1.3.6.1 扫描电子显微镜观察微观结构
将金针菇DF粉过60 目筛,分别取少量改性前后干燥DF粉,将样品紧贴于导电碳膜双面胶上,放入离子溅射仪样品台上喷金30 s,使用扫描电子显微镜(3.0 kV、3 000 倍)观察并收集图像[19]。
1.3.6.2 傅里叶变换红外光谱测定
将DF粉过60 目筛,取改性前后干燥DF粉1 mg,加入100 mg KBr研磨成均质粉末,压片制成透明薄片,并用空白KBr作为背景。扫描次数为32 次,分辨率为4 cm-1,扫描范围为500~4 000 cm-1[20]。
1.3.7 动物实验
1.3.7.1 小鼠高脂肥胖模型的建立
50 只雄性昆明小鼠在室温20~25 ℃、相对湿度40%~50%下适应性喂养一周,期间自由饮食饮水。随后将50 只小鼠随机分成2 组,其中空白对照组8 只,高脂肥胖模型组42 只,空白对照组动物饲喂基础饲料,高脂肥胖模型组小鼠饲喂高脂饲料,期间每周测量一次体质量,造模时间为4 周,分别取高脂肥胖模型组和空白对照组的小鼠进行尾动脉取血并检测血脂四项指标,分别为TG、TC、HDL-C和LDL-C浓度,以高脂肥胖模型组小鼠对比空白对照组小鼠在平均体质量和血脂指标水平上具有显著性差异视为造模成功。
1.3.7.2 小鼠DF干预实验分组
将造模成功的高脂肥胖模型小鼠随机分配为5 组,分别为模型组(基础饲料)、阳性对照组(基础饲料中添加5%燕麦DF)、DF低剂量组(基础饲料中添加2.5%高温蒸煮改性金针菇DF)、DF中剂量组(基础饲料中添加5%高温蒸煮改性金针菇DF)、DF高剂量组(基础饲料中添加10%高温蒸煮改性金针菇DF)。
分组完成之后,空白对照组继续饲喂基础饲料,高脂模型组饲喂基础饲料,其他4 组按照组别饲喂相应不同饲料,继续饲喂4 周,每周测一次体质量,饲喂结束之后,小鼠禁食12 h,颈椎脱臼处死小鼠,取血液于-20 ℃保存[21],之后进行指标检测。
1.3.7.3 主要指标检测
血脂四项指标:TC、TG、LDL-C和HDL-C浓度采用相应试剂盒进行检测。
血清抗氧化指标:SOD、GSH-Px活力采用相应试剂盒进行检测。
1.4 数据处理与分析
采用Excel软件进行数据统计处理,采用Origin 8.0软件作图,显著性差异采用SPSS 24.0软件中单因素方差分析检验法进行分析。
2 结果与分析
2.1 纤维素酶改性和高温蒸煮改性对金针菇SDF得率影响的单因素试验结果
2.1.1 纤维素酶改性对金针菇SDF得率的影响
以液料比30∶1、纤维素酶用量1.5%、酶解时间2.0 h为固定值,保持其中两个因素条件不变的情况下,分别探究第3个因素对金针菇SDF得率的影响,结果如图1所示。
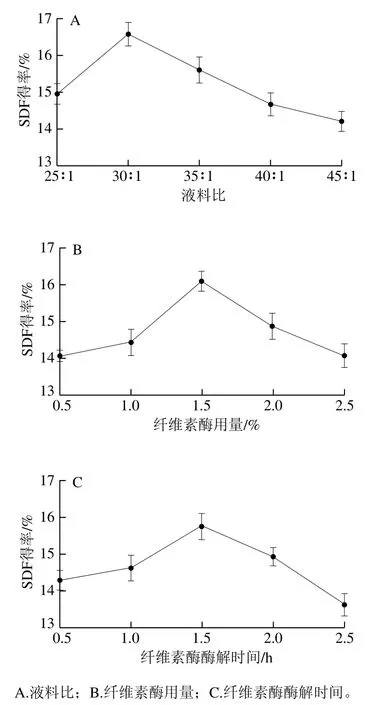
图1 纤维素酶改性对金针菇SDF得率的影响Fig. 1 Effect of cellulase modification on the yield of SDF
由图1可以看出,随着液料比、纤维素酶用量的提高与酶解时间的延长,SDF得率均呈现先升后降的趋势,液料比在30∶1时,SDF得率最高(16.6%);综合考虑选取液料比25∶1、30∶1、35∶1作为正交试验3个水平。当纤维素酶用量为1.5%时,SDF得率最高(16.1%);纤维素酶量过量时,部分SDF也会被分解,综合考虑选取纤维素酶用量1.0%、1.5%、2.0%作为正交试验3个水平。纤维素酶酶解时间为1.5 h时,SDF得率最高(15.8%);当酶解时间继续延长时,会造成纤维素酶的过度酶解,导致SDF得率降低,综合考虑选取酶解时间1.0、1.5、2.0 h作为正交试验3个水平。
2.1.2 高温蒸煮改性对金针菇SDF得率的影响
以液料比30∶1、蒸煮温度120 ℃、蒸煮时间40 min为固定值,保持其中两个因素条件不变的情况下,分别探究第3个因素对金针菇SDF得率的影响,结果如图2所示。
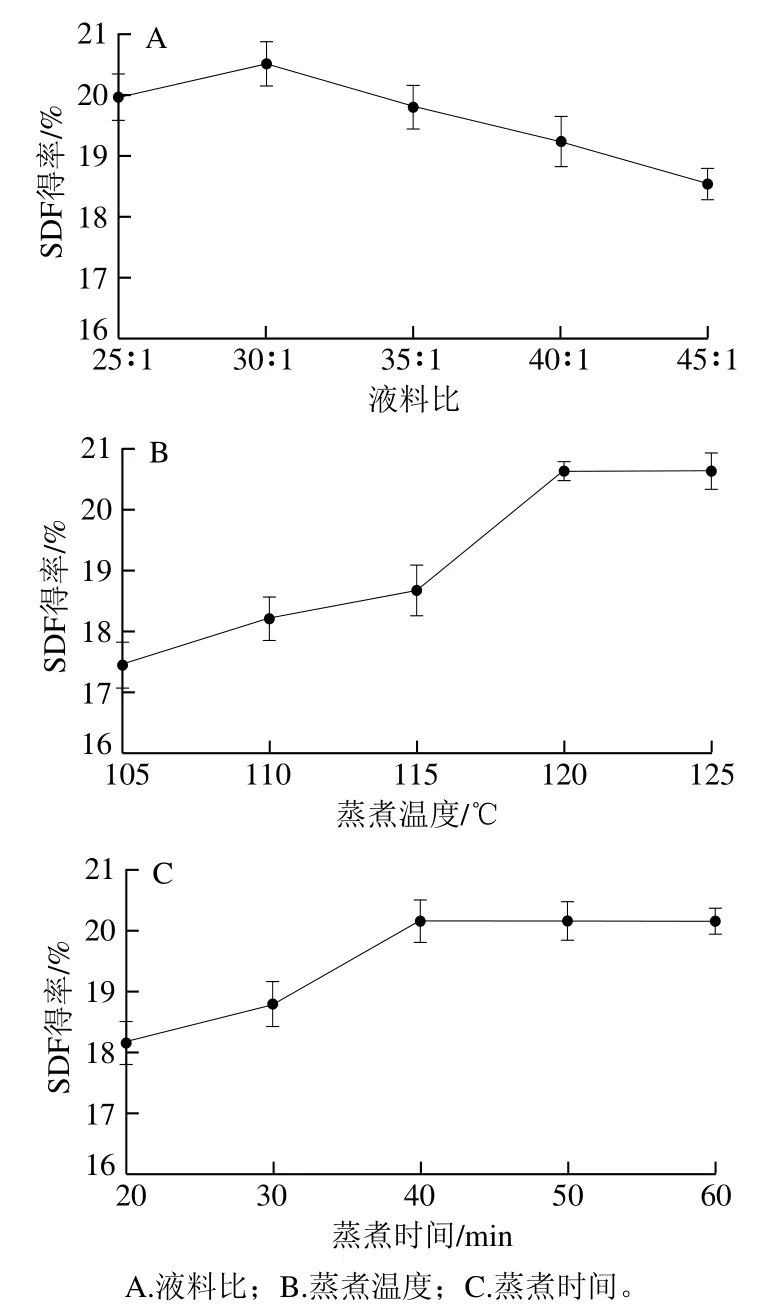
图2 高温蒸煮改性对金针菇SDF得率的影响Fig. 2 Effect of high-temperature cooking modification on the yield of SDF
由图2可以看出,当液料比为30∶1时,SDF得率最高(20.5%)。综合考虑选取液料比25∶1、30∶1、35∶1作为正交试验3个水平。随着蒸煮温度的升高,SDF得率呈现先增加后趋于稳定的趋势,当蒸煮温度为120 ℃时,SDF得率最高(20.6%),高温会破坏DF分子内氢键,部分结晶区遭到破坏促使部分IDF转变为SDF[22],当蒸煮温度高于120 ℃时,SDF得率趋于稳定。综合考虑选取蒸煮温度115、120、125 ℃作为正交试验3个水平。随着蒸煮时间的延长,SDF得率呈现先增加后趋于稳定的趋势,当蒸煮时间为40 min时,SDF得率最高(20.2%)。当蒸煮时间不足40 min时,随着蒸煮时间的延长,部分DF分子质量和聚合度降低,促使部分IDF转变为小分子的SDF[23],当蒸煮时间超过40 min时,SDF得率保持不变。综合考虑选取蒸煮时间30、40、50 min作为正交试验3个水平。
据当地人介绍,江底铁索桥是东川铜业鼎盛时期的产物,古名永安桥,屡毁屡修。钢梁桥1944年开工建设,桥头引道要经过仅4米宽的江底街道,行车艰难。1978年,为改善当地交通条件,江底双曲拱桥正式开工建设。从铁索桥到钢梁桥再到双曲拱桥,3座不同时期建设的桥梁下游往上依次跨越牛栏江,常被摄入同一照片里,“江底三桥”成为人们津津乐道的话题。
2.2 金针菇DF改性工艺参数优化
表3为纤维素酶改性正交试验设计与结果,表4为高温蒸煮改性正交试验设计与结果。根据表3中的极差(R)分析得出各因素对金针菇改性SDF得率影响的主次顺序为B>C>A,即纤维素酶用量>酶解时间>液料比。最佳改性工艺组合是A3B2C3,即液料比35∶1、纤维素酶用量1.5%、酶解时间2.0 h,按照此方案进行验证试验,得到SDF得率为16.2%。从表4中的极差(R)分析得出各因素对金针菇改性SDF得率影响的主次顺序为B>C>A,即蒸煮温度>蒸煮时间>液料比。最佳改性工艺组合是A2B3C3,即液料比30∶1、蒸煮温度125 ℃、蒸煮时间50 min,按照此方案进行验证实验,SDF得率为20.4%。由此可以看出高温蒸煮改性SDF得率高于纤维素酶改性。
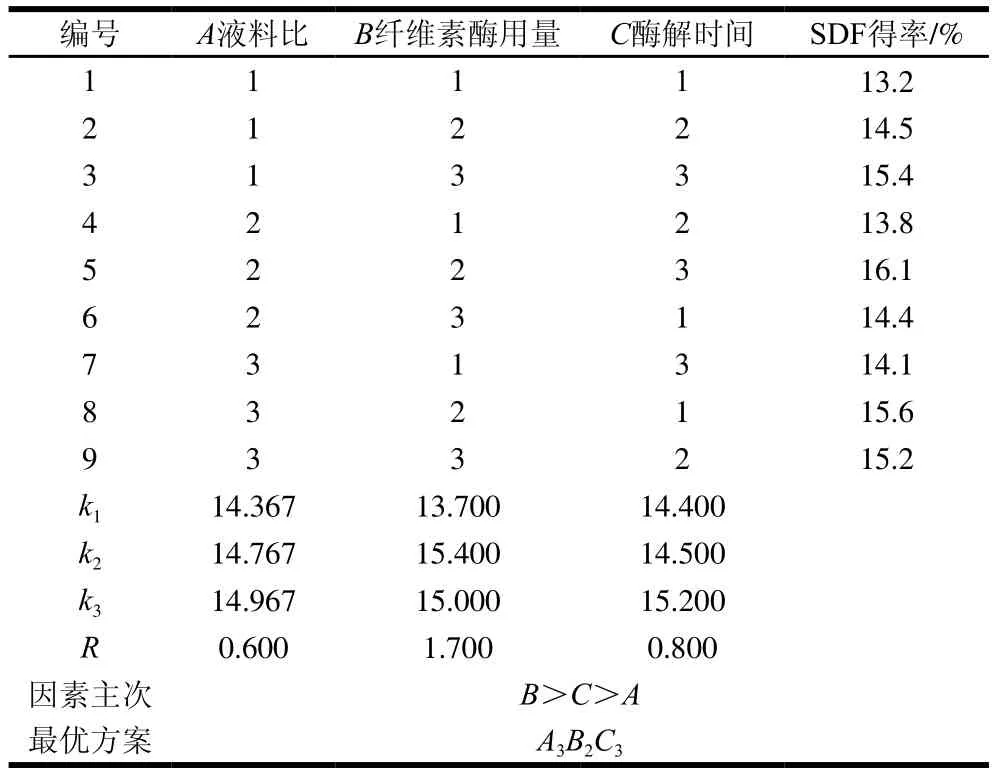
表3 纤维素酶改性金针菇DF正交试验结果Table 3 Orthogonal array design with experimental values of SDF yield by cellulase modification
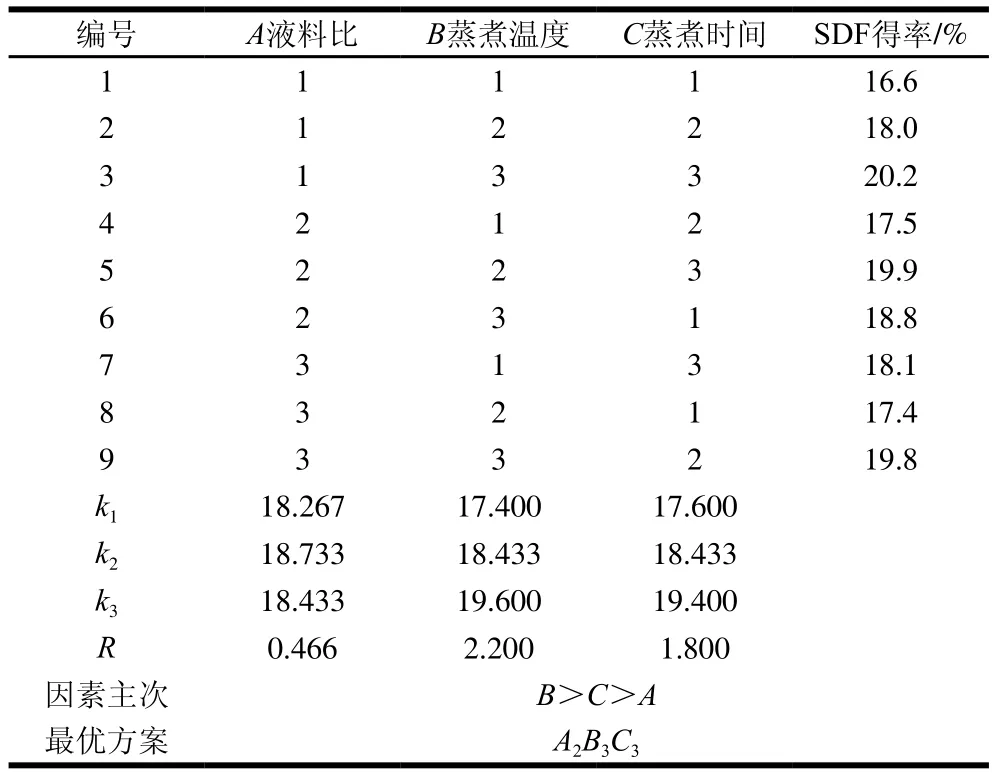
表4 高温蒸煮改性金针菇DF正交试验结果Table 4 Orthogonal array design with experimental values of SDF yield by high-temperature cooking modification
2.3 金针菇膳食纤维改性前后理化性质
DF分子结构中含有许多羧基和羟基的侧链基团,可以与阳离子进行可逆交换[24]。从图3可以看出,NaOH溶液消耗体积为0~1 mL时,几种方法处理的溶液pH值上升都较慢,NaOH溶液消耗体积为1~3 mL时,几种方法处理的溶液pH值上升较快,其中高温蒸煮处理溶液pH值上升最快,pH值为7时NaOH溶液消耗体积为1.6 mL,纤维素酶处理溶液在pH值为7时NaOH溶液消耗体积为1.7 mL,未改性处理的溶液pH值为7时NaOH溶液消耗体积为2 mL,当NaOH溶液消耗体积超过3 mL时,几种溶液的pH值缓慢上升直至接近11。在相同pH值条件下,NaOH溶液消耗体积越小则阳离子交换能力越强。由此可以看出阳离子交换能力依次为高温蒸煮改性组>纤维素酶改性组>未改性组。
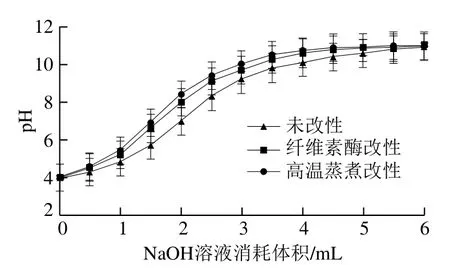
图3 改性处理前后金针菇DF阳离子交换能力比较Fig. 3 Comparison of cation exchange power of Flammulina velutipes DF before and after modification
从图4中可以看出,纤维素酶改性法和高温蒸煮改性法都能明显提高DF的葡萄糖吸收能力,葡萄糖吸收能力从10.2 mmol/g分别提高到16.8 mmol/g和18.3 mmol/g,葡萄糖吸收能力由大到小依次为高温蒸煮改性组>纤维素酶改性组>未改性组。葡萄糖吸收能力主要受SDF含量的影响,改性使金针菇SDF含量提高,DF结构表面积增大,表面变得疏松多孔,对葡萄糖吸收能力产生积极作用,产生良好的水合作用,这与Ma Mengmei等[25]的研究结果相一致。
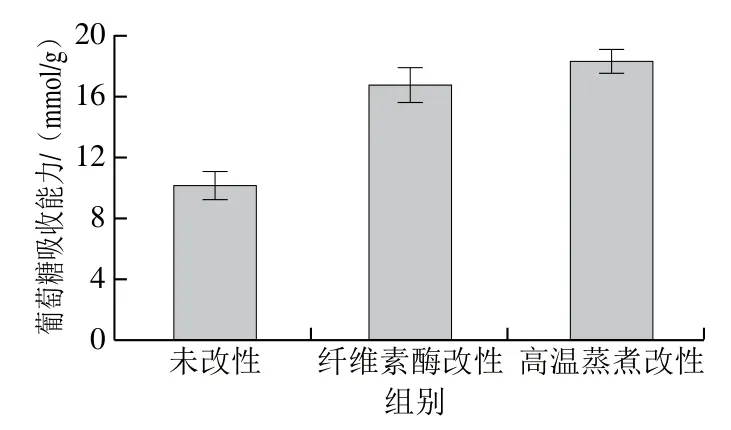
图4 改性前后金针菇DF葡萄糖吸收能力比较Fig. 4 Comparison of glucose absorption capacity of Flammulina velutipes DF before and after modification
胆固醇过高是诱发心脑血管疾病的主要病因之一,果胶和β-葡聚糖等SDF可以在胃肠中形成凝胶态,增加胃肠中食物黏稠度,促进对食物中胆固醇的吸收从而降低肠道对胆固醇的吸收[26]。如图5所示,纤维素酶改性法和高温蒸煮改性法都能明显提高胆固醇吸附力,胆固醇吸附力从5.1 mg/g分别上升到9.8 mg/g和10.1 mg/g。胆固醇吸附力由大到小依次为纤维素酶改性组>高温蒸煮改性组>未改性组。
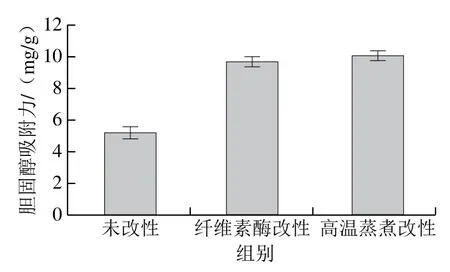
图5 改性前后金针菇DF胆固醇吸附力比较Fig. 5 Comparison of cholesterol adsorption capacity of Flammulina velutipes DF before and after modification
2.4 金针菇DF改性前后的微观结构
如图6所示,3 种方法处理的DF结构差别较大。未改性处理的DF结构较为紧密;经过纤维素酶改性处理的DF结构中孔状结构较多,可能是DF主要成分为纤维素,纤维素酶分解一部分纤维素转变为SDF所致;而高温蒸煮改性处理的DF结构表面疏松多孔,且表面多呈现丝状结构,原因可能是高温迫使DF结构发生改变,使得相当一部分IDF转换成SDF溶解在水中[27]。由此可以看出,两种改性处理方法均可以使金针菇DF具有更大的表面积和多孔结构,且高温蒸煮改性的效果比纤维素酶改性效果更为显著。
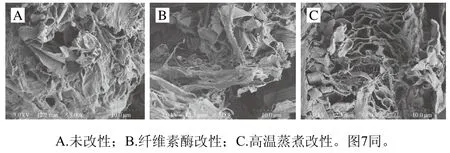
图6 改性前后金针菇DF扫描电子显微镜图Fig. 6 SEM photographs of Flammulina velutipes DF before and after modification
2.5 金针菇DF改性前后傅里叶变换红外光谱分析结果
如图7所示,3 种方法处理的DF在吸收峰上没有明显的变化,在3 400 cm-1附近出现一个较宽的吸收峰,是典型的纤维素和半纤维素O—H伸缩振动带,说明存在分子间的氢键作用力,在2 900 cm-1附近出现一个较弱的吸收峰,主要由糖类亚甲基上的C—H基团伸缩振动引起,在1 630 cm-1处出现木质素中芳香苯基团产生的吸收峰,在1 370 cm-1处出现糖醛酸的C=O特征吸收峰,在1 040 cm-1处出现一个较强的吸收峰,主要由纤维素和半纤维素中醚键C—O—C伸缩振动引起。观察到高温蒸煮改性在各波数吸收峰的透光率较高,说明高温蒸煮可以破坏一定的纤维素和半纤维素结构,产生具有可溶性的小分子物质[28],符合预期的改性效果。
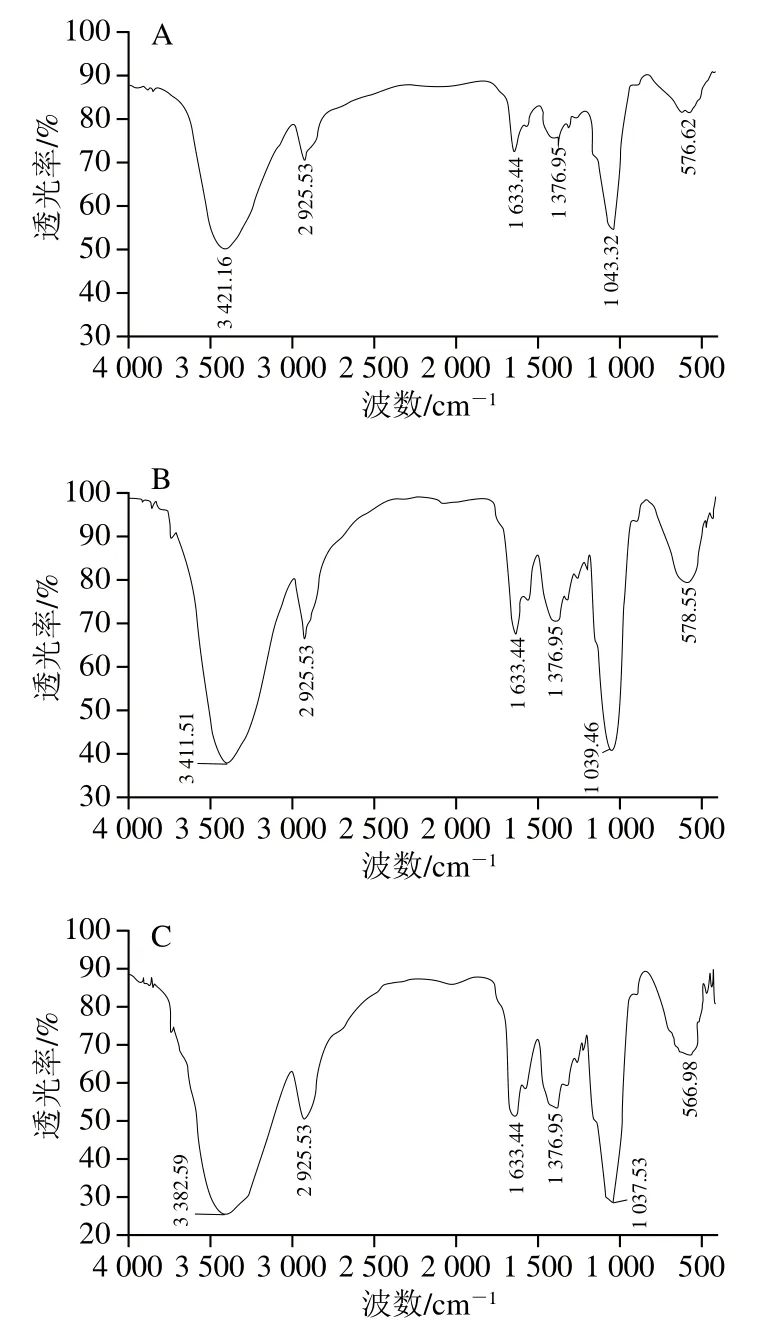
图7 改性前后金针菇DF傅里叶变换红外光谱图Fig. 7 Fourier transform infrared spectra of Flammulina velutipes DF before and after modification
2.6 小鼠高脂肥胖模型造模结果
由体内脂代谢异常造成血浆中多种脂质指标高于正常水平的病症称为高血脂症。研究表明,高脂饮食能够增加血浆中TG、TC、LDL-C水平,降低HDL-C水平[29-30]。由表5可知,高脂肥胖模型组与空白对照组体质量和TG、TC、HDL-C、LDL-C水平均有极显著差异,说明小鼠造模成功。
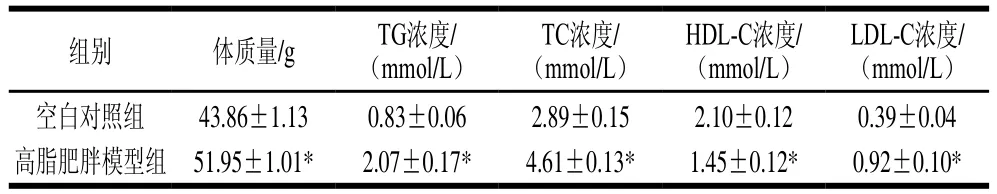
表5 高脂肥胖模型造模实验结果Table 5 Body mass and blood lipids in control and high fat diet-induced obese mice
2.7 金针菇膳食纤维对高脂肥胖小鼠各项生理指标的影响
2.7.1 膳食纤维对高脂肥胖模型小鼠体质量的影响
从表6可以看出,实验组与模型组初始体质量无明显差异,随着时间的推移,各实验组与模型组开始出现差异性,从第2周开始,DF中剂量组和高剂量组小鼠体质量显著低于模型组体质量(P<0.05),从第3周开始,阳性对照组、DF中剂量组和DF高剂量组体质量极显著低于模型组小鼠(P<0.01),第4周DF低剂量组小鼠体质量显著低于模型组小鼠(P<0.05)。上述结果表明DF对小鼠肥胖具有一定的抑制作用,且DF中剂量组和高剂量组对小鼠肥胖具有较好抑制作用,可能是由于DF对小鼠肠道内油脂具有一定的吸附作用,能够减少肠道对油脂吸收,使油脂随粪便排出体外。
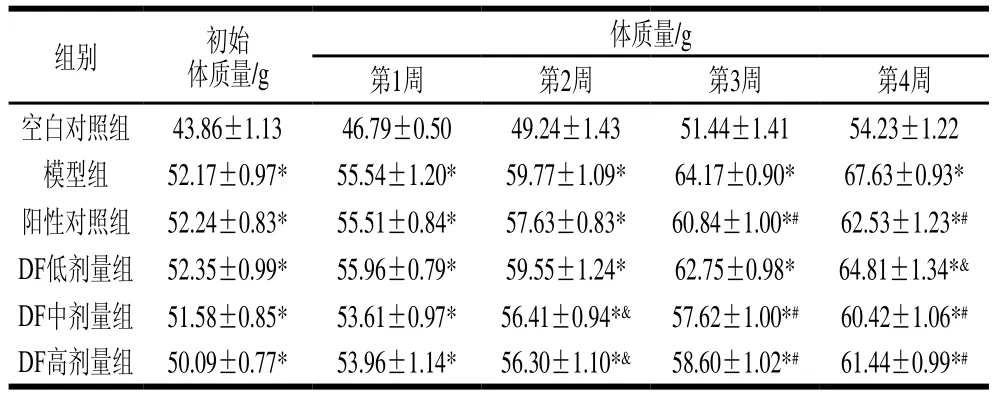
表6 金针菇DF对高脂肥胖模型小鼠体质量的影响Table 6 Effect of Flammulina velutipes DF on body mass of high fat diet-induced obese mice
2.7.2 膳食纤维对高脂肥胖模型小鼠的血脂水平影响
由表7可知,模型组中TG、TC和LDL-C浓度显著高于空白对照组,而HDL-C浓度显著低于空白对照组,说明食用高脂饲料导致模型组小鼠血脂水平异常。实验组TG浓度均与模型组存在极显著差异(P<0.01),DF中剂量组和高剂量组与空白对照组无显著差异,说明中剂量组和高剂量金针菇DF可有效改善高血液TG水平;模型组、阳性对照组和DF低剂量组与空白对照组TC浓度存在极显著差异(P<0.01),而DF中剂量组和高剂量组与空白对照组差异不显著,且与模型组存在极显著差异(P<0.01),DF中剂量组和高剂量组比阳性对照组更能有效改善血液TC水平,这与2.3节胆固醇吸附力结果吻合;各实验组与模型组HDL-C水平均存在显著差异,DF高剂量组和阳性对照组与空白对照组无显著性差异,DF高剂量组和阳性对照组能够极显著提高血液中HDL-C水平(P<0.01)。中剂量组和高剂量组LDL-C浓度与空白对照组无显著性差异,与模型组相比,中剂量组和高剂量组均能极显著降低血液LDL-C水平(P<0.01)。
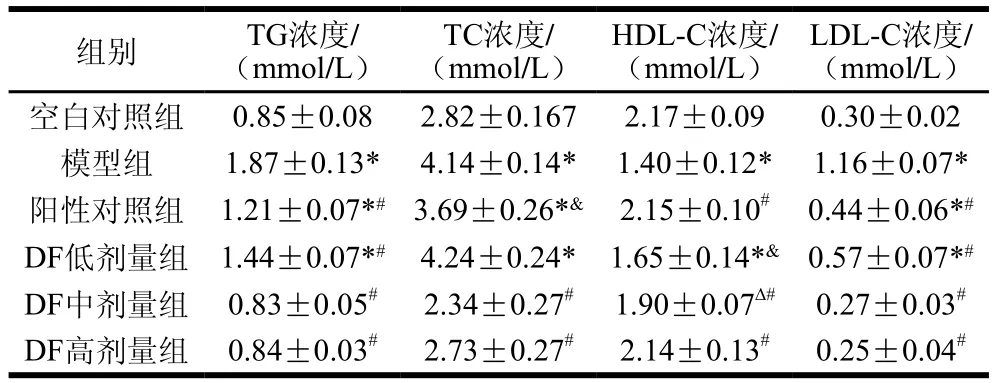
表7 金针菇DF对高脂肥胖模型小鼠血脂水平的影响Table 7 Effect of Flammulina velutipes DF on serum lipid parameters of high fat diet-induced obese mice
2.7.3 膳食纤维对高脂肥胖模型小鼠血清抗氧化指标的影响
SOD、GSH-Px活力为血清抗氧化能力评价指标。如表8所示,模型组与DF低剂量组血清SOD活力极显著低于空白对照组(P<0.01),与模型组相比,阳性对照组、DF中剂量组和DF高剂量组能极显著提高血清中SOD活力(P<0.01)。与空白对照组相比,模型组和DF低剂量组血清GSH-Px活力极显著降低(P<0.01),阳性对照组血清GSH-Px活力极显著升高(P<0.01);与模型组相比,其余组别GSH-Px活力极显著升高(P<0.01)。
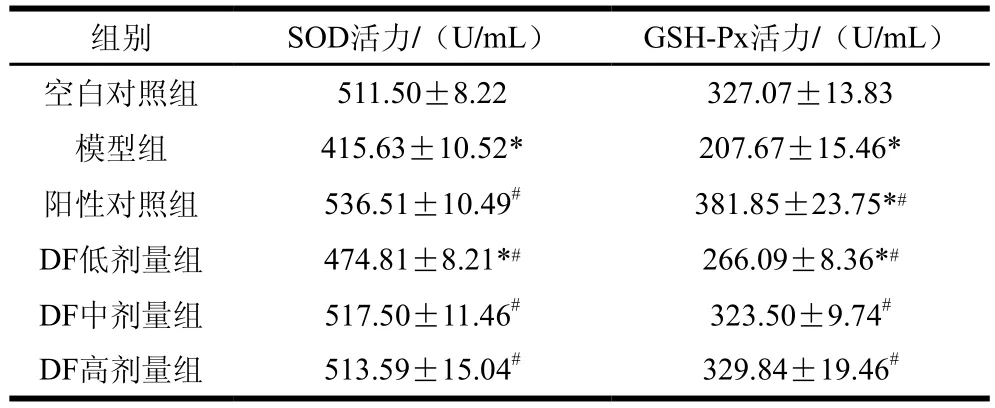
表8 金针菇DF对高脂肥胖模型小鼠血清抗氧化指标的影响Table 8 Effect of Flammulina velutipes DF on serum antioxidant indices in high fat diet-induced obese mice
3 结 论
本实验采用纤维素酶法和高温蒸煮法对DF进行改性,在单因素试验基础上得到改性最佳工艺优化参数,纤维素酶法按照最佳优化水平组合验证,测得SDF得率为16.2%;高温蒸煮法按照最佳优化水平组合验证,测得SDF得率为20.4%,表明高温蒸煮法获得的SDF得率较高。将两种处理方法得到的DF与未改性改性的DF进行理化性质对比,发现高温蒸煮法改性DF在阳离子交换力、胆固醇吸附力和葡萄糖吸收能力均优于纤维素酶法改性DF。此外,扫描电显微镜镜观察和傅里叶变换红外光谱分析结果表明,高温蒸煮改性法所得SDF微观结构更加疏松多孔,透光率更高,与理化性质分析结果一致。最后建立小鼠高脂肥胖模型,通过饲喂3 种含不同剂量的DF饲料,探究金针菇DF对高脂肥胖模型小鼠生理指标的影响,结果表明金针菇DF对高脂肥胖模型小鼠的体质量、血脂以及血清抗氧化等各项指标均有显著的改善效果。
