实时荧光跨越式滚环等温扩增结合PMA检测虾产品中的活副溶血性弧菌
2022-01-06董晶,徐慧,郭威,卢鑫,张伟,,3,
董 晶,徐 慧,郭 威,卢 鑫,张 伟,,3,
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北农业大学理工学院,河北 沧州 061100;3.河北农业大学生命科学学院,河北 保定 071000)
副溶血性弧菌(Vibrio parahemolyticus)作为一种重要的食源性致病菌[1-4],主要存在于虾、蟹、牡蛎、蛤、扇贝及海鱼等海鲜类产品中[5]。食用未完全煮熟的海鲜或被副溶血性弧菌污染的食物可导致腹泻、呕吐、恶心、低烧等症状[6-8]。低温处理在一定程度上可以抑制细菌的生长与繁殖[9],但大部分细菌在低温状态下仍会保持活性。因此,副溶血性弧菌食物中毒的暴发多与食用海鲜类食品相关。
传统培养方法(即GB 4789.7—2013《食品微生物学检验 副溶血性弧菌检验》)公认度高、稳定性好,但检测周期较长,耗时费力[10],且无法检测出活的但不可培养状态的副溶血性弧菌[11]。随着分子生物学的不断发展,核酸检测技术成为近年来研究热点之一,主要包括聚合酶链式反应(polymerase chain reaction,PCR)[12-13]、环介导等温扩增技术(loop mediated isothermal amplification,LAMP)[14-17]、滚环等温扩增技术(rolling circle amplification,RCA)[18-20]等,PCR和实时PCR(real-time PCR)检测技术与传统方法和免疫学方法相比,虽然有许多优点,但是其相对于等温扩增技术来说扩增效率较低,灵敏度亦较低。LAMP和RCA技术扩增效率及检测灵敏度高,但LAMP反应需4~6 条引物,引物间易相互反应,发生非特异扩增,且无法通过测序验证扩增产物的正确性。RCA技术扩增线性DNA时需要锁式探针和连接酶,且需对探针进行环化,操作过程复杂,耗时长约4 h。
本研究团队开发了一种新型核酸等温扩增技术即跨越式滚环等温扩增技术(saltatory rolling circle amplification,SRCA)[21-23],原理如图1所示。对于线性DNA的扩增,在60~65 ℃条件下,下引物(reverse primer,RVP)与模板链上的结合位点结合,在BstDNA聚合酶的作用下,沿模板链合成单链DNA(singlestranded DNA,ssDNA)(步骤①),随后上引物(forward primer,FWP)与新合成的ssDNA上的互补序列结合(步骤②),在BstDNA聚合酶的链置换活性和聚合活性下,沿新合成的ssDNA边合成边置换,最终产生目的序列片段(步骤③)。以目的序列的一条链为例,由于ssDNA本身具有一定的空间二级结构,靶序列的结构近似为非闭合环状,FWP与之结合(步骤④),并沿着靶序列扩增(步骤⑤)。在BstDNA聚合酶作用下,通过添加若干个碱基合成ssDNA,从而跨过靶序列两端的“缺口”(步骤⑥)。继而将先前合成的互补链置换下来,被置换下来的单链就像“卷尺”一样不断被拉长(步骤⑦)。同时,暴露出RVP结合位点,RVP与之结合并延伸(步骤⑧),并将先前合成的ssDNA置换下来(步骤⑨),被置换下来的ssDNA暴露出FWP结合位点,FWP与之结合并扩增(步骤⑩)。如此循环往复,最终扩增产物为以靶序列和添加序列为单元的多个重复序列的双链DNA(步骤)。

图1 SRCA反应原理图Fig.1 Schematic diagram of SRCA assay
该技术与RCA技术相比,无需锁式探针和连接酶以及人为环化过程,操作步骤简单,耗时缩短约3 h,成本降低约3/4;与LAMP技术相比,所需引物数量减少,避免了引物之间的相互作用,成本降低约二分之一,可通过测序验证扩增结果的正确性,已成功应用于食源性病原菌的检测[24-25]。
核酸检测技术的一个共性问题是无法区分死菌与活菌。叠氮溴化丙锭(propidium monoazide,PMA)[26-27]染料可进入到死细胞中与dsDNA发生不可逆交联反应,并阻止其后续的扩增反应[28-29],但PMA染料无法穿过活细胞的细胞膜,因此可区分死菌与活菌[30]。
本研究以toxR基因为特异性靶基因[31],通过大量预实验筛选出了一对最合适的引物,建立检测虾产品中活副溶血性弧菌的PMA-RF-SRCA方法,并对此方法进行评价,旨在为食品中副溶血性弧菌的快速检测与筛查提供新方法。
1 材料与方法
1.1 材料与试剂
样品市购,详情见表1。

表1 76 份实际样品清单Table 1 List of 76 crustacean samples tested in this study
细菌全基因组DNA提取试剂盒、PMA染料、BstDNA聚合酶 大连宝生物工程有限公司;2×EasyTaqPCR SuperMix 北京索莱宝科技有限公司;DNA片段回收试剂盒、基因克隆T4载体 北京全式金生物技术有限公司;正、反向引物由北京华大基因合成。
1.2 仪器与设备
荧光定量PCR仪 中国Archimed Analyzer公司;Nanodrop 2000分光光度计 Gene company Limited基因有限公司;TGL16A台式离心机 上海卢湘仪离心机仪器有限公司;DXY-33A型电泳仪 北京六一仪器厂;JY04S-3E凝胶成像仪 北京君意电泳设备有限公司。
1.3 方法
1.3.1 菌株培养
将副溶血性弧菌(ATCC 17802)接种于3%氯化钠碱性蛋白胨水液体培养基中,于37 ℃过夜培养12 h,取1 mL菌悬液于新的3%氯化钠碱性蛋白胨水液体培养基中,37 ℃培养14 h制备指数期菌悬液,备用。其他菌株均在相应培养基中纯化备用。
1.3.2 死细胞的制备
采取加热煮沸法制备死细胞。取1.3.1节中1 mL备用菌悬液于100 ℃持续沸腾加热15 min,采用平板计数法确定细胞全部死亡。
1.3.3 PMA处理与基因组DNA的提取
向1 mg PMA染料中加入98 μL ddH2O,制备成20 mmol/L的PMA储备溶液,于-20 ℃避光贮存。取1.3.1节备用菌液1 mL,按照细菌全基因组DNA提取试剂盒说明书操作步骤提取DNA,于-20 ℃贮存备用。取1.3.2节热处理后的菌液1 mL加入一定量的PMA储备液,再经过孵育、曝光处理后,按照细菌全基因组DNA提取试剂盒说明书操作步骤提取DNA,于-20 ℃贮存备用。
1.3.4 引物设计
选取toxR基因为靶基因,通过GenBank中的BLAST比对挑选出一条同源性高的序列作为靶序列,利用Primer Premier 5.0和DNAMAN软件设计引物,引物序列详细信息见表2。
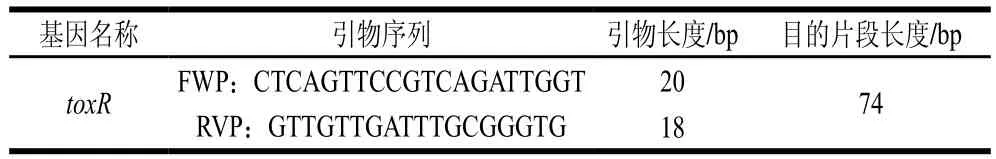
表2 引物序列Table 2 Primer sequences used for amplification of toxR in this study
1.3.5 PMA处理条件的优化
将所有样品分成PMA处理组和未处理对照组。PMA处理组:将2 μL的PMA储备液分别加入到1 mL备用纯活菌及纯死菌菌悬液中,于暗处处理5 min或10 min;接着进行曝光处理5、10、15、20 min;5 000 r/min离心10 min。以未经PMA处理的纯活菌及纯死菌菌悬液为对照。
1.3.6 PMA-RF-SRCA方法的建立
PMA-RF-SRCA体系为:dNTPs(2.5 mmol/L)4.0 μL,Mg2+(20.0 mmol/L) 3.0 μL,10×ThermoPol Reaction Buffer 2.0 μL,FWP(10.0 μmol/L)1.0 μL,RVP(10.0 μmol/L)1.0 μL,DNA模板(71.1 ng/μL)1.0 μL(阴性不添加),BstDNA聚合酶(8 000 U/mL)1.5 μL,添加无菌去离子水将体系补足至20.0 μL。PMA-RF-SRCA的反应利用荧光定量PCR仪进行,变性、退火、延伸均为同一温度,反应程序为62 ℃、15 s;62 ℃、80 s,60(或45)个循环,每个循环采集一次信号;80 ℃、5 min。
1.3.7 PMA-real-time PCR方法的建立
PMA-real-time PCR体系为2×TaqPCR MasterMix 11.0 μL,正、反向引物各添加1.0 μL,模板1.0 μL(阴性不添加),无菌去离子水补足体系至25.0 μL。利用荧光定量PCR仪进行反应,反应程序为:95 ℃预变性5 min;然后95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,40 个循环,每个循环采集一次信号。
1.3.8 产物测序分析
用凝胶电泳法对SRCA扩增结果进行分析,在紫外灯下从下往上选取3~4 条清晰条带进行连接、转化、纯化、菌液验证等操作,并送至北京博迈德基因技术有限公司测序分析。
1.3.9 PMA-RF-SRCA特异性实验
菌株信息如表3所示,共选取30 株菌株,包括12 株副溶血性弧菌和18 株非副溶血性弧菌。分别提取模板DNA,用建立的PMA-RF-SRCA方法进行结果判定。

表3 本研究所用菌种Table 3 Bacterial strains used in this study

续表3
1.3.10 灵敏度实验
为分析PMA-RF-SRCA检测纯菌液的灵敏度,取1 mL备用菌液进行10 倍梯度稀释,获得浓度为3.2×109~3.2×100CFU/mL的菌悬液,提取模板DNA后分别进行PMA-RF-SRCA及PMA-real-time PCR,以荧光曲线法对反应结果进行分析,并比较2种方法的灵敏度。
1.3.11 检出限实验
选用虾产品作为实验样品,对所有实验样品先进行巴氏灭菌,使用GB 4789.7—2013验证不含活副溶血性弧菌。将已知浓度的备用纯菌悬液加入到25 g阴性样品中,采用国标法进行计数,用均质液依次进行10 倍梯度稀释,制得浓度梯度为2.08×108~2.08×101CFU/g的人工污染样本,未接种的样品作为阴性对照,分别进行PMARF-SRCA及PMA-real-time PCR,以荧光曲线法对反应结果进行分析,并确定2种方法的检出限。
1.3.12 PMA-RF-SRCA方法的实际应用与评价
为探究PMA-RF-SRCA方法对实际样品中副溶血性弧菌的检出情况,对76 份虾产品(表1)进行检测,将PMA-RF-SRCA方法与PMA-real-time PCR及GB 4789.7—2013进行对比,每次实验均重复3 次,分别计算3种方法的阳性检出率,并计算相对敏感性、相对特异性、相对符合率评估此方法。
1.4 数据分析
使用Origin 2018软件及IBM SPSS Statistics 26软件通过单因素方差分析进行统计分析。P<0.05,差异显著。
2 结果与分析
2.1 PMA处理条件优化
使用浓度为3.2×109CFU/mL的活副溶血性弧菌菌悬液进行实验,每组实验均重复3 次,PMA处理条件优化结果如图2所示。孵育10 min和光照15 min时活细胞数量最多,且与其他处理组之间具有显著差异(P<0.05);并且在该PMA处理条件下,RF-SRCA方法无法检测到扩增信号,表明该条件下死细胞DNA的扩增被完全抑制。故本实验选取PMA孵育10 min和光照15 min为PMA处理的最佳条件。
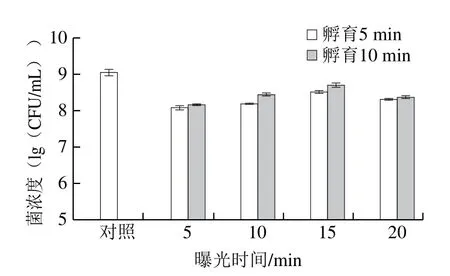
图2 PMA处理条件优化Fig.2 Optimization of PMA processing conditions
2.2 产物测序分析
测序结果如图3所示,结合基因组序列及图3B可知,SRCA跨环时添加的碱基包括FWP上游序列的4 个碱基和RVP互补序列下游序列的3 个碱基,SRCA扩增产物为以靶序列和添加序列为单元的多个串联重复序列,SRCA扩增结果与反应原理一致。
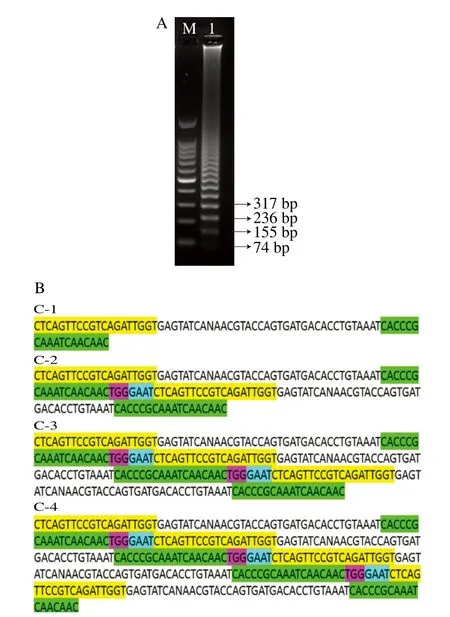
图3 副溶血性弧菌SRCA反应的电泳和测序结果分析Fig.3 Electrophoresis and sequencing of SRCA products of V.parahaemolyticus
2.3 PMA-RF-SRCA特异性分析
采用实时荧光曲线法对引物进行特异性分析。如图4及表3所示,12 株副溶血性弧菌均成功扩增出了荧光曲线且具有单一的溶解峰((83.699±0.4)℃),判定为阳性,而18 株非副溶血性弧菌没有扩增出荧光曲线,判定为阴性。结果表明,PMA-RF-SRCA方法具有良好的特异性,可用于副溶血性弧菌的鉴定与筛查。
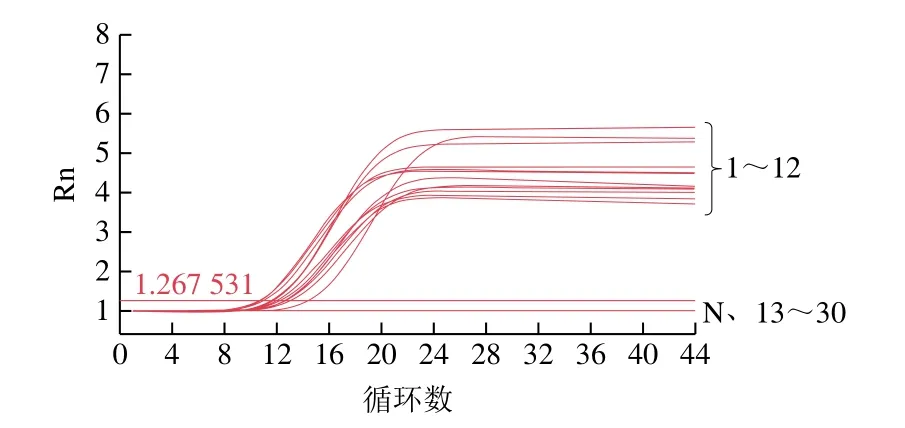
图4 荧光曲线法特异性分析Fig.4 Fluorescence amplification curves showing the specificity of PMA-RF-SRCA
2.4 灵敏度实验结果
对处于指数生长期的菌悬液(终浓度为3.2×109CFU/mL)进行10 倍梯度稀释,提取各稀释度菌悬液的DNA后分别进行PMA-RF-SRCA及PMA-real-time PCR。由图5A可知,对于PMA-RF-SRCA反应,当细胞浓度为3.2×109~3.2×100CFU/mL时,均可成功扩增出荧光曲线,故PMA-RF-SRCA方法的灵敏度为3.2×100CFU/mL。由图5B可知,对于PMA-real-time PCR,当细胞浓度为3.2×109~3.2×102CFU/mL时,均可成功扩增出荧光曲线,但当细胞浓度降低到3.2×101CFU/mL时已观察不到荧光曲线,故PMA-real-time PCR方法的灵敏度为3.2×102CFU/mL。PMA-RF-SRCA方法的灵敏度是PMA-real-time PCR的100 倍。
2.5 检出限实验结果
将人工污染的虾产品样本按照GB 4789.7—2013进行前处理,利用均质液进行10 倍梯度稀释,菌液浓度为2.08×108~2.08×100CFU/g。提取模板DNA后分别进行PMA-RF-SRCA反应及PMA-real-time PCR。如图6A所示,对于PMA-RF-SRCA反应,当菌液浓度为2.08×108~2.08×101CFU/g时,均可成功扩增出荧光曲线,故此方法的检出限为2.08×101CFU/g。对于PMA-real-time PCR(图6B),当菌液浓度降低到2.08×102CFU/g 时,不再扩增出荧光曲线,故此方法的检出限为2.08×103CFU/g。因此,PMA-RF-SRCA方法的检出限低至PMA-real-time PCR的1/100。
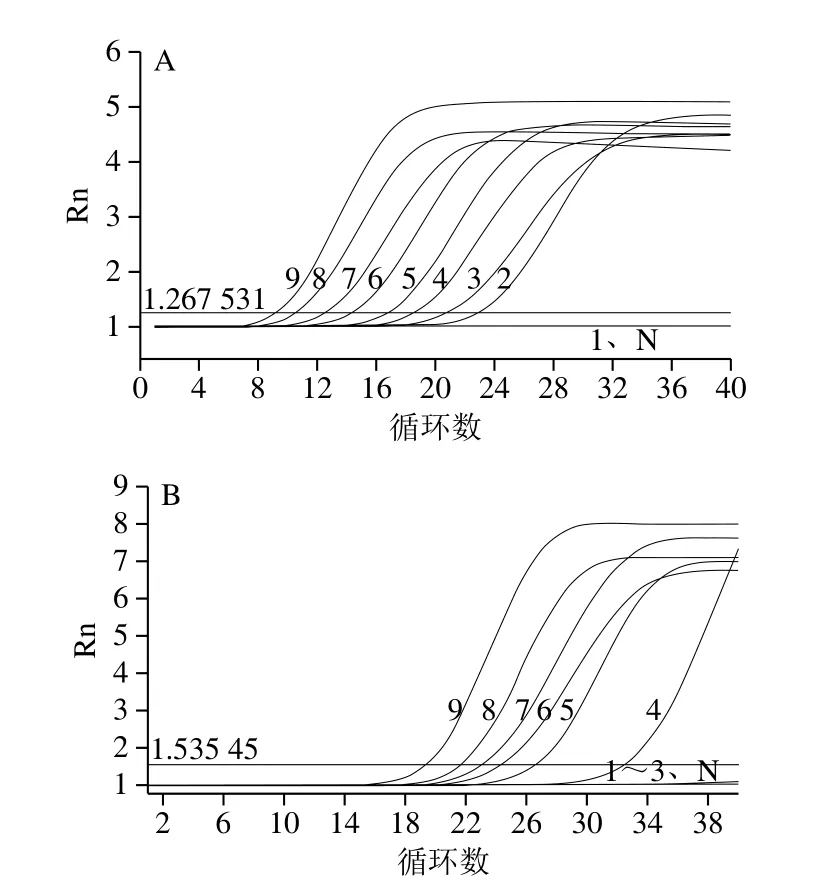
图6 检出限检测分析Fig.6 Determination of detection limit of PMA-RF-SRCA and PMA-real-time PCR
2.6 PMA-RF-SRCA方法的实际应用与评价
分别用GB 4789.7—2013、PMA-RF-SRCA、PMA-real-time PCR 3种方法对76 份虾产品样本进行检测。以GB 4789.7—2013为标准,结果如表4所示。国标法阳性样品检出数为51 个,阴性样品数为25 个,其阳性样品检出率为67.11%(51/76);PMA-RT-SRCA法阳性样品检出数为52 个,真阳性为51 个,假阳性为1 个,真阴性为24 个,故阳性样品检出率为68.42%(52/76);PMA-realtime PCR法阳性样品检出数为53 个,真阳性为51 个,假阳性为2 个,真阴性为23 个,故阳性样品检出率为69.74%(53/76);以GB 4789.7—2013方法为基准,经计算[22,32-34],PMA-RF-SRCA方法的相对敏感性为100.00%,相对特异性为96.00%,相对符合率为98.68%;PMA-real-time PCR方法的相对敏感性为100.00%,相对特异性为92.00%,相对符合率为97.37%。
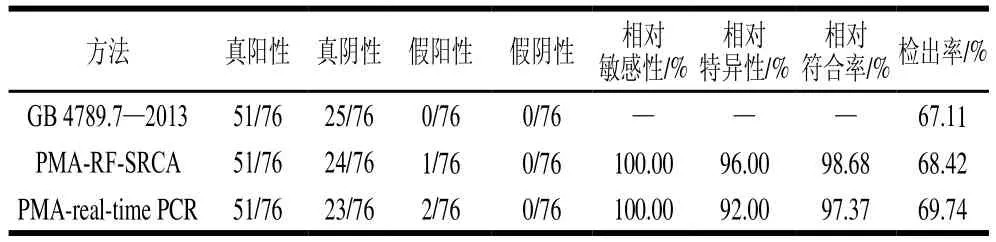
表4 PMA-RF-SRCA及PMA-real-time PCR方法评估Table 4 Evaluation of PMA-RF-SRCA and PMA-real-time PCR
3 结 论
本研究成功建立了用于检测虾产品中活副溶血性弧菌的PMA-RF-SRCA方法,通过测序分析验证了扩增结果的正确性,检测时间大大缩短。使用40 mmol/L的PMA处理浓度和3.2×109CFU/mL的死/活副溶血性弧菌对PMA处理条件进行优化,得出PMA的最佳孵育时间为10 min,曝光时间为15 min。利用PMA-RF-SRCA方法进行特异性实验,12 株副溶血性弧菌均呈阳性,18 株非副溶血性弧菌均呈阴性,结果证明本方法具有较强的特异性。PMA-RF-SRCA检测副溶血性弧菌纯菌液的灵敏度为3.2×100CFU/mL,是PMA-real-time PCR的方法高100 倍;人工污染的虾产品样本中副溶血性弧菌的检出限为2.08×101CFU/g,低至PMA-real-time PCR的1/100。利用PMA-RF-SRCA、PMA-real-time PCR及GB 4789.7—2013方法对76 份实际样品进行检测,国标法阳性检出率为67.11%,PMA-RF-SRCA及PMA-real-time PCR方法阳性检出率分别为68.42%、69.74%。以GB 4789.7—2013为标准,PMA-RF-SRCA的相对敏感性为100.00%,相对特异性为96.00%,相对符合率为98.68%;PMA-real-time PCR的相对敏感性为100.00%,相对特异性为92.00%,相对符合率为97.37%。
