血清铁指标检测项目和骨髓铁染色在炎症性贫血中的诊断价值比较
2022-01-06吴胜黄建军孟蓉
吴胜,黄建军,孟蓉
(彭州市人民医院检验科,四川 彭州 611930)
炎症性贫血(AI)又称慢性病贫血(ACD),是与大多数慢性感染、 炎症或一些恶性肿瘤相关的轻至中度贫血(Hb 70~120g/L),发病率较高,为仅次于缺铁性贫血(IDA)居第二位的最常见贫血类型,也是住院患者最常见的贫血类型[1]。 其特征为尽管骨髓中巨噬细胞的储存铁正常甚至增多,但血清铁和铁结合力降低,红细胞生成减少。 通常红细胞为正细胞正色素性,也可表现为小细胞低色素性。血清铁检测项目及骨髓铁染色能够直观反映机体的储存铁和铁利用情况,对炎症性贫血的诊断具有重要的临床价值,虽然骨髓铁染色一直被认为是鉴别AI 和铁缺乏的 “金标准”,但因该操作对患者带来的不适以及采样的质量对结果影响太大,故逐渐被血清铁指标联合检测所代替。
1 资料与方法
1.1 一般资料 回顾性分析2017年6月-2019年6月我院收治贫血67 例,男42 例,女25 例。年龄32~76岁,平均年龄56岁。 以上病例均已通过临床确诊,其中AI 病例27 例,IDA 病例37 例,铁粒幼细胞贫血(SA)3 例。 经详细病史采集,所有患者3个月内均无输血和铁剂治疗史,并排除血液系统恶性肿瘤、巨幼红细胞贫血、溶血性贫血、慢性失血、肾功能障碍、稀释性贫血等可能干扰铁代谢的贫血类型[2]。 另选同期13 例正常骨髓象、无贫血、无感染及炎症指标患者设为对照组,男8 例,女5例,年龄27~66岁,平均48岁。
1.2 诊断标准 AI、IDA、SA 诊断标准参考文献[3]。
1.3 标本处理 ⑴抽取患者空腹血2~3ml,保持3000 r/min 速度实施血清分离处理5 min,采用无脂血、溶血、黄疸标本,采集后2h 内上机检测;⑵骨髓细胞学检查时确保骨髓涂片富含骨髓小粒,穿刺后1h 内固定染色。
1.4 检测项目和方法 所有患者均进行血清铁指标检测和骨髓铁染色检查。 ⑴红细胞及血红蛋白参数检测应用mindray 全自动血细胞分析仪BC-6800,试剂采用仪器配套试剂;⑵血清铁、总铁结合力的检测应用Ferene 法, 仪器为Beckman 5811全自动生化分析仪, 试剂采用利德曼总铁结合力(TIBC)测定试剂盒;⑶铁蛋白检测应用化学发光微粒子免疫检测法,仪器为Abbott i2000SR,试剂采用Abbott 铁蛋白测定试剂盒; ⑷铁染色应用普鲁士蓝染色及沙黄复染法,采用贝索骨髓铁染色试剂盒。
2 结果
2.1 血清铁指标参数比较 4 组血清铁指标参数见表1,AI 组细胞内铁及SI 水平略高于IDA 患者组且低于正常对照组及SA 患者组, TIBC 水平低于IDA 患者组及正常对照组,差异有统计学意义(P<0.05)。其中有1 例患者SF<12ug/L,其余均>45ug/L。
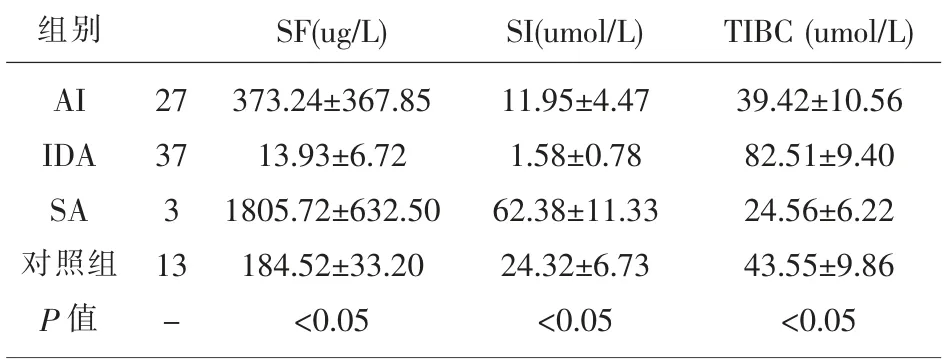
表1 血清铁指标参数结果
2.2 骨髓铁染色结果比较 4 组骨髓铁染色结果见表2,AI 患者组细胞外铁及SF 水平同时高于IDA患者组及正常对照组,低于SA 患者组。其中仅有1例细胞外铁阴性,其余均为阳性或强阳性。
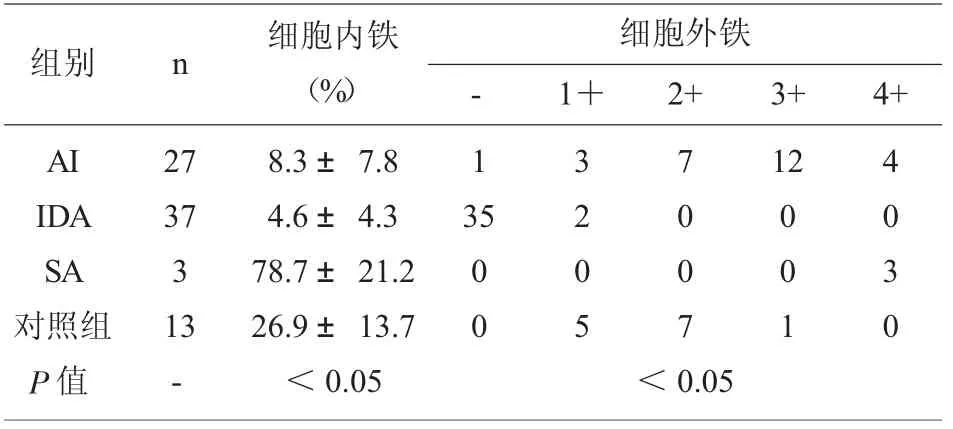
表2 骨髓铁染色结果
2.3 铁指标血清检测与骨髓铁染色的Spearman 等级相关分析 Spearman 等级相关分析见表3,骨髓细胞外铁与SF 呈高度正相关,骨髓细胞内铁与SF、SI 均呈高度正相关,与TIBC 呈负相关。
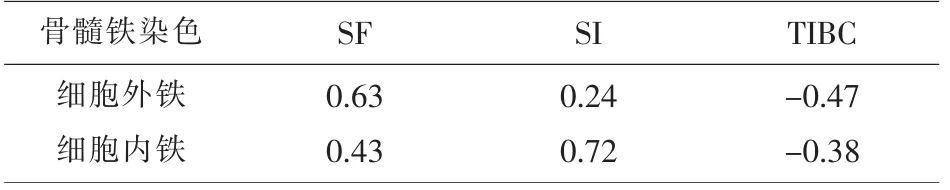
表3 骨髓铁染色与血清铁指标的Spearman 等级关分析
3 讨论
有关AI 的发病机制目前尚未完全清楚,但通常认为是由于炎性细胞因子抑制红细胞生成所引起的,其中炎症细胞因子诱导产生铁调素增多在AI 的发病机制中最为关键[4]。 AI 的一个特征性临床表现是SI、TIBC 减低、SF 并不减低,骨髓铁染色细胞外铁增多,而低铁血症在感染或严重的炎症起病后数小时内即可发生。 研究认为这种铁代谢机制可能是对机体的一种保护,机体不能正常利用储存铁导致假性低铁,低铁限制了外来侵入性病原体增殖所需的微环境营养[5]。 骨髓铁染色作为贫血骨髓细胞形态学检验的必须项目,是评价体内铁缺乏的金标准,也是评估细胞铁利用障碍的最佳方法。 但是骨髓穿刺作为一种侵入性操作,容易给患者造成不适及恐惧心理,并且铁染色对骨髓标本要求较高,需要比较丰富的骨髓小粒,如果因为标本不合要求重新采集患者往往不易接受。再次,铁染色操作中干扰因素较多,如:涂片标本铁质污染、染色液配比失当、染色时间及室温影响等均可造成最终结果的误差。 AI 的治疗主要是针对基础疾病,基础疾病纠正后贫血常得以纠正[6],故临床诊断尤为重要。 目前,临床医师对AI 的诊断思路大多是依循原发病去推测,但部分原发病发病隐匿诊断不明,部分AI 的临床表现又容易被原发病的症状和体征所掩盖,造成误诊、漏诊。 因此,采用一系列准确、敏感、简便、快捷的检测手段是提高临床医师对该病诊断准确率的基础。 为了了解血清铁指标与骨髓铁染色的相关性,进行了之前的研究。
统计结果显示,AI 患者骨髓铁染色及血清铁指标参数具以下特点: ⑴细胞内铁及SI 水平略高于IDA 患者组且低于正常对照组及SA 患者组;⑵细胞外铁及SF 水平同时高于IDA 患者组及正常对照组,低于SA 患者组;⑶TIBC 水平低于IDA 患者组及正常对照组,差异有统计学意义(P<0.05);⑷经Spearman 等级相关分析,骨髓细胞外铁与SF呈高度正相关,骨髓细胞内铁与SF、SI 均呈高度正相关且与TIBC 呈负相关。 此结果与夏存玉[7]的研究报道相一致。 进一步对比两种方法的临床价值,可以显见血清铁指标检测在单纯性IDA 诊断中,其特异性和敏感性是优于骨髓铁染色的;在SA 诊断中,铁染色环形铁粒幼红细胞的检出在诊断中有着不可替代的价值;在AI 诊断中,骨髓铁染色与血清铁指标相关性良好,但是由于缺铁性红细胞的生成需要一定的时间,因此细胞内铁用于炎症早期的判断不具备敏感优势,而SI、TIBC 在短时间内即可产生变化,用于AI 的诊断及预后监测都具有重要价值。 值得一提的是,SF 在AI 中可表现为急性时相反应蛋白,在此种情况下如将其作为缺铁判断指标,应提高其诊断阈值[8]。
需要指出的是,本次研究中,有1 例AI 患者合并储存铁减低。 有研究显示慢性炎性疾病可最终出现真正的铁缺乏,AI 伴缺铁(CDID)在AI 患者中占比达60.5%[9],此类贫血部分也表现为储存铁及内铁减低,因此在诊断上使用上述铁指标检测方法CDID 与AI 有时不易鉴别。 相关文献报道,铁调节激素(Hepc)与AI 发病机理密切相关,Hepc 过量,会降低铁吸收,防止铁再循环而导致的血清铁减少,在AI 中是一个关键性的病理作用[10]。 张文龙[11]等研究表明,血清可溶性转铁蛋白受体(sTfR)用于诊断缺铁有较强的特异性,不易受炎症及慢性疾病等干扰,理想的诊断方法是将SF 作为铁贮存的指标,而sTfR 作为组织铁缺乏的指标[12]。 另外,张伟[13]等使用红细胞参数联合铁指标诊断CDID 的经验值得未开展sTfR 检测的医院借鉴。
综上所述,在AI 的诊断及后期监测中,血清铁指标因其准确度高、敏感性好、操作便捷、患者容易接受等优点,在临床检验中的使用价值超过骨髓铁染色,但是在贫血诊断依据不足或考虑有其他可能原因时,需联合铁染色及骨髓细胞形态学进行综合评估,可以获取更精准的诊断效果。
