启膈散对食管鳞状细胞癌上皮- 间质转化的影响
2022-01-06张春燕王秀敏
张春燕,王秀敏
(1.安阳市人民医院护理部;2.安阳市人民医院消化内科,河南 安阳 455000)
食管癌是常见的消化道恶性肿瘤,而且中国人群食道癌发病率显著高于世界平均水平。 食管癌具有两种病理分型,其中约80%患者为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC),20%患者为食管腺癌(esophageal adenocarcinoma,EAC)。 尽管手术治疗和放、化疗在一定程度上延长了食管癌患者的生存期,但由于癌症的转移和复发依然影响食管癌预后的重要因素[1,2]。启膈散主治噎膈、吞咽困难,临床研究发现,启膈散在防治食管癌癌前病变、 改善中晚期患者生存质量方面具有一定功效[3-5],然而其有效成分及作用机制还没有深入的研究。 肿瘤细胞通过上皮-间质转化增强侵袭和转移能力,因此抑制上皮-间质转化的过程对防治肿瘤的转移和复发具有重要意义。本研究通过建立体外培养的食管癌细胞系Eca109上皮-间质转化模型,探究了启膈散对食管癌上皮-间质转化的影响及机制。
1 材料和方法
1.1 药物 沙参15g,丹参15g,荷叶蒂15g,茯苓15g,川贝母6g,郁金10g,砂仁壳3g,加入1000ml水加热煮沸煎制。 中药煎出液经离心去除药渣,上清放置于旋转蒸发仪中,40℃蒸发浓缩。 随后将浓缩液转移到-80℃冰箱冷冻过夜,后于冻干机中制备冻干粉,称量后分装保存。 使用前,用DMEM 培养基溶解配置成5mg/ml 的母液,经过0.22μm 滤器过滤除菌,放置于4℃保存。
1.2 主要试剂和耗材 DMEM 高糖培养基(美国GE 健康公司)、胎牛血清(美国Gibco 公司)、胰蛋白酶-EDTA 消化液(美国Gibco 公司)、CCK-8 细胞活性试剂盒(日本同仁化学研究所)、细胞培养皿和培养板(美国康宁公司)、Transwell 小室(美国BD 公司)、小鼠抗E-钙粘蛋白抗体和小鼠抗N-钙粘蛋白抗体(美国Abcam 公司)、小鼠抗波形蛋白抗体(美国CST 公司)、 兔抗GAPDH 抗体(美国Santa Cruz 公司)、HRP 偶联抗小鼠IgG 抗体和抗兔IgG 抗体(天津三箭生物公司)、TriZOL 总RNA提取试剂(美国ThermoFisher 公司)、qPCR super Mix(美国Roche 公司)。
1.3 细胞培养和处理 人食管鳞癌细胞系ECA109购自中国医学科学院细胞库。 细胞复苏后培养在含有10%胎牛血清的DMEM 完全培养基中,于二氧化碳培养箱中传代培养。 加药处理时,将ECA109 细胞分为4 组,其中对照组不加入启膈散,其余三组分别加入终浓度50、100、200μg/ml 的启膈散,放置于二氧化碳培养箱中培养24h。
1.4 CCK-8 实验检测细胞增殖活性 消化离心收集传代培养的ECA109 细胞,使用DMEM 完全重悬细胞并计数后,接种于96 孔培养板中,每孔5×104个细胞,每组设置3 个复孔平行对照。 在加入启膈散后的第0 h、24 h、48 h 时,加入10μl CCK-8检测液,继续置于37℃二氧化碳培养箱中培养4h,使用酶标仪读取450 nm 波长的吸光值。
1.5 Transwell 实验检测细胞迁移能力 消化并用无血清DMEM 培养基重悬ECA109 细胞,将细胞密度调整为1×106个/mL。 取200μl 细胞悬液,加入到Transwell 上层小室中,并将小室放置于24 孔细胞培养板中,培养板每孔加入600μl 完全培养基。将Transwell 装置放置于37℃二氧化碳培养箱中培养24 h,随后取出Transwell 装置,放置于4%多聚甲醛溶液中固定15 min,然后使用PBS 清洗3 次,每次5min。 用棉签擦拭小室内未迁移的细胞,使用0.1%结晶紫溶液室温染色20 min,用PBS 充分清洗去掉浮色。 将Transwell 小室薄膜取下,使用明场显微镜拍照,并计算视野中发生迁移的细胞数。 拍照后,将薄膜浸泡于10%乙酸溶液中抽提10 min,使用酶标仪检测抽提液590 nm 波长的吸光值,并计算相对迁移率。
1.6 总RNA 提取及Real-time PCR 检测 不同浓度启膈散处理的Eca109 细胞经过消化并离心,使用磷酸盐缓冲液清洗一遍,加入500μl TriZOL 试剂裂解,随后加入氯仿抽提RNA,并用异丙醇沉淀并洗涤,得到的总RNA 用DEPC 处理的ddH2O 溶解得到1 μg/μl。 随后使用M-MLV 逆转录酶进行cDNA 合成。 取1μg 总RNA,加入oligo dT 引物,65℃变性5 min,后立刻冰浴退火2 min。 随后在反应体系中加入dNTPs、M-MLV、 核酸酶抑制剂等,放置在42℃金属加热器中反应30 min。 随后使用实时荧光定量PCR Mix 进行目的基因mRNA 表达水平的检测,通过ΔΔCt 法计算基因相对表达水平,所用引物序列为,见表1。

表1 引物序列信息
1.7 蛋白质免疫印迹实验 使用细胞裂解液重悬Eca109 细胞,放置于冰上裂解30 min。 12000 rpm离心10 min,上清加入SDS 上样缓冲液沸水浴加热10 min。 随后使用SDS-PAGE 电泳蛋白样品,使用湿法转膜将蛋白样品转印在尼龙膜上。 使用封闭液孵育30 min,然后分别加入稀释后的一抗,室温孵育60 min,使用TBST 溶液漂洗3 次,每次5 min,加入二抗室温孵育45 min,随后使用TBST 溶液漂洗5 次,每次5 min。 最后加入发光底物,用凝胶成像仪拍摄蛋白条带。
1.8 统计分析 采用Graphpad Prism 8.0 统计软件进行统计学分析,数据以±s 表示。采用t test 分析组间差异,P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度启膈散对细胞增殖活性的影响 实验结果表明启膈散在50 μg/ml、100 μg/ml 作用浓度时对未对细胞增殖活性产生明显影响(50 μg/ml组:t = 0.5196,P =0.6308;t =0.5203,P =0.6303;t =1.514 P=0.2046;100 μg/ml 组:t=1.109,P=0.3297;t= 0.3464,P=0.7465;t= 0.4856,P=0.6526),而当启膈散作用浓度增加到200μg/ml,在作用24 h、48 h和72 h 后,显著抑制了Eca109 细胞的增殖活性(24 h: t=3.122,P=0.0354;48 h: t=4.102,P=0.0148;72 h: t=5.042,P=0.0073),见表2。
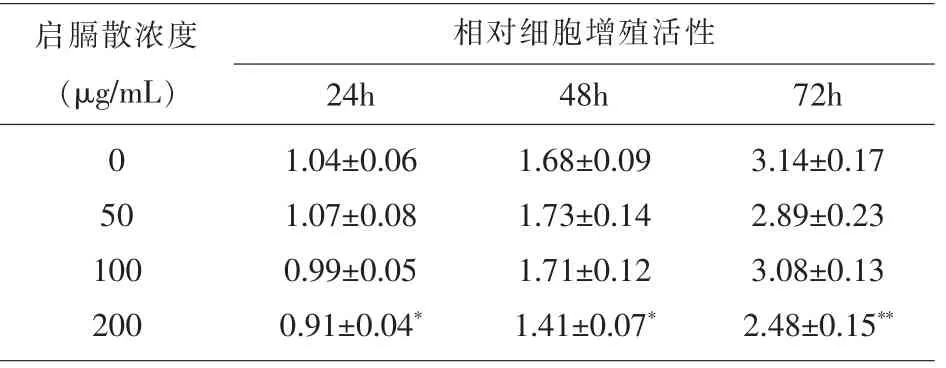
表2 启膈散处理后各组细胞相对增殖活性
2.2 不同浓度启膈散对细胞迁移的影响 实验结果表明,见图2,50μg/ml 启膈散对细胞迁移能力没有明显影响,而将启膈散浓度提高到100μg/ml 或200μg/ml 时,迁移到下层小室的细胞明显减少(50μg/ml 组:t =0.753,P =0.4934;100μg/ml 组:t =2.817,P=0.048;200μg/ml 组:t=6.353,P=0.0031),见图2,通过定量统计相对细胞迁移率发现,与对照组相比,100μg/ml 和200μg/ml 启膈散处理组相对细胞迁移率均显著下降(50μg/ml 组:t=0.723,P=0.5097;100μg/ml 组:t =3.49,P =0.0251;200μg/ml组:t=4.153,P=0.0142),见图3,且启膈散对细胞迁移的抑制作用随浓度升高而增加。
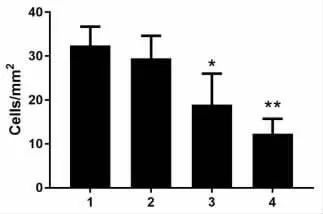
图2 迁移到下层小室的细胞数
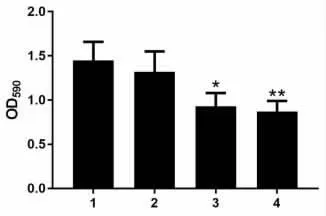
图3 各组细胞相对迁移率
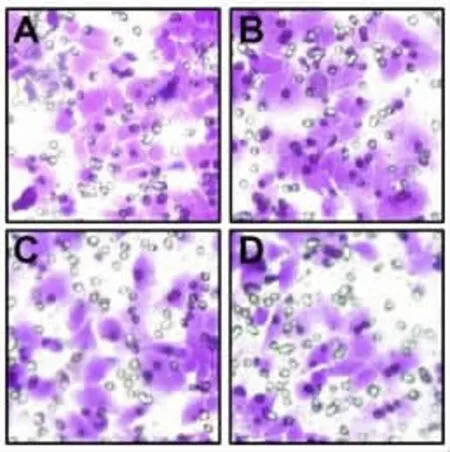
图1 结晶紫染色标记迁移到下层小室的细胞。
2.3 Real-time PCR 检测Eca109 细胞E-cadherin、N-cadherin 和Vimentin 的mRNA 表达水平 实验结果表明,50μg/ml 浓度的启膈散对Eca109 细胞中N-cadherin、E-cadherin 和Vimentin 蛋白mRNA的表达未产生显著影响,但启膈散作用浓度增加到100μg/ml 或200μg/ml 后,Eca109 细胞中N-cadherin(50μg/ml 组:t=1.076,P=0.3427;100μg/ml 组:t=6.023,P=0.0038;200μg/ml 组:t=5.573,P=0.0051)和Vimentin(50μg/ml 组:t=1.315,P=0.2590;100μg/mL 组:t=6.185,P=0.0035;200μg/ml 组:t=7.907,P=0.0014)mRNA 表达水平显著下降,而E-cadherin(50μg/ml 组:t =1.033,P =0.3601;100μg/ml 组:t =3.361,P=0.0283;200μg/ml 组:t=3.366,P=0.0281)蛋白mRNA 表达水平显著上升,见图4。
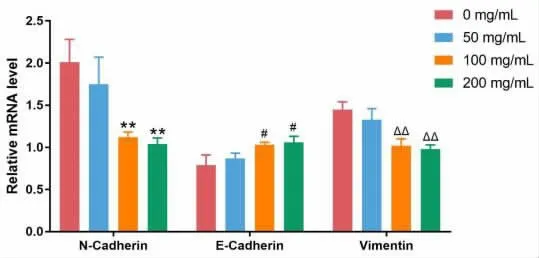
图4 不同浓度启膈散处理的Eca109 细胞中N- cadherin、E- cadherin 和Vimentin 蛋白mRNA 的相对表达水平
2.4 Western blot 实验检测上皮-间质转化标记分子蛋白蛋白表达水平 实验结果表明,50μg/ml 浓度的启膈散抑制了N-cadherin 蛋白水平的表达,但对E-cadherin 和Vimentin 蛋白水平的表达未产生显著影响,而当启膈散作用浓度增加到100μg/ml 或200μg/ml 后,E-cadherin 蛋白水平的表达显著上升,而N-cadherin 和Vimentin 蛋白的表达水平显著下降,见图5。
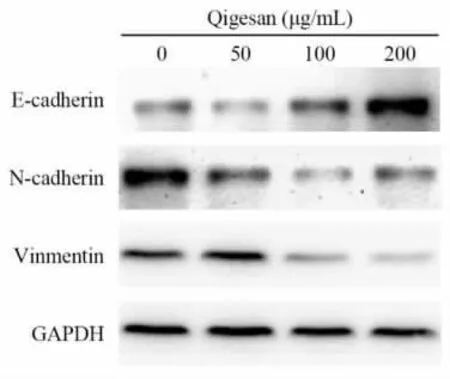
图5 不同浓度启膈散处理的Eca109 细胞中N- cadherin、E- cadherin 和Vimentin 蛋白相对表达水平
3 讨论
当前,食管癌治疗的主要方法是手术结合放化疗,但由于食管癌细胞的侵袭和转移,常导致患者术后复发,影响生存率。 启膈散出自清代中医著作《医学心悟》,主治 “噎嗝”,而食管癌部分临床症状如吞咽困难等于 “噎嗝” 相似[6]。 传统中医理论,阴虚、气郁、痰气交阻是食管癌发病的病机,而李晶等提出 “血液衰耗,胃脘干槁” 是其核心病机[3]。启膈散具有滋阴、润燥、解郁、化痰之功效[6],近几十年了被广泛接受作为食管癌的中医治疗方案,并取得了较为明显的疗效[3-5]。 此外,启膈散也可与化疗药物如顺铂、 紫杉醇等联合用药改善了食管癌的治疗预后[7,8]。史会娟等发现启膈散可以影响食管癌细胞骨架的重排[9];吴耀松等和尹素改等分别发现启膈散会通过下调转录因子STAT3 抑制食管癌细胞的增殖,诱导细胞凋亡[10,11]。 然而,启膈散中的有效作用成分及其参与食管癌疾病发生发展的分子机制还不是很清楚[12]。
食管癌细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT) 在肿瘤浸润和转移过程中发挥了重要的作用[13]。 在肿瘤细胞EMT 的过程中,细胞由连接紧密的上皮样细胞转变为间质样细胞,上皮细胞粘附分子E-cadherin 表达水平下调,而非上皮细胞粘附分子N-cadherin 表达水平上升,细胞粘附能力减弱,而迁移能力增强[14]。 EMT过程中另一个标记分子Vimentin 属于细胞骨架组分III 型中间丝,可以被转录因子Smad 激活表达,在EMT 过程中表达水平上升[15,16]。 本研究中,我们发现使用不同浓度的启膈散均会引起N-cadherin、Vimentin 蛋白及mRNA 表达水平的下降,以及Ecadherin 蛋白及mRNA 表达水平的上升,且随着启膈散浓度的升高其表达水平变化更显著,该结果提示启膈散可以抑制食管癌细胞系Eca109 的EMT 过程。 与此相一致的是,通过Transwell 实验检测发现加入不同浓度启膈散也会抑制Eca109细胞的迁移能力,且启膈散的抑制作用具有剂量依赖效应。 综上所述,本研究发现了启膈散可以通过抑制食管癌细胞的上皮-间质转化影响细胞的迁移。
