慢性阻塞性肺疾病患者外周血单个核细胞中TLR2/4- NFκB 及IRAK1/4 信号通路变化研究
2022-01-06李航黄昊
李航,黄昊
(开封市中心医院 检验科,河南 开封 475000)
慢性阻塞性肺疾病(COPD)的主要特征为持续性气流受限且多呈进行性发展,并伴有肺功能进行性减低,还可伴随心血管疾病、代谢综合征等并发症[1]。 研究表明,相关炎症信号通路激活、炎症因子异常表达在气道壁和肺实质损伤中具有关键性作用[2]。 Toll 样受体(TLRs)是机体重要的模式识别受体之一,而核因子κB(NF-κB)位于TLRs 下游信号通路的关键位置,TLRs-NF-κB 信号通路过度激活情况下可导致炎症反应失控,参与呼吸道及肺组织损伤、破坏[3]。 白细胞介素-1 受体相关激酶(IRAK)可介导包括TLRs 在内的多细胞受体信号,在多种炎症细胞信号转导网络中具有重要调节作用[4]。 本研究通过检测COPD 患者外周血单个核细胞(PBMCs)中TLR2/4-NF-κB 及IRAK1/4 信号通路表达,旨在探讨其在COPD 发病中的作用,为COPD 的防治提供参考依据。
1 资料与方法
1.1 一般资料 本研究所有受试者均自愿参与且签署知情同意书,研究设计经医院伦理委员会审核批准通过。 选取2018年1月至2019年6月期间,在本院就诊并符合入选标准的COPD 患者90例:纳入标准:⑴符合COPD 的临床诊断标准[5];⑵年龄≥40岁; ⑶近期未使用激素类药物。 排除标准:⑴合并哮喘、肺结核等其他呼吸系统疾病者;⑵肺部及其他脏器系统恶性肿瘤病史或先病者;⑶合并严重心、脑、肝、肾及血液系统疾病者;⑷合并高血压、糖尿病等其他慢性疾病者;⑸结缔组织病、寄生虫感染者。参照相关诊疗指南[5,6],根据是否处于急性发作期分为稳定期组(n=48)与急性加重期组(AECOPD 组,n=42)2 个亚组。
另选同期在本院接受健康体检的性别、年龄匹配的志愿者90 例作为正常对照组,纳入标准:⑴肺功能正常,无呼吸系统病史;⑵既往身体健康状况良好,无慢性疾病史、恶性肿瘤史。 排除标准:⑴重要脏器器质性病变; ⑵近2 个月内发烧或其他感染性疾病; ⑶经体格检查及胸X 线片检查显示异常者。
1.2 检测方法
1.2.1 PBMCs 提取 所有受试者均隔夜空腹8h 以上,晨取空腹外周静脉血5 ml,以肝素钠抗凝,采用Ficoll Hypaque 密度梯度离心法(转速2000r/min 离心30min)离心,留取白膜层细胞,采用PBS洗涤2 次,1500r/min 离心10min,获取PBMCs。
1.2.2 TLRs、NF-κB 及IRAK mRNA 检 测 采 用Trizol 法提取RNA,逆转录反应后采用实时PCR技术检测TLRs、NF-κB 及IRAK mRNA 表达,PCR仪为美国Bio-Rad 公司提供。 反应体系包括4 种dNTPs 混合液各2.5μl,上下游引物各0.4μl,cDNA模板1.2μl,Taq DNA 聚合酶1 U,加入灭菌水至总体积20μl。 反应 条件:95℃30s→95℃5s→60℃25s,循环40 次。 试剂盒由Promega 生物技术公司生产,溶解曲线反应条件:95℃15s→60℃1min→95℃15s。 内参对照为GAPDH,引物由赛默飞世尔科技公司提供。 检测TLR-2、TLR-4、NF-κB、IRAK-1 和IRAK-4 mRNA 表达,引物设计:(1)GAPDH 上游序列5’-TGACTTCAACAGCGACACCCA-3’,下游序列5’-CACCCTGTTGCTGTAGCCA AA-3’,片段大小121bp;(2)TLR-2 上游序列5’-CGGAAGATAATGAACACCAAGAC-3’, 下游序列5’-AGATCCCAACTAGACAAAGACTG-3’,片段大小139 bp;(3)TLR-4 上游序列5’-CCTGTCCCTGAACCCTATGA-3’, 下 游序列5’-CTTCTAAAC CAGCCAGACCTT-3’ ,片段大小137 bp;(4)NFκB 上游 序 列5’-AGGATTTCGTTTCCGTTATGT -3’,下游序列5’-CCTGAGGGTAAGACTTCTTGTTC-3’,片段大小92 bp;(5)IRAK-1 上游序列5’-TGAGGAACACGGTGTATGCTG-3’,下游序列5’-GTTTGGGTGACGAAACCTGGA-3’,片段大小119 bp; (6)IRAK -4 上 游 序 列5’ -CCTGACTCCTCAAGTCCAGAA-3’,下游序列5’-ACAGAAATGG GTCGTTCATCAAA-3’,片段大小119 bp。
1.2.3 结果判定 获得电泳带以Fluor Chem V2.0电容胶成像分析软件进行分析,即5μL 3%琼脂糖凝胶(0.1%溴乙锭)经电泳分析PCR 终产物,采用2-△△CT法计算目标基因相对表达量,△CT=目标基因△CT-参照△CT,相对量(RQ)=2-△△CT。
1.2.4 血清炎症因子检测 受试者均晨取外周静脉血4ml,3000r/min 离心10min 分离血清,保存于-80℃冰箱中统一待测。 采用酶联免疫吸附试验法(ELISA)测定血清白介素(IL)-1β、-6、-8 及肿瘤坏死因子α(TNF-α),BK-EL10C 全自动酶联免疫分析仪及其配套试剂由山东博科医疗器械有限公司提供。
1.3 统计学分析 数据采用SPSS 22.0 统计软件进行分析。 计量资料以均数±标准差(±s)表示,多组比较经单因素方差分析,进一步两两比较经LSD-t检验;计数资料以百分率(%)表示,比较经χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 COPD 组与对照组的临床特征比较AECOPD组中,男33 例,女9 例;年龄45~75岁,平均62.31±8.14岁;病程3~15年,平均11.31±5.17年;第一秒用力呼气量占所有呼气量的比例(FEV1/FVC)为43%~60%,平均49.42±5.16%。 COPD 稳定期组中,男40 例,女8 例;年龄45~75岁,平均60.49±7.96岁;病程2~16年,平均11.52±5.01年;FEV1/FVC为48%~66%,平均58.82±6.74%;对照组中,男68例,女22 例;年龄45~75岁,平均58.98±7.43岁;FEV1/FVC 为82%~89%,平均83.66±8.02%。 三组的一般资料比较,差异均无统计学意义(P>0.05)。
2.2 COPD组与对照组的TLRs、NF -κB、IRAKs mRNA 表达水平比较COPD 组的PBMCs 中TLR-2、TLR-4、NF-κB、IRAK-1 及IRAK-4 mRNA 表达水平均高于对照组,且AECOPD 组高于稳定期组,差异有统计学意义(P<0.05)。 见表1。
表1 COPD 组与对照组的TLRs、NF- κB、IRAKs mRNA 表达水平比较(±s)
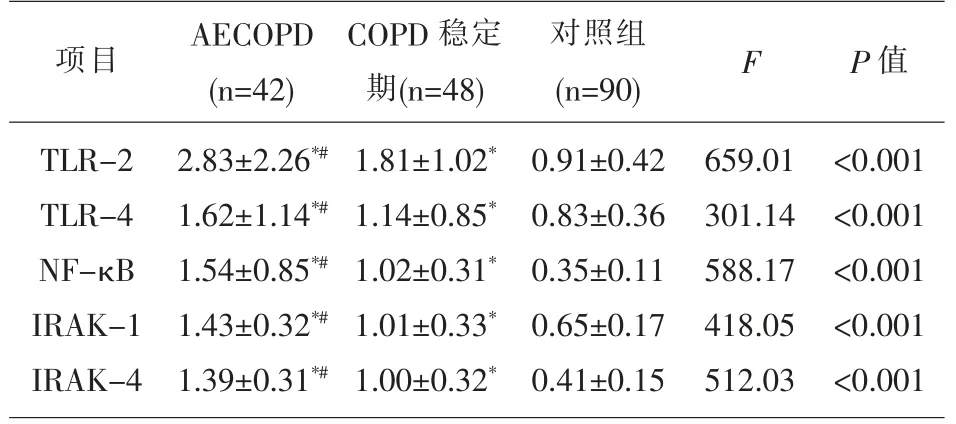
表1 COPD 组与对照组的TLRs、NF- κB、IRAKs mRNA 表达水平比较(±s)
注:与对照组比较,*P<0.05;与稳定期比较,#P<0.05。
COPD 稳定期(n=48)1.81±1.02*1.14±0.85*1.02±0.31*1.01±0.33*1.00±0.32*项目 对照组(n=90) F P 值TLR-2 TLR-4 NF-κB IRAK-1 IRAK-4 AECOPD(n=42)2.83±2.26*#1.62±1.14*#1.54±0.85*#1.43±0.32*#1.39±0.31*#0.91±0.42 0.83±0.36 0.35±0.11 0.65±0.17 0.41±0.15 659.01 301.14 588.17 418.05 512.03<0.001<0.001<0.001<0.001<0.001
2.3 COPD 组与对照组的血清炎症因子谱比较COPD 组的血清IL-1β、IL-6、IL-8、TNF-α 水平均高于对照组,且AECOPD 组高于稳定期组,差异有统计学意义(P<0.05)。 见表2。
表2 COPD 组与对照组的血清炎症因子谱比较(±s)
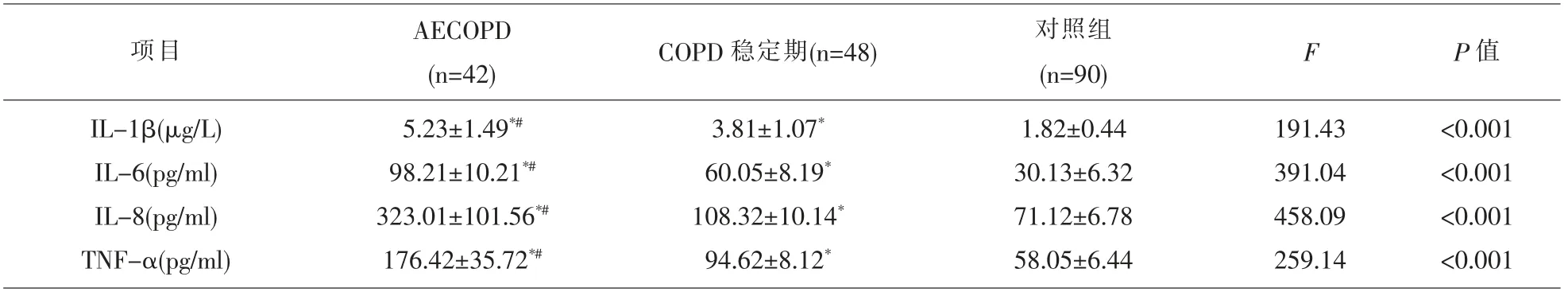
表2 COPD 组与对照组的血清炎症因子谱比较(±s)
注:与对照组比较,*P<0.05;与稳定期比较,#P<0.05。
项目 AECOPD(n=42)IL-1β(μg/L)IL-6(pg/ml)IL-8(pg/ml)TNF-α(pg/ml)5.23±1.49*#98.21±10.21*#323.01±101.56*#176.42±35.72*#COPD 稳定期(n=48)3.81±1.07*60.05±8.19*108.32±10.14*94.62±8.12*对照组(n=90)1.82±0.44 30.13±6.32 71.12±6.78 58.05±6.44 F 191.43 391.04 458.09 259.14 P 值<0.001<0.001<0.001<0.001
2.4 COPD 患者血清炎症因子谱与TLRs、NF-κB、IRAKs mRNA 表达的相关性COPD 患者血清IL-1β、IL-6、IL-8、TNF-α 均 与TLR-2、TLR-4、NFκB、IRAK-1、IRAK-4 呈正相关性,且与FEV1/FVC呈负相关性(P<0.05);且TLR-2、TLR-4、NF-κB、IRAK-1、IRAK-4 与FEV1/FVC 呈负相关性(P<0.05),TLR-2/4、NF-κB、IRAK-1/4 之间互呈正相关性(P<0.05)。 见表3。
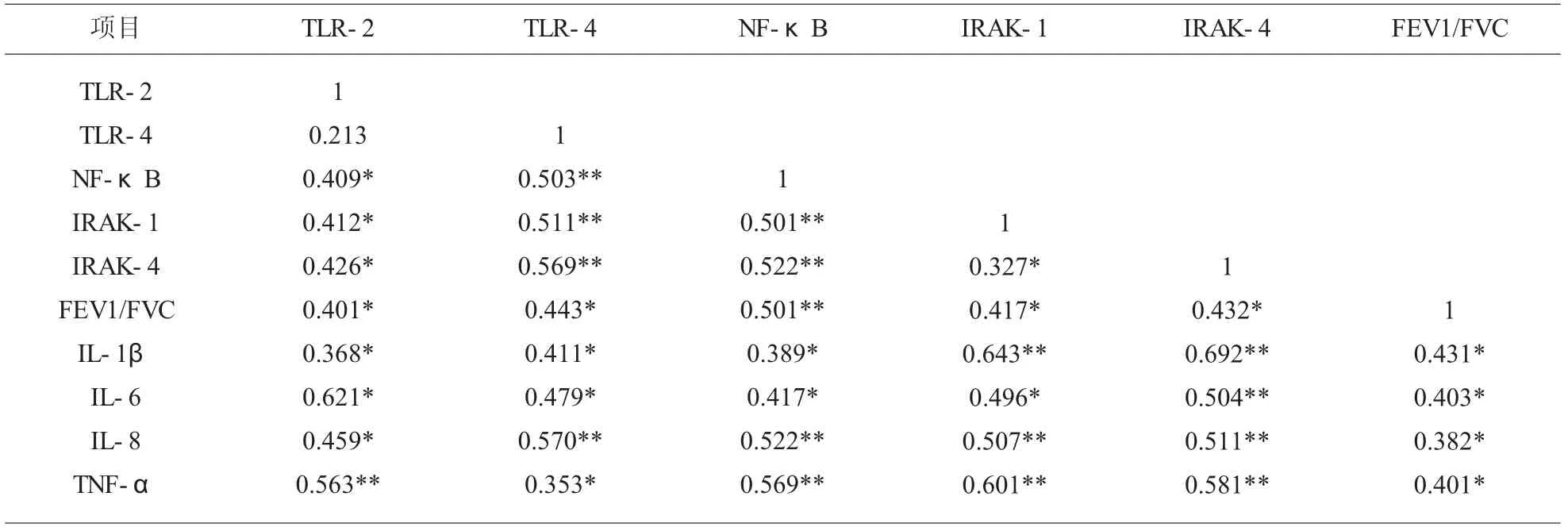
表3 COPD 患者血清炎症因子谱与TLRs、NF- κB、IRAKs mRNA 表达的相关性(r)
3 讨论
COPD 的发病机制目前尚不完全明确,多认为与慢性支气管炎、 长期肺泡上皮细胞及平滑肌上皮细胞重塑、肺气肿等密切相关,尤其是有吸烟史者具有更高的COPD 发病率[7]。 在感染等刺激因素下,COPD 发展为AECOPD 可在短期内出现肺功能恶化,导致严重并发症(肺动脉高压、肺心病等)发生风险升高,增加病死率或远期不良预后风险[8]。因此,研究COPD 尤其是AECOPD 发生及发展的相关生物学机制,对于COPD 的治疗及急性发作的防治具有积极参考价值。
临床研究表明, 免疫-炎症反应紊乱是COPD的重要发病因素和急性加重因素之一[9]。TLRs 参与天然免疫、获得性免疫应答的调节,且在多种炎症反应过程中细胞信号传导、细胞吞噬作用、细胞凋亡等具有重要调节作用[10]。TLR-2 和TLR-4 是TL Rs 的主要亚型, 已有研究证实其在COPD 患者中具有明显高表达,推测其与COPD 患者的肺血管重塑及持续气道炎症反应密切相关[11]。 核转录调控因子NF-κB 在TLRs 信号传导中起着关键作用,大量细胞因子的生成与释放有赖于TLRs 所诱导的NF-κB 信号通路激活[12]。本研究结果显示,COPD 患者PBMCs 中TLR-2、TLR-4、NF-κB 均处于高表达水平,与对照组比较差异有统计学意义(P<0.05)。 提示TLR2/4-NF-κB 信号通路过度激活与COPD 的发生及发展有关。 与此同时,AECOPD 患者的TLR-2、TLR-4、NF-κB mRNA 表达水平均高于稳定期组(P<0.05), 表明AECOPD 患者的TLR2/4-NF-κB 信号通路激活可能较稳定期COPD 更为明显。 考虑为AECOPD 多在感染、有害气体或颗粒刺激等情况下发生,而上述因素均可激活TLR/NFκB 信号通路而扩大炎症反应,引起不可控性炎症反应或炎症反应持续,可诱发肺部病理性改变或肺损伤。 IRAKs 家族是TLRs/IL-1 信号级联家族的重要成员,在TLRs/IL-1 信号通路中发挥着连接、枢纽作用,其中,以IRAK1 和IRAK4 的作用尤为关键[13]。 本研究中,COPD 组PBMCs 中IRAK-1 及IRAK-4 mRNA 表达水平均较对照组明显升高,且在AECOPD 组中表达较稳定期COPD 组进一步升高(P<0.05),证实IRAK-1/4 信号通路在COPD 尤其是AECOPD 中呈高度活化状态,并大量参与气道炎症过程。 考虑为COPD 患者长期处于气道炎症等刺激作用下,呼吸道固有免疫功能受抑,导致患者对细菌的易感性增加,更容易发生呼吸道反复感染,而害气体或物质、感染等刺激可进一步激活TLR2/4-NF-κB、IRAK-1/4 信号通路,故在AECOPD患者中具有更明显的TLR2/4-NF-κB、IRAK-1/4 过表达,这对COPD 的长期控制及AECOPD 的预防提供了一定的理论依据[14]。 相关性分析显示,COPD 患者的TLR-2/TLR-4 与NF-κB、IRAK-1/4 之间均呈正相关性(P<0.05),提示TLR2/4-NF-κB 与IRAK-1/4 信号通路可能通过某种相互作用而参与COPD 的发生及发展过程。
细胞因子异常表达已被证实与COPD 气道炎症的发生及持续具有密切关系,尤其是在肺部感染或COPD 急性发作情况下,多种细胞因子可呈现指数性上升,且其变化幅度与病情严重程度密切相关[15]。IL-1β、IL-6、IL-8、TNF-α 均是经典促炎细胞因子,具有多生物活性,已有研究证实上述因子可介导或扩大 “瀑布效应”,参与气道炎症反应的持续及气道重塑[16]。 本研究中,COPD 患者的血清IL-1β、IL-6、IL-8、TNF-α 水平均高于对照组,且AECOPD 高于COPD 稳定期(P<0.05),与王志英等[17]报道基本相符,说明系统性炎症反应在COPD的发生及发展中具有重要作用,且炎症反应加剧可能与COPD 急性加重发作有关。 进一步相关性分析显示,COPD 患者的血清IL-1β、IL-6、IL-8、TNF-α 水平均与PBMCs 中TLR-2、TLR-4、NFκB、IRAK-1 及IRAK-4 mRNA 表达水平呈正相关性(P<0.05)。 提示在COPD 患者可能长期受到定植菌刺激或存在DAMPs,TLR-2/TLR-4 可能识别并活化NF-κB,或IRAK-1/4 激活NF-κB 而介导下游炎症因子IL-1β、IL-6、IL-8、TNF-α 等的释放,炎性介质或细胞因子又可进一步活化淋巴细胞、激活中性粒细胞等,使气道炎症持续或加重。 同时,研究还显示,血清炎症因子及TLR-2/4-NF-κB、IRAK-1/4 表达水平均与FEV1/FVC 呈负相关性(P<0.05),郭太平等[18]也获得了相似结论,证实炎症反应程度与肺功能关系密切。 由此可见,炎症TLR-2/4-NF-κB、IRAK-1/4 信号通路过度激活及其介导的下游炎性因子高表达与COPD 的发生及病情程度存在一定关联,监测TLR-2/4-NF-κB、IRAK-1/4 信号通路活化情况及其下游炎症因子表达对COPD 的病情评估具有指导意义。
综上所述,COPD 患者存在明显TLR-2/4-NFκB、IRAK-1/4 信号通路激活,在PBMCs 中呈明显高表达,与气道炎症反应持续或加重密切相关,且与COPD 的急性加重、肺功能减低有一定关系。 监测TLR-2/4-NF-κB、IRAK-1/4 信号通路及相关因子表达变化,对COPD 的发病机制研究、临床管理及急性加重的防治具有一定参考价值。
