UiO-66-AO 的制备及其对铀的吸附
2022-01-06孙艳斌高乾宏邵大冬肖无云
孙艳斌,刘 颖,高乾宏,邵大冬,肖无云
1.南京理工大学 环境与生物工程学院,江苏 南京 210094;2.国民核生化灾害防护国家重点实验室,北京 100005
铀矿开采与冶炼、核燃料元件生产以及乏燃料处置过程中会产生大量的放射性污染物。放射性污染物不能通过常规的环境微生物降解和化学降解进行消除[1],并会通过生物富集、食物链以及饮水等途径最终进入人体,以化学毒性和内照射的方式对人类健康产生长远的危害[2-3]。放射性污染物的处理[4]一直是全球广泛关注的主要环境污染问题之一。因此,必须对放射性污染物(如铀)进行有效的处理处置[5],降低并消除其对环境的污染。
放射性废水的处理工艺[6-7]主要有化学沉淀[8]、离子交换[9-10]、蒸发浓缩[11]和吸附[12]等。吸附法由于具有操作简单、吸附效率高、吸附材料来源广泛等优点而被广泛研究。吸附法的关键是高性能吸附剂的研发。UiO 系列[13]材料具有优异的稳定性,在含铀废水处理处置方面具有很好的应用前景。石伟群课题组[14]研究了UiO-66-NH2对U(Ⅵ)的吸附行为,发现其对U(Ⅵ)的吸附容量高达100 mg/g。在众多的铀吸附基团中,研究显示:在其它干扰离子存在的情况下,偕胺肟基[15]对铀酰离子具有较强的亲和性和优异的选择吸附性,因此大量研究者关注偕胺肟基聚合物的吸附法。王祥科课题组[16]在UiO-66-Br上接枝腈基(—CN),再引入偕胺肟基(C(NOH)NH2)制备得到UiO-66-AO,考察了该材料对Eu(Ⅲ)的去除能力,实验结果表明:反应2 h后,UiO-66-AO 对Eu(Ⅲ)的吸附容量达到253.8 mg/g。刘建明等[17]通过在UiO-66-NH2上引入醛基后再通过胺肟化反应得到UiO-66-AO 纳米材料,考察它和UiO-66、Fe3O4@SiO2-AO 不同pH 下的吸附性能,整体上UiO-66-AO 表现出更好的U(Ⅵ)吸附性能,吸附容量达到227.8 mg/g。
基于UiO-66-NH2良好的稳定性和偕胺肟基官能团对U(Ⅵ)的优异吸附性能,本工作拟通过氮杂-迈克尔加成和胺肟化反应将偕胺肟基修饰到UiO-66-NH2表面,制备偕胺肟化UiO-66 材料(UiO-66-AO)。之前的研究大多是在有毒物质或有机溶剂中在UiO-66-NH2上引入腈基[16-17],本工作在水溶液中引入腈基的方式绿色高效,后续的胺肟化反应也简便可行。再利用FTIR、XPS、XRD 等手段对材料微观性质进行表征,采用批实验技术研究UiO-66-AO 对U(Ⅵ)的吸附性能。
1 实验部分
1.1 仪器和试剂
Tensor 27傅里叶变换红外光谱仪、D8AadvanceX射线衍射仪,德国Bruker公司;ASAP 2460比表面积测试仪,美国Micromeritics公司;AXIS Ultra DLD X射线光电子能谱,英国Kratos公司;Optima 8000电感耦合等离子体原子发射光谱(ICP-OES)仪,美国Perkin Elmer公司。
氢氧化钠(纯度为96%,片状)、碳酸钠(纯度≥99.5%)、二甲基亚砜(色谱级,纯度≥99.9%)、三乙胺(分析纯,纯度为99.0%)、N,N-二甲基甲酰胺(色谱级,纯度≥99.9%),上海麦克林生化科技有限公司;2-氨基对苯二甲酸(色谱级)、无水乙醇(分析纯),国药集团化学试剂有限公司;无水甲醇,纯度为99.5%,南京化学试剂股份有限公司;丙烯腈,纯度≥99.0%,上海阿拉丁生化科技有限公司。
1.2 UiO-66-AO 制备
UiO-66-AO 制备流程示于图1。

图1 UiO-66-AO 制备流程Fig.1 Preparation process of UiO-66-AO
UiO-66-NH2制备步骤[18]如下:称取0.134 g 2-氨基对苯二甲酸超声溶解在10 mLN,N-二甲基甲酰胺(DMF)中。将0.125 g四氯化锆加入到含有5 mL DMF和1 mL 浓盐酸中超声溶解。将上述两种溶液混合超声20 min 后80 ℃反应24 h,然后冷却至室温。所得样品用DMF 和乙醇各洗涤离心3次,然后在50 ℃下真空干燥。
UiO-66-CN 制备[19]:将117 mg UiO-66-NH2和0.10 mL 丙烯腈加入7 mL 去离子水中,在120 ℃反应48 h,反应结束后自然冷却至室温。所得样品用甲醇和蒸馏水离心洗涤3 次后在50 ℃下真空干燥。
UiO-66-AO 制备[20]:将UiO-66-CN(0.552 g)、盐酸羟胺(1.29 g)和三乙胺(1.88 g)分散在50 mL乙醇溶液中,在75 ℃下搅拌反应24 h。用乙醇洗涤3 次再离心,所得固体在50 ℃下真空干燥12 h。
1.3 吸附实验
采用批实验(每组3次)研究UiO-66-AO 对U(Ⅵ)的吸附性能。向聚乙烯离心管中加入UiO-66-AO 和NaNO3溶液,然后在振荡器上振荡1 d使UiO-66-AO 和NaNO3在加U(Ⅵ)前达到平衡。加入适量硝酸铀酰和去离子水后调节溶液pH值。当混合溶液在振荡器上振荡一定时间后,在25 ℃下9 000 r/min的转速下离心分离固液相。采用ICP-OES测定溶液中U(Ⅵ)的剩余浓度。UiO-66-AO 对U(Ⅵ)的平衡吸附容量通过式(1)计算。

式中:qe,平衡吸附容量,mg/g;ρ0和ρe分别为初始和平衡时U(Ⅵ)的质量浓度,mg/L;V,溶液体积,L;m,吸附剂质量,g。
2 结果和讨论
2.1 材料表征
UiO-66-NH2、UiO-66-CN 和UiO-66-AO 的红外图谱示于图2。由图2 可知:加成反应后UiO-66-CN 在约2 250 cm-1处出现一个对应于—CN 伸缩振动的新峰,表明丙烯腈成功修饰到UiO-66-NH2表面。UiO-66-CN 经过胺肟化处理反应后,腈基的特征吸收峰(2 250 cm-1)消失,同时在1 653 cm-1和922 cm-1处出现了对应于偕胺肟基的吸收振动的弱峰。这表明胺肟化处理后材料表面—CN 官能团充分转化为—AO 官能团。
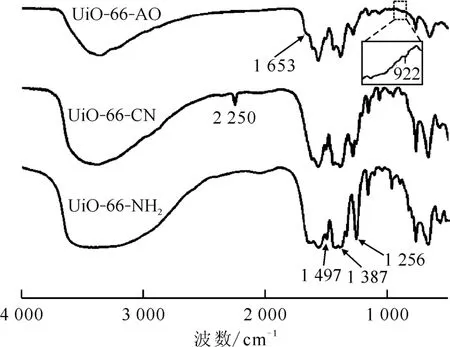
图2 UiO-66-NH2、UiO-66-CN和UiO-66-AO的红外图谱Fig.2 FTIR spectra of UiO-66-NH2,UiO-66-CN and UiO-66-AO
为了进一步证明偕胺肟基引入到UiO-66-NH2上,将胺肟化后的样品进行XPS测试,结果示于图3。由图3可知,在UiO-66-AO 的XPS全谱上可以看到较强的O 1s、C 1s、N 1s和Zr 3d信号,并对N 1s 谱图进行拟合,分别在400.78、399.68 eV和398.98 eV 处分为三个峰,各归属于和Ar NH—,且峰面积之比约为1∶1∶1,进一步说明成功制备出UiO-66-AO。
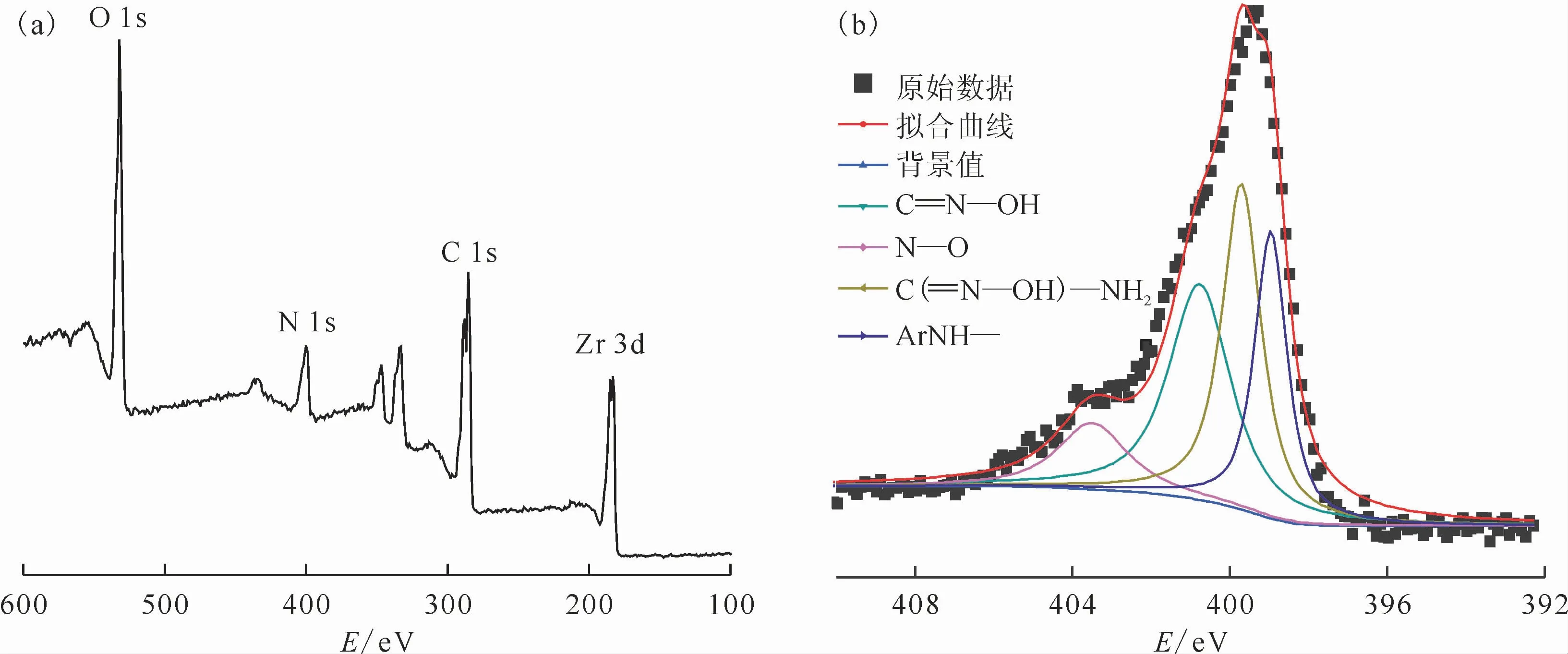
图3 UiO-66-AO 的XPS全谱(a)和N 1s(b)谱Fig.3 XPS survey(a)and N 1s(b)spectra of UiO-66-AO
UiO-66-NH2、UiO-66-CN 和UiO-66-AO 的XRD 图谱示于图4。UiO-66-NH2的XRD 图谱与文献[14]一致,说明UiO-66-NH2制备成功。修饰后样品UiO-66-CN、UiO-66-AO 和UiO-66-NH2的XRD 谱图高度相似,这说明修饰过程未破坏材料的晶格结构。

图4 UiO-66-NH2、UiO-66-CN 和UiO-66-AO 的XRD 图 谱Fig.4 XRD patterns of UiO-66-NH2,UiO-66-CN and UiO-66-AO
2.2 吸附实验
2.2.1 吸附动力学 平衡时间是评价吸附剂实用性的重要参数之一。平衡时间短有利于降低吸附剂用量和操作所需时间,进而降低处理成本。图5为不同温度下UiO-66-AO 对U(Ⅵ)的吸附容量随时间的变化曲线。如图5所示,不同温度下UiO-66-AO 对U(Ⅵ)的吸附容量均随吸附时间的增加而逐渐上升。在吸附初始,由于U(Ⅵ)浓度较高和UiO-66-AO 表面可用吸附活性点较多,吸附速率较快,吸附1 h吸附率达85%;随着吸附的进行,U(Ⅵ)浓度和UiO-66-AO 表面可用吸附活性位点均逐渐降低,吸附速率逐渐下降,并在4 h达到吸附平衡。动力学研究不但能够直观地反映反应的平衡过程及去除能力,还能揭示反应机制。为探究UiO-66-AO 对U(Ⅵ)的吸附机理,采用准一级和准二级动力学方程模型[21]对U(Ⅵ)吸附动力学数据进行拟合,计算相关吸附动力学参数。准一级动力学的线性方程如式(2)。

图5 反应时间对UiO-66-AO 吸附U(Ⅵ)的影响Fig.5 Effect of reaction time on U(Ⅵ)adsorption on UiO-66-AO

式中:k1,准一级动力学常数,h-1;t,反应时间,h;qe,平衡吸附容量,mg/g;qt,t时刻的吸附容量,mg/g。准二级动力学线性方程如式(3)。

式中:k2,准二级动力学常数,g/(mg·h)。两种模型的速率常数以及相应的线性拟合相关系数(r2)结果列入表1。由表1可知:准二级动力学线性拟合r2值更高,这表明UiO-66-AO 对U(Ⅵ)的吸附更符合准二级动力学模型[22]。这表明U(Ⅵ)在UiO-66-AO 表面上的吸附主要受化学吸附控制,且吸附容量与材料表面吸附位点紧密相关。
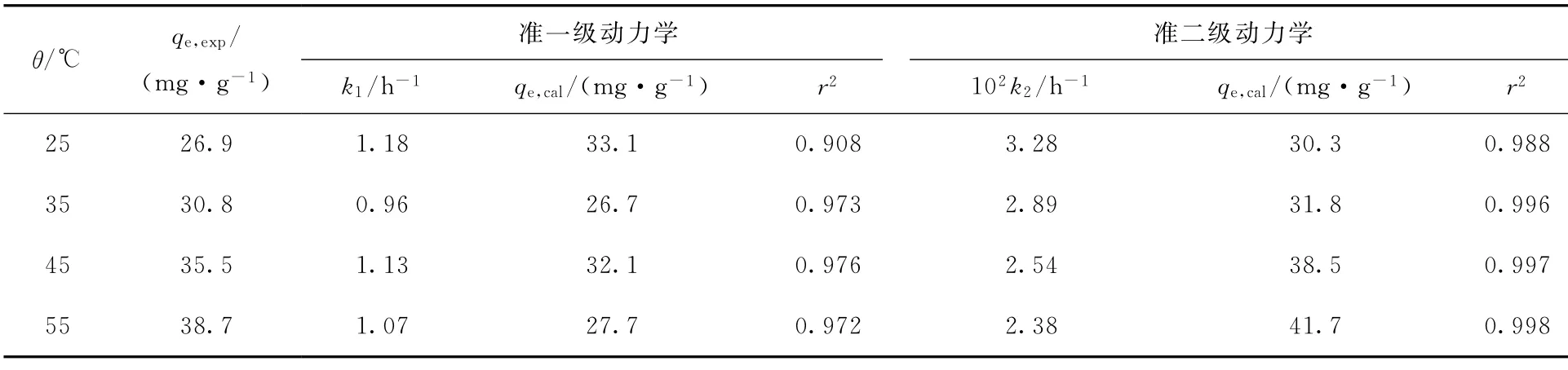
表1 UiO-66-AO 吸附U(Ⅵ)的动力学参数Table 1 Kinetic parameters of UiO-66-AO adsorption for U(Ⅵ)
2.2.2 溶液pH 的影响 pH 对UiO-66-NH2和UiO-66-AO 吸附U(Ⅵ)的影响示于图6。由图6可知:U(Ⅵ)在UiO-66-NH2表面的吸附随着pH 值的增大而上升,当pH 为5~6 时达到最大,然后随pH 值的上升而降低;U(Ⅵ)在UiO-66-AO 表面吸附的变化规律与UiO-66-NH2表面相似。这说明U(Ⅵ)的吸附受溶液pH 值的影响。当溶液pH 较低时,U(Ⅵ)主要以游离形式存在,而吸附剂上的活性位点被质子化并带正电荷。由于静电排斥,带正电荷的不易与同样带正电荷的活性位点结合[17],因此UiO-66-AO对U(Ⅵ)的吸附较小。在高pH 值时,溶液中U(Ⅵ)除了以柱铀矿((UO2)8O2(OH)12·12 H2O)的形式存在,部分以和的形式存在[23],都不易与偕胺肟基配位,导致UiO-66-AO的U(Ⅵ)吸附容量迅速降低。

图6 pH 对UiO-66-NH2 和UiO-66-AO 吸附U(Ⅵ)的影响Fig.6 Effect of pH on UiO-66-NH2 and UiO-66-AO adsorption for U(Ⅵ)
2.2.3 吸附等温线 吸附等温线[24]表示在吸附达到平衡时吸附物质在固-液两相的分布情况,这对于评估UiO-66-AO 对U(Ⅵ)的吸附能力非常重要。考察U(Ⅵ)浓度对吸附的影响,结果示于图7。由图7可知:UiO-66-AO 对U(Ⅵ)的吸附容量随着U(Ⅵ)浓度的增加而逐渐升高,并随温度的升高而逐渐升高,开始增长迅速,之后变得平缓,直至材料的吸附容量达到饱和。这表明高温有利于U(Ⅵ)的吸附。采用Langmuir和Freundlich模型[25]对吸附等温线进行拟合计算,以进一步研究UiO-66-AO 与U(Ⅵ)之间的相互作用关系。Langmuir等温方程如式(4)。

图7 UiO-66-AO 吸附U(Ⅵ)的吸附等温线Fig.7 Adsorption isotherm of UiO-66-AO for U(Ⅵ)

式中:ρe,平衡时液相中U(Ⅵ)的质量浓度,mg/L;qe,平衡吸附容量,mg/g;qm,最大吸附容量,mg/g;KL,Langmuir吸附平衡常数,L/mg。Freundlich模型方程如式(5)。
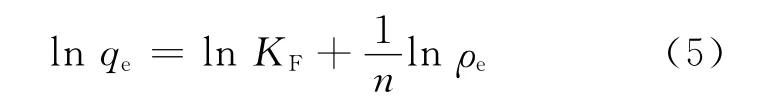
式中:n为经验常数,代表吸附强度,一般认为1/n值越小其吸附性能越好;KF,Freundlich 吸附平衡常数,。两种模型拟合的结果列入表2。由表2可知:Langmuir吸附等温线拟合的r2值均显著高于Freundlich模型拟合结果。因此,Langmuir吸附等温模型更适合描述U(Ⅵ)吸附到UiO-66-AO 的过程。随着温度由25 ℃增加到55 ℃时,UiO-66-AO 吸附U(Ⅵ)的最大单层吸附容量由204 mg/g增加到244 mg/g。相较于先前研究的UiO-66-NH2(吸附容量为100 mg/g)[14]及通过在UiO-66-NH2上引入醛基后再通过胺肟化反应得到UiO-66-AO 纳米材料(吸附容量达到227.8 mg/g)[17],在水溶液中引入腈基制备得到的UiO-66-AO 也表现出良好的吸附U(Ⅵ)的效果。

表2 UiO-66-AO 吸附U(Ⅵ)的Langmuir和Freundlich吸附等温线模拟参数Table 2 Langmuir and Freundlich parameters for U(Ⅵ)adsorption on UiO-66-AO
2.2.4 吸附热力学 吸附热力学主要研究材料吸附过程的表观焓变、表观熵变和表观Gibbs自由能变[26],在吸附过程中是否需要提供能量或者为自发反应。相关热力学方程如下:

式中:Kd,热力学分配系数,L/g;R,理想气体常数,8.314 J/(mol·K);T,吸附平衡时溶液绝对温度,K;ΔH,吸附焓变,kJ/mol;ΔS,吸附熵变,J/(mol·K);ΔG,Gibbs自由能,kJ/mol。通过Van't Hoff方程(6)得到图8,再结合公式(7)和(8)计算UiO-66-AO 吸附U(Ⅵ)的相关热力学参数,结果列入表3。由表3可知:正的ΔS值表明UiO-66-AO 吸附U(Ⅵ)的过程中固-液界面间的混乱度增加;正的ΔH值说明UiO-66-AO 对U(Ⅵ)吸附过程为吸热过程,温度越高越有利于吸附;负的ΔG值表明UiO-66-AO 对U(Ⅵ)吸附过程是自发过程,同时随着温度的升高,ΔG变小,进一步证明温度越高越有利于其吸附的进行。
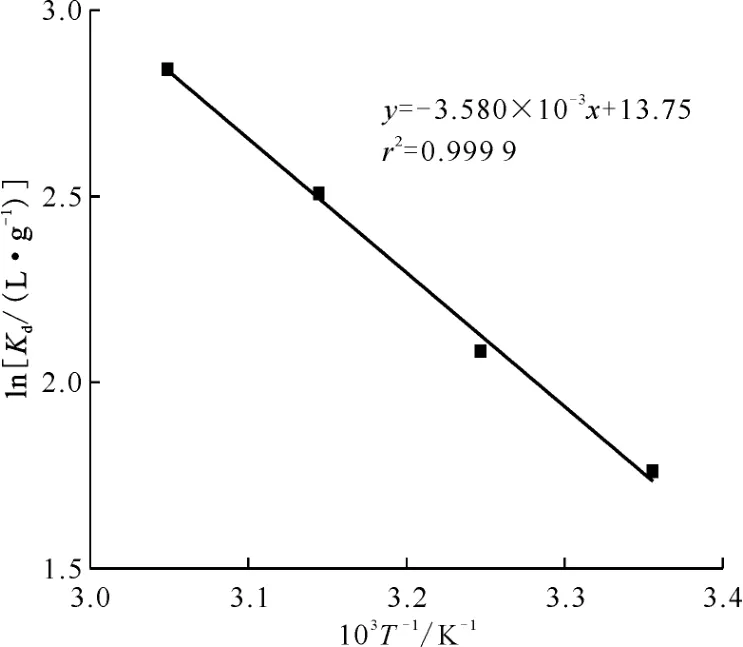
图8 UiO-66-AO 吸附U(Ⅵ)的Van't Hoff图Fig.8 Van't Hoff plot for adsorption of U(Ⅵ)on UiO-66-AO

表3 UiO-66-AO 吸附U(Ⅵ)的热力学参数Table 3 Thermodynamic parameters of UiO-66-AO adsorption for U(Ⅵ)
2.2.5 吸附选择性 为了评估UiO-66-AO 的吸附选择性能及其在实际核工业废水中的潜在应用,采用模拟核工业废水进行研究。金属离子种类和初始浓度列入表4[27]。不同固液比时模拟废水中UiO-66-AO 对U(Ⅵ)的吸附示于图9(a)。由图9(a)可知:随着固液比的增大,该材料对U(Ⅵ)的吸附率越高;当固液比增至5 g/L时,吸附效果最佳,吸附率为95.3%。UiO-66-AO 对模拟核工业废水中不同金属离子的吸附率示于图9(b)。由图9(b)可知:各金属离子的吸附选择性如下:Na+>Zn2+>Co2+>Mn2+>Sr2+。该研究表明在模拟核工业废水中,UiO-66-AO 材料对U(Ⅵ)具有优异的选择吸附性。

图9 不同固液比时模拟核工业废水中UiO-66-AO 对U(Ⅵ)的吸附(a)和吸附选择性研究(b)Fig.9 Adsorption of U(Ⅵ)on UiO-66-AO in simulated nuclear industrial wastewater with different solid-liquid ratios(a)and adsorption selectivity(b)

表4 模拟核工业废水中金属离子的种类和初始浓度[27]Table 4 Species and initial concentrations of metal ions in simulated nuclear industrial wastewater[27]
3 结论
通过氮杂-迈克尔加成和胺肟化反应制备出新型偕胺肟化金属-有机框架UiO-66-AO,并利用FTIR、XPS、XRD 等表征手段对其微观性质进行深入研究。吸附实验表明:UiO-66-AO 对U(Ⅵ)的吸附在4 h达到吸附平衡,吸附过程符合准二级动力学模型;U(Ⅵ)在UiO-66-AO 表面吸附容量最高可达244 mg/g;吸附过程符合Langmuir模型;相关吸附热力学参数说明UiO-66-AO 对U(Ⅵ)的吸附是一个吸热、熵增、自发过程。选择吸附实验结果表明,在众多干扰离子存在情况下,UiO-66-AO 对U(Ⅵ)也具有优异的吸附率,说明其具有潜在的实际应用价值。
