USP39在肝细胞癌中的表达及其与预后、免疫浸润的相关性分析
2022-01-06李浩令包智航仰高伟倪宇轩王文锐
李浩令,包智航,仰高伟,倪宇轩,王文锐,2
(蚌埠医学院 1.癌症转化医学安徽省重点实验室;2.生命科学学院,安徽 蚌埠 233030)
肝癌是临床上发病率极高的肿瘤之一,LIHC是其中最常见的一种,并且肝细胞癌患者死亡率在全球癌症中位居第四位[1]。与肝细胞癌相关的死亡率有逐年上升的趋势[2],这主要因为肝细胞癌患者大多在晚期阶段被确诊,现有治疗方法有限且治疗效果不佳[3]。此外,有研究表明肝细胞癌患者的术后复发率极高,并且肝细胞癌术后复发患者的预后效果较差[4]。因此,寻找潜在的诊断和治疗肝细胞癌患者的生物标志物尤为重要。
泛素化和去泛素化在调节蛋白质定位、代谢、稳定以及控制细胞生理和病理过程中发挥重要作用[5],而泛素特异性蛋白酶39(USP39)是去泛素化酶家族的成员之一,可以阻止蛋白质形成泛素化,从而参与蛋白质稳定性和降解的调节,例如USP39通过去泛素化作用来调节DNA损伤相关蛋白CHK2的稳定性,从而进一步调节肺癌的细胞过程[6]。此外,USP39在癌细胞中的促生长作用已被广泛研究,例如高表达的USP39可以通过靶向EMT和P53途径促进人卵巢癌细胞的增殖和迁移[7];USP39蛋白可通过调控Wnt/β-catenin途径进而促进结直肠癌细胞生长和转移[8];此外USP39蛋白还可通过调控Akt信号通路促进人肾细胞癌恶性增殖[9]。尽管越来越多的研究表明,USP39的异常表达与恶性肿瘤的发生发展相关,但其在肝细胞癌中的预后价值及其生物学作用尚不清楚。
本研究对TCGA-LIHC数据集进行处理,利用生物信息学方法分析USP39表达与肝细胞癌患者临床病理参数及预后的相关性,进一步预测USP39在肝细胞癌中可能参与的生物学过程。此外,我们利用肿瘤免疫评估资源(TIMER)数据库分析USP39与免疫细胞浸润及免疫细胞标志物的相关性。
1 资料和方法
1.1 资料来源本研究中使用的肝细胞癌数据来源于TCGA数据库(https://www.cancer.gov/)和ICGC数据库(https://icgc.org/)。采用Strawberry Perl软件对肝细胞癌基因表达数据及临床数据进行提取和整理,通过网站(https://www.perl.org/)下载安装;使用R软件分析包对肝细胞癌数据进行分析及可视化,通过网站(https://www.r-project.org/)下载安装。
1.2 USP39在肝细胞癌组织中的差异表达从TCGA数据库下载肝细胞癌转录组数据(包含50例正常组织,374例肝细胞癌组织)。同时从ICGC数据库获取肝细胞癌转录组数据(包含202例正常组织,243例肝细胞癌组织),作为USP39差异表达的验证数据集。应用Strawberry Perl软件处理肝细胞癌转录组数据,获取基因表达矩阵;应用R 4.03软件提取USP39的表达数据并利用Strawberry Perl软件获取USP39基因在肝细胞癌组织及其对应正常组织中的表达数据(50对配对数据来自TCGA数据库),然后使用limma包对USP39表达数据做差异分析,以|foldchange|>1.5、FDR<0.05表示基因表达具有差异。此外,使用TIMER数据库(https://cistrome.shinyapps.io/timer/)差异表达模块分析USP39基因在多种癌症中的表达情况。
1.3 USP39表达与临床病理参数及预后的相关性分析应用Strawberry Perl软件将USP39在TCGA-LIHC数据集中的表达数据分别与肿瘤分期,组织学分级和肿瘤大小及肝细胞癌患者生存时间合并。采用Kruskal(KS)检验分析USP39表达与肿瘤分期,组织学分级和肿瘤大小之间的关系;使用Kaplan-Meier法分析USP39高低表达组之间生存率的差异,然后使用ICGC-LIHC数据集对USP39生存分析结果进行验证;采用单因素和多因素Cox回归分析USP39在肝细胞癌中的预后价值。
1.4 USP39单基因富集分析根据TCGA-LIHC数据集中USP39表达量的中位值,将基因表达数据分为高表达组和低表达组。应用GSEA分析软件以分子标签数据库(Molecular Signature Database,MsigDB)中的c2.cp.kegg.v7.2.symbols.gmt数据集作为功能基因集对USP39进行信号通路富集分析。以NES绝对值≥1.0、NOM p-val<0.05、FDRq-val<0.25为条件对USP39单基因富集结果进行筛选。
1.5 USP39与潜在靶基因的相关性分析从USP39相关信号通路中寻找与肝细胞癌发生发展相关的通路,应用Strawberry Perl软件提取USP39基因和目标通路中的关键基因在肝细胞癌组织中的表达数据,然后使用Spearson函数分析USP39与关键基因的关系。0.1≤|r|≤1.0时表示USP39与潜在靶基因具有相关性,P<0.05表示有统计学意义。
1.6 TIMER数据库分析为了更好地了解USP39在肝细胞癌中的作用,使用TIMER数据库中的基因模块探究USP39的表达与免疫细胞浸润(B cells,CD4+T cells,CD8+T cells,neutrophils,macrophages,dendritic cells)水平的相关性;应用相关性模块分析了USP39表达与免疫浸润细胞(Monocyte,tumor-associated macrophage,M1 macrophage,M2 macrophage,Th1,Th2)标志物表达之间的相关性。0.1≤|r|≤1.0时表示USP39与免疫浸润细胞标志物具有相关性,P<0.05表示有统计学意义。
1.7 统计学分析采用R 4.03软件以及Strawberry Perl软件对数据进行处理与分析。应用非参秩检验(Wilcox Test)分析USP39在肝细胞癌组织与正常组织之间的表达差异;应用Kruskal检验分析USP39表达与临床病理参数间的相关性;应用 Kaplan-Meier 分析USP39高低表达组之间生存率的差异;应用单因素和多因素COX回归模型分析USP39在肝细胞癌患者中的预后意义。以P<0.05 为差异具有统计学意义。使用Spearson函数分析USP39与关键基因之间的相关性,0.1≤|r|≤1.0时表示USP39与潜在靶基因具有相关性,P<0.05表示具有统计学意义。
2 结果
2.1 USP39在肝细胞癌组织中的表达水平TIMER数据库分析显示USP39在胆管癌(CHOL)、食管癌(ESCA)、肺鳞癌(LUSC)、肺腺癌(LUAD)、胃癌(STAD)等肿瘤中呈现高表达(图1)。TCGA-LIHC数据集分析显示肝细胞癌组织中USP39的表达量高于正常组织(P<0.05,图2A);对TCGA-LIHC数据集中肝细胞癌组织及相对应的正常组织的分析结果表明,USP39在肝细胞癌组织中的表达高于配对正常组织(P<0.05,图2B)。进一步分析ICGC-LIHC数据集来增加正常组织数量,对243例肝细胞癌组织样本及202例正常组织进行分析,结果表明USP39在肝细胞癌组织中高表达(P<0.05,图2C)。
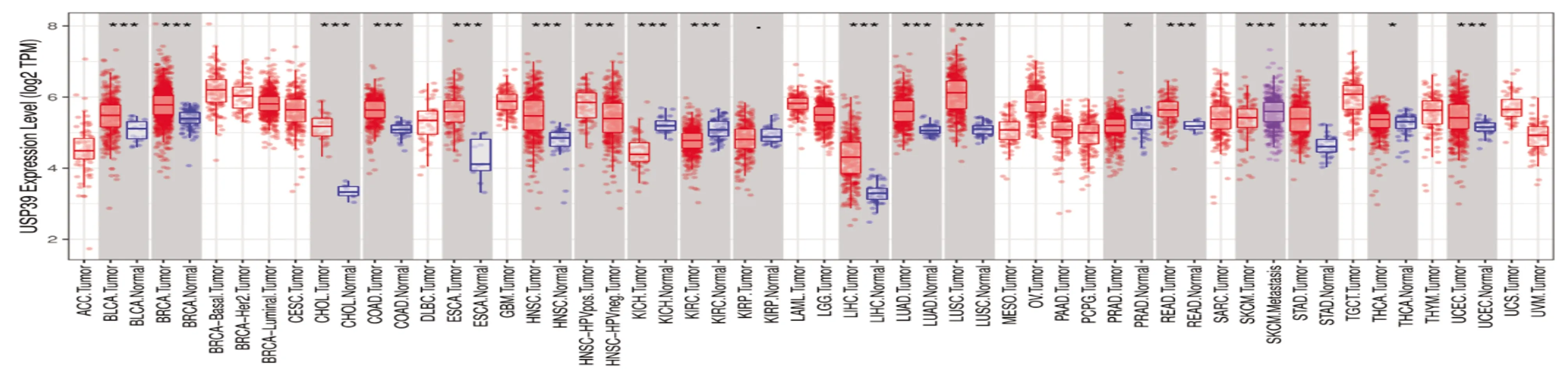
图1 TIMER网站分析TCGA数据库中不同肿瘤类型中USP39的表达情况
2.2 USP39的表达与临床病理参数及预后的关系TCGA-LIHC数据集的分析结果表明。USP39基因表达与肿瘤分期,组织学分级和肿瘤大小具有相关性(P<0.001,图3)。Kaplan-Meier分析结果显示,USP39高表达患者的生存率低于USP39低表达患者(P<0.001,图4A),并且ICGC-LIHC数据集生存分析结果进一步验证了USP39高表达组肝细胞癌患者预后不良(P<0.001,图4B)。单因素Cox回归分析显示肿瘤分期、肿瘤大小和USP39可有效预测肝细胞癌患者的生存(P<0.001,图5A);多因素Cox分析显示,USP39与肝细胞癌患者预后不良相关(P<0.001,图5B),可作为评价肝细胞癌患者的独立预后危险因子。

图5 单因素(A)与多因素(B)独立预后分析
2.3 USP39单基因通路富集分析为了分析USP39在肝细胞癌中可能参与的生物学过程,我们在TCGA-LIHC数据集的基础上对USP39的高低表达组进行GSEA分析。结果显示,USP39与自噬的调节过程相关(图6),USP39高表达可促进肝细胞癌组织中肿瘤细胞的自噬作用。
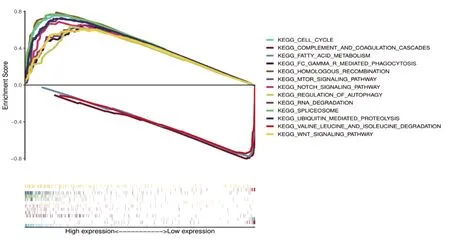
图6 USP39基因的通路富集分析(部分结果)
2.4 USP39与自噬相关基因的相关性肝细胞癌组织中USP39基因与4个自噬相关基因之间的相关性分析显示(r=0.6,r=0.59,r=0.5,r=0.6,均P<0.001,图7),USP39与ATG4B、ATG16L1、BIRC6和TSC1成显著正相关。结合以上分析结果,我们推测USP39可能通过调控ATG4B、ATG16L1、BIRC6和TSC1表达来促进肿瘤细胞自噬,进而对肝细胞癌的发展产生促进作用。
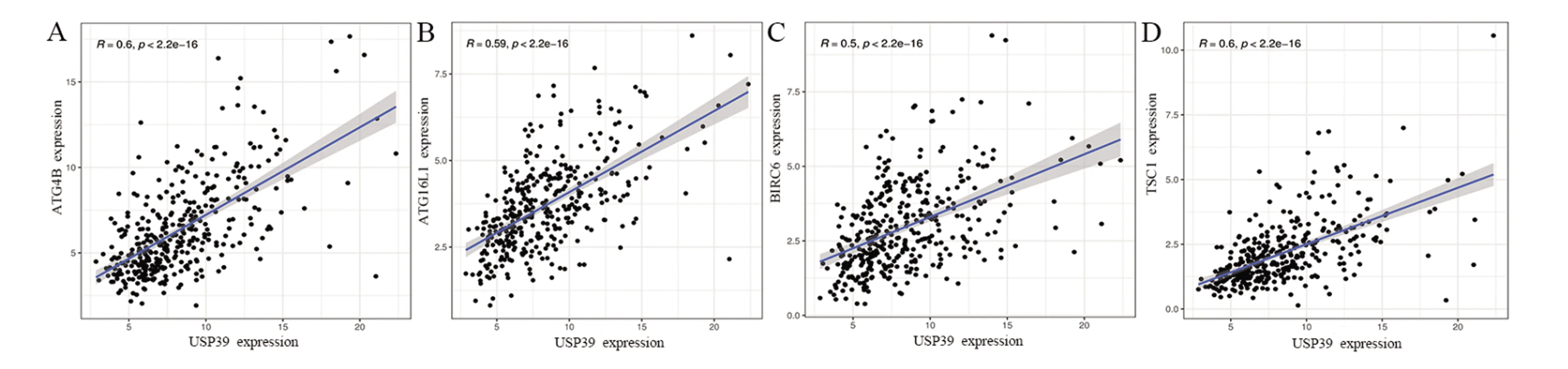
图7 USP39与ATG4B(A)、ATG16L1(B)、BIRC6(C)、TSC1(D)的相关性
2.5 USP39的表达与免疫浸润水平的关系TIMER数据库分析显示(图8),USP39表达水平与肿瘤纯度具有正相关性(r=0.122,P=0.0227);USP39表达水平与B细胞(r=0.363,P<0.001)、CD8+T细胞(r=0.215,P<0.001)、CD4+T细胞(r=0.453,P<0.001)、巨噬细胞(r=0.478,P<0.001)、中性粒细胞(r=0.402,P<0.001)以及树突状细胞(r=0.402,P<0.001)免疫浸润水平成显著正相关。

图8 肝细胞癌中USP39的表达与免疫浸润水平的相关性
2.6 USP39与免疫细胞标记物间的关系采用TIMER数据库分析USP39与免疫细胞表面标志物间的关系。结果显示(均P<0.05,图9和图10),USP39与单核细胞标志物(CD86、CSF1R)、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)标志物(CCL2、CD68、IL10)、M1型巨噬细胞标志物(NOS2、IRF5、PTGS2)和M2型巨噬细胞标志物(CD163、VSIG4、MS4A4A)均呈显著正相关。此外,USP39还与Th1细胞标志物(STAT4、TBX21、CD4、TNF)和Th2细胞标志物(GATA3、CXCR4、CCR8、STAT5A)具有显著正相关的关系。

图9 肝细胞癌中USP39与Monocyte、TAM、M1及M2的表面标志物的相关性

图10 肝细胞癌中USP39与Th1及Th2的表面标志物的相关性
3 讨论
肝细胞癌(LIHC)是全球最常见的消化道恶性肿瘤之一,其主要致病因素包括酒精中毒、药物刺激、肥胖、乙肝病毒和丙肝病毒等[10]。肝细胞癌的治疗关键在于早期确诊以便于患者进行有效的治疗,但大部分肝细胞癌患者都在晚期被确诊。因此,探索肝细胞癌可能的致病机制以及寻找肝细胞癌发生发展中的分子标志物对于肝细胞癌的诊断和治疗具有重要意义。
泛素特异性蛋白酶39(USP39)是一种属于USP家族的半胱氨酸脱嘌呤酶,是剪接体复合物的组成分子之一,参与部分基因的加工过程[11]。最近,有研究报道USP39在多种恶性肿瘤中异常表达并表现出致癌作用。例如,USP39通过促进致癌基因HMGA2的有效剪接,进而在卵巢癌细胞中发挥致癌作用[11];在非小细胞肺癌中USP39作为癌基因发挥作用,而且揭示了敲低USP39可以激活P53途径进而抑制非小细胞肺癌细胞增殖和转移[12];在胰腺癌中,USP39同样也作为癌基因发挥作用[13]。以上研究表明USP39在多种恶性肿瘤中发挥着促癌作用,但其在肝细胞癌中的预后价值以及分子机制尚不清楚。
在本研究中,TIMER数据库分析显示,USP39在CHOL、ESCA、LUSC、LUAD和STAD等恶性肿瘤中呈现高表达。然后通过分析TCGA-LIHC数据集,我们发现USP39基因在肝细胞癌组织中表达水平高于正常组织,并且在ICGC-LIHC数据集的分析中,我们验证了USP39在肝细胞癌中的差异表达。进一步分析显示,USP39与肿瘤分期、组织学分级及肿瘤大小相关,并且USP39高表达提示肝细胞癌患者预后不良。单因素和多因素COX分析显示,USP39可作为评价肝细胞癌患者预后的独立预测指标。为深入研究USP39在肝细胞癌发生发展中的生物学功能及分子调控机制,我们使用GSEA软件对USP39进行单基因富集分析,结果显示USP39高表达可对肿瘤细胞自噬过程产生促进作用,且USP39与自噬调节过程中的关键基因(ATG4B[14]、ATG16L1[15]、BIRC6[16]、TSC1[17])呈显著正相关。已有研究表明自噬作用可促进肿瘤细胞生长[14-17],由此推断USP39高表达可能通过促进肿瘤细胞自噬进而调控肝细胞癌的发展。此外,我们通过TIMER数据库分析,发现USP39与B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、中性粒细胞以及树突状细胞免疫浸润相关,并且USP39表达与单核细胞、TAM、M1和M2巨噬细胞、Th1和Th2细胞的标记基因表达呈正相关。
综上所述,我们发现USP39在肝细胞癌组织中高表达,并且其表达与临床病理参数、预后及免疫细胞浸润具有相关性。同时,我们发现USP39高表达可促进肿瘤细胞的自噬过程,并且其与自噬相关基因呈显著正相关。我们推测USP39具有作为诊断肝细胞癌并预测患者预后的分子标记物的潜力,其可能通过促进肿瘤细胞自噬进而对肝细胞癌的发生发展产生影响。虽然本实验使用生物信息学工具对USP39基因在肝细胞癌中的作用进行深度探索,但尚需要大量基础实验对本研究的预测结果进行验证,为肝细胞癌的诊断和预后提供新的生物标志物。
