干制对生鲜调理草鱼肉贮藏品质和菌群结构的影响
2022-01-05李鸣泽谭雨青罗永康
田 丽 庄 帅 罗 涛 李鸣泽 洪 惠 谭雨青 罗永康
(中国农业大学 食品科学与营养工程学院,北京 100083)
草鱼是我国重要的淡水鱼养殖品种,2020年草鱼养殖总产量为557.108 3万t,占淡水鱼养殖总产量的21.72%[1]。鱼肉由于结缔组织少,水分和蛋白质含量高,pH偏中性等原因适合微生物生长而腐败变质。调理草鱼肉是淡水加工产品中的一种,经过调理不仅可以改善鱼肉的风味,而且可以延长鱼肉的货架期[2]。
鱼肉的水分约占整体质量的75%~80%,包括结合水、不易流动水和自由水。水分含量高不仅使微生物活跃,同时其中的酶活性也高,易造成鱼肉的腐败变质。干制是指在受控条件下通过加热和传质的方式将鲜鱼的水分含量降低到不利于细菌生长和繁殖的低水分含量水平,是一种传统的鱼类加工和保存方法,具有成本低,易操作的特点[3]。然而在目前鱼肉干制的研究中,大多数将鱼肉的水分含量降低至15%~40%,研究方向主要集中在比较不同干燥方式对鱼肉品质的影响以及最适干燥工艺方面[4-6]。虽然这些研究中鱼肉的水分含量和菌落总数降低了,但是过度的干燥也增大了鱼肉的硬度和咀嚼性,降低弹性,促进蛋白质的降解和脂肪氧化,降低亮度,增强黄度,造成褐变等,使鱼肉的品质变差[7-8]。
为了降低鱼肉蛋白降解和脂肪氧化程度,保证其具有较好的质构、色泽和感官品质,需要控制鱼肉的脱水程度,但是降低脱水程度是否能延长鱼肉的货架期还有待进一步研究。本研究拟以生鲜调理草鱼肉为研究对象,通过降低鱼肉的脱水程度,研究生鲜调理草鱼肉在(4±1)℃贮藏过程中的品质变化,以期为延长生鲜调理草鱼肉贮藏时间提供研究基础。
1 试验材料与设备
1.1 试验材料
本试验于2020年12月在中国农业大学食品科学与营养工程学院进行。鲜活草鱼,购自北京市朝阳区喜龙生鲜超市,体长为(52.8±1.0)cm;体重(1 392±71)g;三磷酸腺苷(ATP)关联物和生物胺标准品购自美国Sigma-Aldrich公司;丙酮、乙腈、甲醇购自Fisher Scientific公司;高氯酸、磷酸二氢钠、磷酸氢二钠、氢氧化钾、氨水购自北京化学试剂公司;三氯乙酸、硼酸、氧化镁,氯化钠购自国药集团化学试剂有限公司;BCA试剂盒购自南京建成生物工程研究所;无菌均质袋购自Interscience公司。
1.2 仪器设备
BCD-251 WBCY冰箱,青岛海尔股份有限公司;FE-20 pH计,Mettler Toledo公司;DSHZ-300A水域恒温振荡器,苏州培英实验设备有限公司;T18分散剂,德国IKA 公司;GL-21M冷冻离心机,长沙平凡仪器表有限公司;LC-16高效液相色谱仪,江苏苏州岛津仪器有限公司;P4紫外分光光度计,上海美谱达仪器有限公司;NR110手持色差仪,深圳Threenh科技有限公司。
2 试验方法
2.1 样品预处理
在聚乙烯塑料袋中装入适量干净的水,将18条草鱼放入袋中,向袋中充满氧气并密封,然后将其运输到实验室。将活草鱼迅速敲击其头部致死,刮鳞,去内脏,冲洗干净后将每条鱼片成4片,鱼片长宽厚约10 cm×10 cm×2 cm,鱼片用无菌水冲洗干净,在不锈钢网架上晾10 min后分别装入聚乙烯保鲜袋中;将鱼片质量10%的水和鱼水总质量1.5%的无碘食盐溶解于烧杯中,将盐水分别加入保鲜袋中,将其置于4 ℃腌制12 h。
腌制结束后,将所有鱼片随机分成3组,每组24片。具体分组如下:对照组,盐腌后不脱水;脱水6%组,盐腌后干燥脱去鱼片质量6%的水分;脱水12%组,盐腌后干燥脱去鱼片质量12%的水分。
2.2 鱼肉干燥
对照组不干燥,脱水6%和12%组采用干燥箱分别对鱼肉脱水6%和12%,干燥温度50 ℃,风速1.5 m/s,风向与鱼片平行,相对湿度50%~55%,由前期实验得到的干燥曲线拟合得到不同组的干燥时间:脱水6%组44 min,脱水12%组87 min。干燥完成后将鱼片装于聚乙烯保鲜袋中,贮藏于4 ℃,分别于第1、3、5、7、9、11、13天随机从每组取3片鱼肉进行指标的测定,并于第1和13天提取3组鱼肉中微生物的DNA以测定鱼肉中微生物的组成。
2.3 菌落总数的测定
菌落总数的测定参照Zhuang等[9]的方法。在超净工作台中取5 g鱼肉于无菌拍打袋,向袋中加入45 mL无菌生理盐水,在拍打机中拍打1 min,将拍打液进行10倍梯度稀释,选择3个适当的稀释梯度,涂布100 μL均质液在平板计数琼脂上,将平板置于30 ℃培养箱中48~72 h后进行微生物计数,菌落总数表达单位为lg(CFU/g)。
2.4 菌群结构的测定
菌群结构的测定参照Liu等[10]的方法。经过提取得到的细菌DNA用干冰运送至上海美吉生物医药科技有限公司,委托该公司采用第二代测序技术进行PCR扩增和产物纯化以及细菌16S rRNA基因V3~V4区的测序。
2.5 挥发性盐基氮TVB-N质量分数的测定
挥发性盐基氮TVB-N的测定参照Li等[11]的方法。称取搅碎的鱼肉5 g于离心管中,加入50 mL 蒸馏水,均质2 min,摇床上振荡30 min,4 000 r/min 离心5 min,吸取5 mL上清液与5 mL氧化镁(10 g/L)混合,蒸馏5 min。锥形瓶中加入10 mL硼酸溶液(20 g/L)和100 μL甲基红-次甲基蓝指示剂(2 g/L)以吸收溜出物,用0.01 mol/L的盐酸标准溶液滴定吸收液至蓝紫色,蒸馏水为空白对照。
2.6 TCA-可溶性肽质量摩尔浓度的测定
TCA-可溶性肽质量摩尔浓度的测定参照Zhuang等[12]的方法。称取1 g搅碎的鱼肉于离心管中,加入9 mL 50 g/L的三氯乙酸溶液,均质1 min,碎冰中放置30 min,4 ℃、10 400 r/min离心5 min,取7~8 mL上清液储存于-20 ℃冰箱。TCA-可溶性肽采用Lowry蛋白法进行测定,其质量摩尔浓度以每克肉中含的酪氨酸摩尔当量表示,μmol/g。
2.7 感官评价
感官评价参考Berizi等[13]的方法,并做少许调整。感官小组由训练有素的9名实验室成员组成,男女比为4:5,年龄为22~32岁,感官小组成员分别对鱼肉的色泽、气味、质地和总体可接受度进行5分制打分,评分标准见表1。

表1 生鲜调理草鱼肉感官评价评分标准Table 1 Sensory evaluation standard of fresh prepared grass carp flesh
2.8 ATP关联物及K值的测定
ATP关联物的提取和测定参照Li等[14]的方法。称取1 g鱼肉进行ATP关联物的提取,提取液和ATP关联物标准品用0.22 μm的超滤膜过滤后,在高效液相色谱上进样测定,液相色谱条件:COSMOSIL 5C18-PAQ反相色谱柱(4.6×250 mm),流动相A为0.05 mol/L磷酸盐缓冲液(pH 6.8),流动相B为甲醇,流速1 mL/min,进样量50 μL,检测波长为254 nm。通过将样品中各峰的保留时间和峰面积与标准品对比进行ATP关联物的定性和定量分析。
2.9 生物胺质量分数的测定
生物胺的提取及测定参照Zhuang等[9]的方法。称取2 g搅碎的鱼肉进行生物胺的提取,提取液及生物胺标准品衍生后,用0.22 μm的有机膜过滤,在高效液相色谱上进样测定。液相色谱条件:COSMOSIL 5C18-PAQ反相色谱柱(4.6×250 mm),流动相A为0.1 mol/L醋酸铵溶液,流动相B为乙腈,流速0.8 mL/min,进样量50 μL,检测波长为254 nm。通过将样品中各峰的保留时间和峰面积与标准品对比进行生物胺的定性和定量分析。
2.10 数据统计与分析
所有试验指标均测3个平行,试验结果用平均值±标准差的形式表示,使用IBM公司统计软件SPSS 17.0中的Duncan法对试验数据进行差异显著性分析,显著水平为5%。
3 结果分析
3.1 感官评价
3组鱼肉的感官评分均随着贮藏时间的延长而降低(图1)。在贮藏第9和11天,脱水12%组的色泽评分显著高于对照和脱水6%组(P<0.05),但贮藏第13天各组间无显著差异。3组鱼肉的气味评分除第5天外均无显著性差异。脱水6%和12%组在贮藏第1、11和13天质地评分显著高于对照组(P<0.05)。从第9天开始,脱水6%和12%组的总体喜好度评分显著高于对照组(P<0.05)。
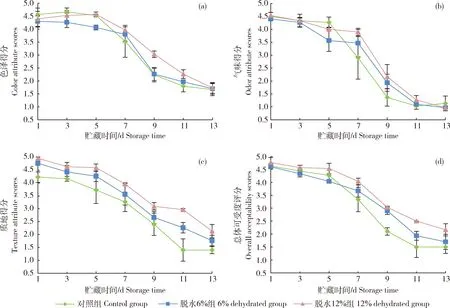
标记点上黑色竖线表示平行数据间的标准偏差,图2~4同。The black vertical line on each point represents the standard deviation between parallel data.Figs 2 to 4 are the same as Fig.1.图1 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中色泽(a)、气味(b)、质地(c)和总体可接受度(d)的变化Fig.1 Changes in color (a),odor (b),texture (c)attributes scores and overall acceptability scores (d) of fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
3.2 菌落总数
对照、脱水6%和12%组初始菌落总数分别为4.2、4.0和4.8 lg (CFU/g)(图2)。随着贮藏时间的延长,各组的菌落总数均增长,然而在第7、9和11天,各组间无显著差异,说明在此期间脱水6%和12%组微生物生长比对照组慢。对照和脱水6%组的菌落总数在第7天,脱水12%组在9天超过7 lg (CFU/g),说明脱水12%能够有效控制生鲜调理草鱼肉中微生物的生长。

图2 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中菌落总数的变化Fig.2 Changes in total viable counts of fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
3.3 TVB-N的质量分数
对照、脱水6%和12%组初始TVB-N质量分数(w)分别为10.15、9.92和10.38 mg/100 g(图3(a))。随着贮藏时间的延长,各组的TVB-N质量分数均增长,在第5、7和9天,w(TVB-N)在脱水6%和12%组中均高于对照组,脱水12%组在第5和第9天具有显著差异(P<0.05),其他贮藏时间各组间无显著差异。在贮藏第13天,对照、脱水6%和12%组的TVB-N质量分数分别增长至20.88、19.72和21.35 mg/100 g,脱水6%组最低。
3.4 TCA-可溶性肽的质量摩尔浓度
对照、脱水6%和12%组初始TCA-可溶性肽质量摩尔浓度(b)分别为1.88、2.04和2.38 μmol/g(图3(b))。在贮藏前11 d,各组的b(TCA-可溶性肽)增长缓慢,之后各组均增长显著(P<0.05)。第9天,脱水12%组显著高于其他组(P<0.05),而其他时间各组间无显著差异。在贮藏第13天,对照、脱水6%和12%组的TCA-可溶性肽分别增长至4.13、3.86和4.62 μmol/g,脱水6%组最低。
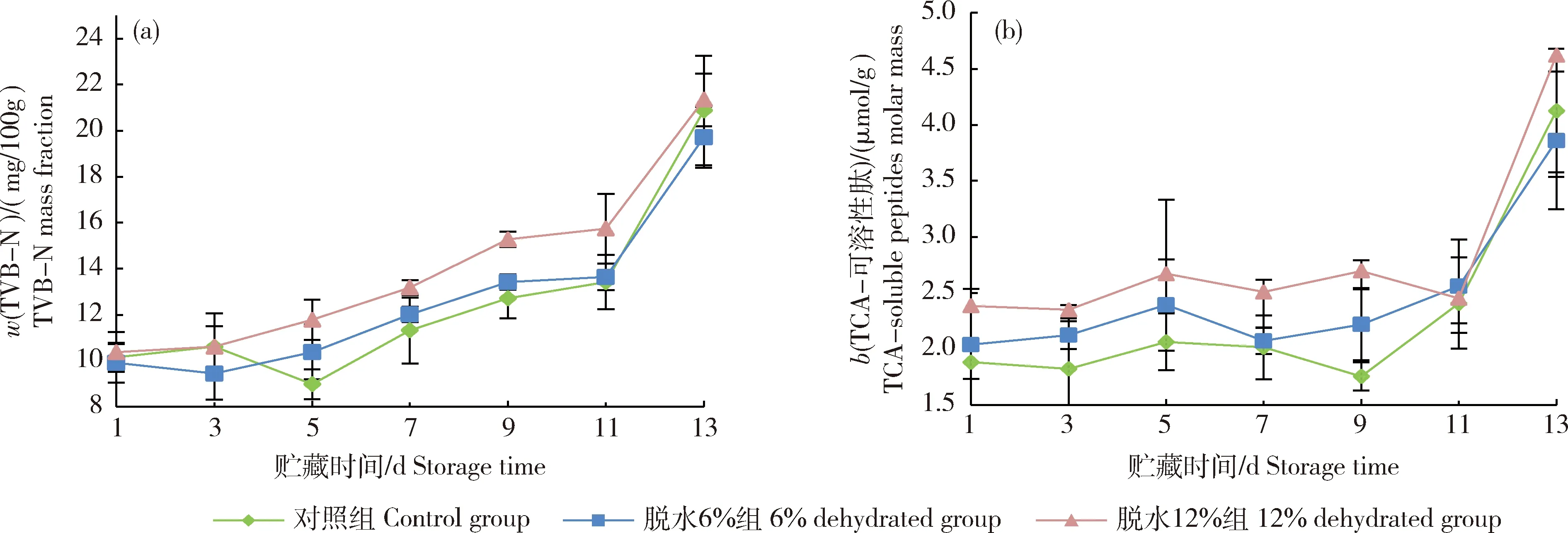
图3 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中TVB-N质量分数(a)和TCA可溶性肽质量摩尔浓度(b)的变化Fig.3 Changes in TVB-N mass fraction (a)and TCA-soluble peptides molality (b)of fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
3.5 ATP关联物及K值
对照、脱水6%和12%组初始b(5′-肌苷酸IMP)分别为4.40、3.18和2.12 μmol/g(图4),各组的b(IMP)随贮藏时间的延长而降低,第7和9天,对照和脱水6%组显著高于脱水12%组(P<0.05),而在第13天,脱水6%和12%组显著高于对照组(P<0.05)。对照、脱水6%和12%组初始b(次黄嘌呤核苷HxR)分别为0.76、0.58和1.24 μmol/g,随着贮藏时间的延长,对照组的b(HxR)先升高后降低,而脱水6%和12%组一直升高,并在贮藏第11和13天,脱水6%和12%组显著高于对照组(P<0.05)。对照、脱水6%和12%组初始b(次黄嘌呤Hx)分别为0.04、0.39和0.79 μmol/g,初始K值分别为12.77%、21.55%和41.87%,随着贮藏时间的延长,3组的b(Hx)和K值均逐渐增加。在贮藏前5 d,对照组K值显著低于脱水6%和12%组(P<0.05),而在贮藏第7、9和11天对照和脱水6%组无显著差异。
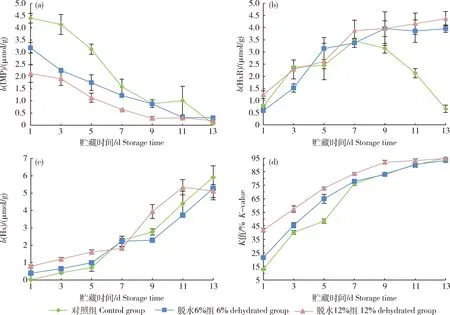
图4 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中IMP (a)、HxR (b)、Hx (c)质量摩尔浓度和K值(d)的变化Fig.4 Changes in IMP (a),HxR (b),Hx (c)molality and K-value (d)of fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
3.6 生物胺的质量分数
对照、脱水6%和12%组初始腐胺质量分数分别为1.73、1.38和1.36 mg/kg(表2),3组的腐胺随着贮藏时间的延长而增加,在贮藏第9、11和13天,脱水6%组腐胺质量分数显著低于对照组(P<0.05),在贮藏第11和13天,脱水6%和12%组无显著差异(P<0.05)。对照、脱水6%和12%组初始尸胺质量分数分别为4.31、3.26和3.96 mg/kg,在贮藏过程中,各组的尸胺虽有波动,但整体仍然呈现升高的趋势,在贮藏第11和13天,脱水6%组尸胺质量分数显著低于另外2组(P<0.05)。

表2 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中生物胺的变化Table 2 Changes in biogenic amines of fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
3.7 菌群结构
高通量测序共检测到248 533个有效序列,各组的覆盖率均高于0.999,表明测序深度较高。Alpha多样性分析发现随着贮藏时间延长,Ace和Shannon指数减小(图5(a)和5(b)),且在不同时间点脱水6%和12%组的Shannon指数均低于对照组,说明贮藏和干制都会降低微生物的多样性。对照、脱水6%和12%组初始相对丰度最大的菌属分别为Rhodococcus、Aeromonas和Macrococcus,相对丰度分别为21.56%、23.88%和79.92%(图5(c)),不同组之间的初始优势菌群存在很大差异。贮藏13 d后,对照组的优势菌属变为Shewanella(相对丰度23.46%),脱水6%组的优势菌属变为Pseudomonas(相对丰度27.42%),脱水12%组优势菌属变为Pseudomonas(相对丰度45.96%),不同组的菌群发生变化,对照组和2个脱水组的优势腐败菌明显不同。

横轴的处理表示脱水程度和贮藏时间,如0%,1 d表示对照组贮藏1天。Treatment on the horizontal axis of the figures represents dehydration degrees and storage time.For example,0%,1 d represents the 1st day of storage in the control group.图5 不同脱水程度生鲜调理草鱼肉4 ℃贮藏过程中菌群Alpha多样性((a)和(b))及属水平上菌群的相对丰度(c)Fig.5 Alpha diversity estimation of microbiota (including Ace (a)and Shannon (b)indexes), composition,and relative abundance of microbiota at the genus level (c)in fresh prepared grass carp fillets with different dehydration degrees during storage at 4 ℃
4 讨 论
4.1 不同脱水程度草鱼肉冷藏过程中理化特性的比较
随着贮藏时间的延长,鱼肉的各项品质逐渐劣化。对照组在贮藏末期肉色发绿,肌肉软化,表面粘液较多,氨味浓郁。脱水6%和12%组经过干燥后色泽变黄,质地变硬,在贮藏末期表面粘液产生少。与对照组相比,贮藏末期脱水6%和12%组的质地评分和总体可接受度更高。Wan等[15]也发现热风干燥的草鱼肉黄度值更大,鱼肉色泽发黄与干燥温度、干燥方式以及水分蒸发量有关[16]。脱水6%和12%组的TVB-N质量分数和b(TCA-可溶性肽)高于对照组,且脱水程度越大,其含量越高,这与Kim等[5]的研究结果相似,可能是因为热风干燥的温度适宜微生物的生长,同时一些蛋白酶的活性增强,二者的共同作用促进了鱼肉蛋白质的降解[17],使得脱水6%和12%组的TVB-N质量分数和b(TCA-可溶性肽)高于对照组。在贮藏过程中ATP被降解为二磷酸腺苷ADP、一磷酸腺苷AMP、IMP、HxR和Hx[18]。随着贮藏时间的延长,不同脱水程度组的b(IMP)持续降低,脱水6%和12%组在贮藏前5天b(IMP)显著低于对照组(P<0.05),可能是由于在干燥过程中温度适宜,与IMP降解相关的酶活性增强,促进了IMP的降解。随着贮藏的进行,脱水6%和12%组的b(HxR)不断增加,对照组b(HxR)先升高后降低,b(HxR)后期降低是因为HxR被降解为Hx,脱水6%和12%组的b(HxR)在贮藏后期(7~13 d)较高,说明2个脱水组HxR的降解被抑制。HxR降解为Hx主要与微生物有关[14],脱水组和对照组贮藏后期HxR变化趋势不同,可能是贮藏末期的优势腐败菌不同造成的[11,19]。虽然脱水6%和12%组贮藏后期HxR的降解被抑制,但是脱水12%组的b(Hx)和K值在9和11 d显著高于另外2组(P<0.05),脱水6%组的b(Hx)在9、11和13 d比对照组低,其K值在第13天也显著低于对照和脱水12%组(P<0.05),说明并非脱水程度越高越好,脱水6%组在抑制HxR降解、Hx的产生和K值增长方面效果更好。贮藏末期脱水6%和12%组的腐胺质量分数低于对照组,脱水6%组的尸胺质量分数也显著低于对照组和脱水12%组,说明希瓦氏菌产生腐胺和尸胺的能力较强,这与Wang等[20]的研究结果相似,他们发现Shewanellaputrefaciens能产生较多的尸胺。综合各指标来看,与对照和脱水12%组相比,脱水6%组贮藏末期的感官、TVB-N、TCA-可溶性肽、HxR和Hx等指标优于另外2组。因此,有效控制脱水程度和脱水时间有助于生鲜调理草鱼肉贮藏品质的提升,但是脱水12%组未能达到理想效果,可能是因为脱水12%组所需的干燥时间稍长,且本研究采用的干燥温度稍高,干燥条件适宜鱼肉中微生物的生长及相关酶活性的增强,从而未能提升草鱼肉的贮藏品质。为提升草鱼肉干制后的贮藏品质,后期应进一步探讨更低脱水程度和更低脱水温度对生鲜调理草鱼肉品质的影响。
4.2 不同脱水程度草鱼肉冷藏过程中微生物特性的比较
在贮藏初期,脱水6%和12%组菌落总数高于对照组,可能是空气中存在一定量的微生物,鱼肉在干燥时不可避免的和空气接触而沾染到了,导致其初始菌落总数较高。虽然经过干燥其初始菌落总数较高,但是在贮藏中后期脱水6%和12%组的菌落总数和对照组无显著差异(P>0.05),说明干燥后鱼片的微生物在贮藏过程中生长较慢,干燥对贮藏过程中微生物生长具有一定的抑制作用。
假单胞菌、气单胞菌、希瓦氏菌是生鲜鱼肉中常见的3种优势腐败菌[21-22],在初始时对照、脱水6%和12%组主要菌属分别为Rhodococcus、Aeromonas和Macrococcus。在腐败时生鲜鱼肉中常见的腐败菌逐渐占优势,对照组的优势腐败菌为Shewanella,而脱水6%和12%组的优势腐败菌为Pseudomonas,脱水组和对照组的优势腐败菌明显不同,说明干燥改变了生鲜调理草鱼肉的菌群结构。
5 结 论
干燥能够改变生鲜调理草鱼肉的菌群结构,对照组的优势腐败菌为Shewanella,脱水6%和12%组的优势腐败菌均为Pseudomonas。干燥对鱼肉中细菌的抑制作用不明显,对TVB-N和TCA-可溶性肽的产生、IMP的降解以及K值的增长无明显抑制作用,但是经过干燥可以有效提高生鲜调理草鱼肉的感官品质,其质地评分和总体可接受度更高,贮藏后期HxR降解缓慢,腐胺和尸胺的产生较少。然而并非脱水程度越高越好,以本研究结果看,脱水6%组能在一定程度上延缓生鲜调理草鱼肉的腐败变质。
