大白母猪发情期前后唾液蛋白组学分析
2022-01-05李晨雷齐昆龙刘蓥珂叶建伟李新建王克君李秀领乔瑞敏韩雪蕾
李晨雷 齐昆龙 刘蓥珂 叶建伟 李新建 王克君 李秀领 乔瑞敏 韩雪蕾
(河南农业大学 动物科技学院,郑州 450046)
在猪生产过程中,发情鉴定的准确性是影响母猪繁殖性能的重要因素。目前采用的发情鉴定法如外部观察法、压背反应法和公猪试情法有工作量大、准确率低等缺点,有些异常发情如安静发情、短促发情、持续发情等情形很难把握配种时机,易造成鉴定准确度不高、异常发情判断不准和重复配种资源浪费的现象[1],与此同时各类家畜新型发情鉴定法的研究也从未停止,唾液[2]、血液[3]、尿液[4]等各种体液中差异表达的生物分子已成为诊断母畜发情的重要标靶。
唾液主要由腮腺、舌下腺和下颌腺三对唾液腺及口腔黏膜下大量小唾液腺分泌物组成,主要有水和一些非蛋白类有机物(如尿酸、胆红素、肌酸酐、葡萄糖、脂肪酸等)及一些蛋白类或多肽类物质(如α-淀粉酶、白蛋白、分泌型免疫球蛋白A、富酪蛋白等),另外,还含有一些激素(如皮质醇、睾酮、黄体激素、雌二醇、醛固酮等)和核酸物质(如miRNA)等[5-6],人体内绝大多数的代谢产物、激素和抗体等可经过血液的被动扩散、主动转运等方式进入唾液,唾液的成分复杂而且相对稳定。唾液是动物体内重要且必需的体液,唾液中含有丰富的类固醇激素、DNA等,并含有高分子敏感度的RNA、氧化应激标志物等成分,近年来,除了血浆、血清和尿液外,唾液已成为检测人类和动物生理、病理状态的有效工具[7]。研究发现,人的唾液中含有2 000多种不同的蛋白,以及2 000多种低分子量的多肽片段,占分泌蛋白比重的40%~50%[8],唾液与血液重叠部分蛋白质含量约为27%,有40%的蛋白质作为肿瘤、心血管疾病等的候选标志物被发掘,在上个世纪以前,唾液已被人类用于检测疾病和健康评估,吕磊等[9]采用酶联免疫法发现妇女唾液和血液中的E2含量成正比,且与卵泡大小和数目呈显著相关,因此可通过检测唾液E2含量侧面反映血浆游离激素水平,用于临床实践。Lindsay等[10]研究证实唾液是准确的临床指标,可以用来衡量游离型激素的含量并诊断HPA轴的功能不佳。目前唾液检测在动物中的应用,主要在猪病检测方面,包括PRRSV、猪流感病毒、猪口蹄疫病毒、猪圆环病毒2型和猪瘟病毒等病原体的抗原抗体检测[11-15]。近年来,诸多研究证实,唾液和血液中的激素、药物、抗体、病毒等的含量具有较高的相似度[16-22]。唾液采集相对于传统的血液采集具有明显的优势,具有简便性、无创性、样本易于储存和运输等特点,同时在进行唾液采集时,动物处于主导地位,与被动性的采血相比较能更真实的反映动物机体的状态,可明显减少动物的应激反应[23]。唾液检测是无创检测领域的一个热点,具有很大的发展潜力和应用前景,目前通过唾液蛋白标记物对母猪进行发情鉴定还未见报道。
因此,本研究通过对大白母猪发情周期不同阶段的唾液样品进行蛋白组学测序和分析,以揭示发情母猪唾液中蛋白质水平变化规律,筛选与发情相关的唾液蛋白,为母猪准确发情鉴定提供重要参考,并为下一步母猪发情鉴定试剂盒/试纸条的开发提供借鉴。
1 材料与方法
1.1 试验动物和样品采集
选取4头三胎经产大白母猪,猪舍类型为全封闭猪舍,大圈饲养模式,每圈8~10头母猪,猪舍内温度控制在15~22 ℃,湿度保持在45%~60%,饲养环境适宜,繁殖机能正常,健康无遗传疾病。发情鉴定采用外部观察法和压背反应法综合鉴定母猪发情,在试验期间每天早上、中午和晚上分别对实验母猪进行观察,每次观察30 min,当母猪出现躁动不安,食欲减退,阴部充血、肿胀并有粘液分泌和爬跨其他猪等行为时,在猪鼻上喷洒公猪气味剂并用力按压背部,母猪静立不动并弓背竖耳即鉴定为发情,发情日当天记为第0天。采用咀嚼式方法对发情前后生殖激素含量变化明显的3个阶段进行唾液采集[24],包括发情前期(PE/Proestrus):发情前3天,发情期(E/Estrus):发情当天和发情后期(AE/After estrus):发情后3天。唾液采集时间为每天早上饲喂前(早6:00—早7:30),4 ℃,4 000 g低温离心后收集上清液,置于-80 ℃冰箱中保存备用,供后续使用Lable-free定量蛋白组学技术进行唾液蛋白组测序。
1.2 样品消化和酶水解
分别采集4头经产母猪3个阶段的唾液,按不同阶段分别转移至3 ku超滤管,4 ℃ 7 000 g离心浓缩,加入1 mL 25 mmol /L ABC,4 ℃ 7 000 g 30 min 离心3次,每次吸取滤膜上层保留的液体(约100 μL)。每份样本加100 μL SDT裂解液,100 ℃ 金属浴3 min,离心取上清。于-80 ℃中取出样本蛋白质裂解液,冻融,取1 μL进行BCA法定量。根据定量结果取20 μg蛋白质样本进行SDS-PAGE电泳。取各样品300 μg进行FASP酶解。样品加入200 μL UA buffer(8 mol Urea,150 mmol Tris-HCl pH 8.5)混合摇匀,在室温下14 000 g离心30 min,弃滤液,此步骤重复3次。加100 μL IAA(50 mmol IAA in UA),600 r/min 振荡1 min,室温避光300 r/min 孵育30 min,14 000 g 室温离心30 min。加入100 μL UA buffer后室温14 000 g离心30 min,重复3次。然后加100 μL 25 mmol/L ABC,相同条件离心,重复3次。滤出液弃置后加入40 μL Trypsin buffer(2 μg Trypsin in 40 μL 100 mmol/L ABC),放置恒温混匀仪上(300 r/min,18 h,37 ℃)。室温14 000 g离心30 min,收集滤出液并换新收集管后加入40 μL 100 mmol/L ABC,室温14 000 g离心30 min,取滤液,OD280肽段定量。
1.3 质谱分析
样品酶解后进行毛细管高效液相色谱脱盐以及分离,之后使用Orbitrap-Elite 质谱仪进行质谱分析。使用自动进样器,以150 nL/min的流速将每个样品共1 μg上到Thermo Scientific EASY柱(两柱)上。多肽和多肽碎片的质量电荷比按照每次全扫描后采集10个碎片图谱(MS2 scan)的方法采集,MS2 Activation Type:CID,Isolation window:1 m/z,质谱仪在正离子模式下运行,母离子扫描范围为300~2 000 m/z。Orbitrap Elite在200 m/z的一级质谱和二级质谱扫描分辨率分别设置为60 000 at m/z和15 000 at m/z。选取获得的质谱中最强烈的10个信号进行进一步的分析。
1.4 数据库检索、蛋白质鉴定与定量
LC-MS/MS质谱检测使用的系统为ABSCIEX Triple TOFTM 5 600 plus质谱系统,AB SCIEX分析柱,使用标准化的质谱数据流程进行分析。
对于鉴定到的蛋白质,蛋白鉴定分值(Unused score)≥1.3(即可信度水平在95%以上)且每个蛋白至少包含一个唯一肽段的蛋白定义为可信蛋白。按照LFQ值对蛋白进行Fold Change(FC)计算,利用Persus软件(Version1.4.1.3,http:∥www.coxdocs.org/doku.php?id=perseus:start)中Significant A算法对FC进行显著性参数PValue计算。
使用Maxquant软件进行分析,将质谱数据由谱峰形式转化为直观的双向凝胶图谱,图上每一个点代表一个肽段,通过比较不同样本上相应肽段的强度,从而对肽段对应的蛋白质进行相对定量,选择肽匹配图谱(PSM)FDR<0.01和肽段 FDR<0.01进行筛选[25]。
1.5 数据分析
对鉴定到的蛋白质通过LFQ值进行Fold change(FC)计算、P Value计算,并且按照表达倍数上调≥1.5且P<0.05进行筛选,使用Uniprot蛋白数据库(www.Uniprot.com)进行分析,并设置3个比较组:E vs AE、E vs PE和AE vs PE。将筛选出来的差异蛋白进行Gene Ontology (GO)功能注释和KEGG 信号通路分析,筛选差异蛋白富集的GO功能和KEGG信号通路,并利用 String数据库(http:∥string.embl.de/)和Cytoscape(http:∥www.cytoscape.org/)软件对差异蛋白进行网络互作分析[26]。
2 结果与分析
2.1 大白母猪发情周期唾液蛋白质鉴定
通过对发情周期3个阶段的唾液蛋白组数据进行分析,分别得到2 205、1 918和2 104个肽段,共鉴定出405个蛋白,其中PE、E和AE分别有290、191和318个蛋白质(表1),分子量分布主要在 10~20 ku、20~30 ku、30~40 ku、40~50 ku、50~60 ku的范围内,占总蛋白的73.43%,其中有78.27% 被鉴定的蛋白有3个及以上的肽段(图1(a)和(b))。对鉴定到的405个唾液蛋白进行蛋白聚类分析,其中PE、E和AE 3个阶段共有蛋白数量为149个,PE和E,PE和AE,E和AE阶段共有蛋白的数量分别为8、79和9个,PE、E和AE分别有54、25和81个特异蛋白(图2和3)。
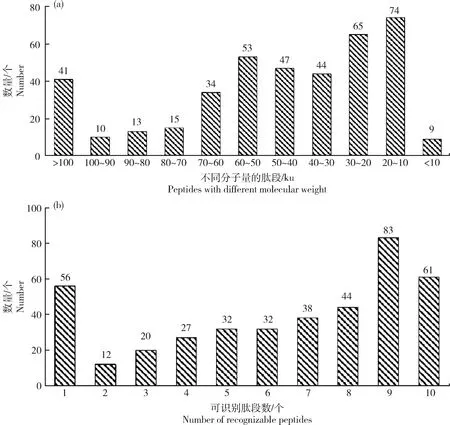
(a)不同分子量的肽段数量;(b)可识别不同肽段的蛋白质数量(a)The number of peptides with different molecular weight;(b)The number of proteins recognizing different peptides图1 发情周期唾液蛋白质鉴定与分析Fig.1 Identification and analysis of salivary proteins during the estrus cycle

图2 发情周期唾液蛋白聚类热图Fig.2 Heat map of salivary protein clustering during estrus cycle
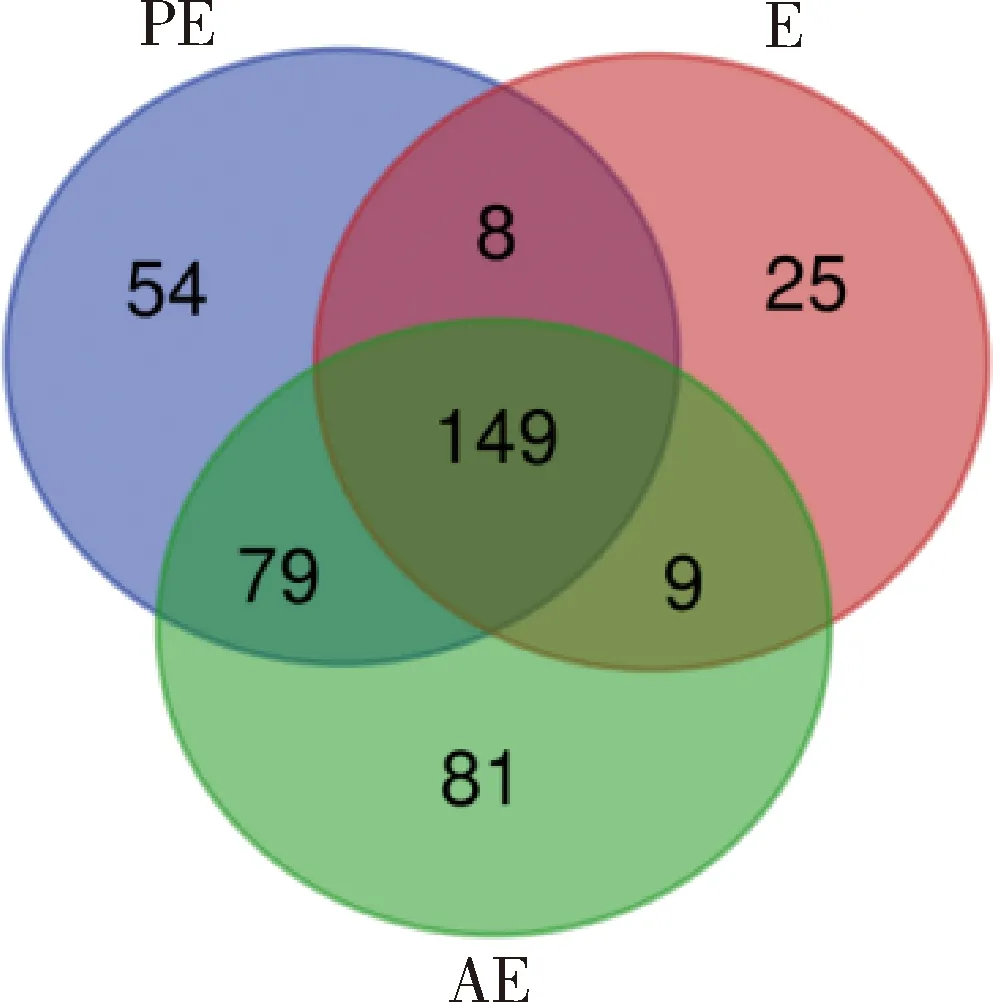
图3 发情周期唾液蛋白鉴定韦恩图Fig.3 Quantitative Wayne diagram of salivary protein during estrus cycle
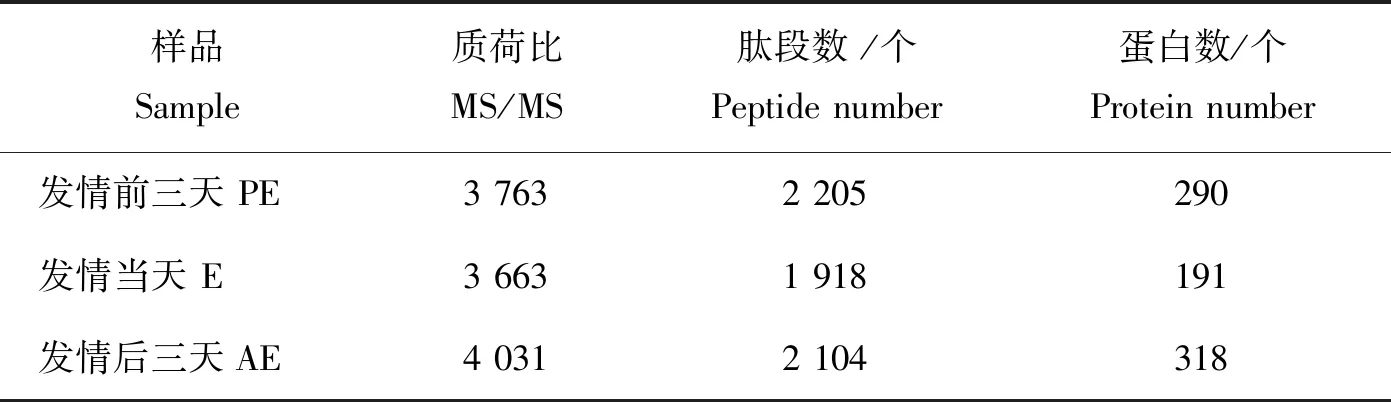
表1 发情周期不同阶段唾液蛋白统计与分析Table 1 Statistics and analysis of salivary protein in different stages of estrous cycle
2.2 大白母猪发情周期唾液差异蛋白的筛选与分析
对鉴定到的蛋白质进行差异显著性分析,共得到45个差异蛋白质,如图4所示,在E vs PE 组,有18个蛋白差异达到显著水平,包括6个上调和12个下调蛋白(P<0.05);E vs AE组,有17个差异显著蛋白,包括8个上调和9个下调蛋白(P<0.05);在PE vs AE组中,共有10个蛋白差异达到显著水平,其中包括9个上调和1个下调蛋白(P<0.05)。

图4 发情周期唾液差异蛋白聚类热图Fig.4 Heat map of salivary differential proteins in estrus cycle
2.3 大白母猪发情周期唾液差异蛋白GO和KEGG富集分析
对筛选出的45个差异显著蛋白进行GO和KEGG富集分析,结果显示,其参与富集显著的GO条目主要涉及分子功能和细胞过程,包括小分子结合、急性时相反应、内肽酶活性的负调控、DNA损伤后内源性凋亡信号通路的负调控等;参与的细胞组分有胞外区,胞外区包含垂体促性腺激素复合物等(P<0.05),KEGG通路主要包括胰高血糖素信号通路、丙酸代谢、丙酮酸代谢、长时程增强效应和光转导等(P<0.05),结果如表2和3所示。
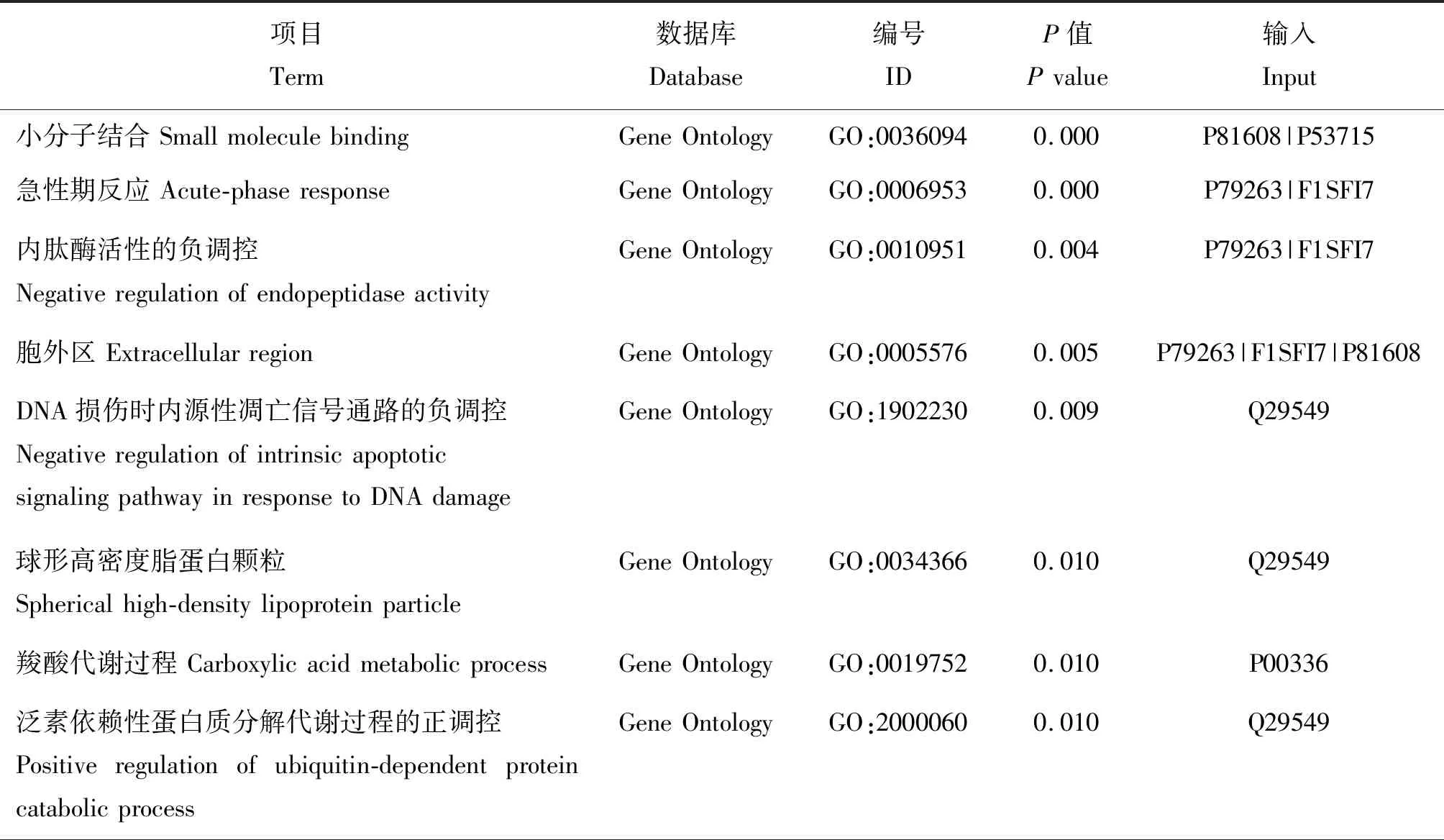
表2 发情周期唾液差异蛋白GO富集分析Table 2 Go enrichment analysis of salivary differential protein during estrus cycle

表2(续)
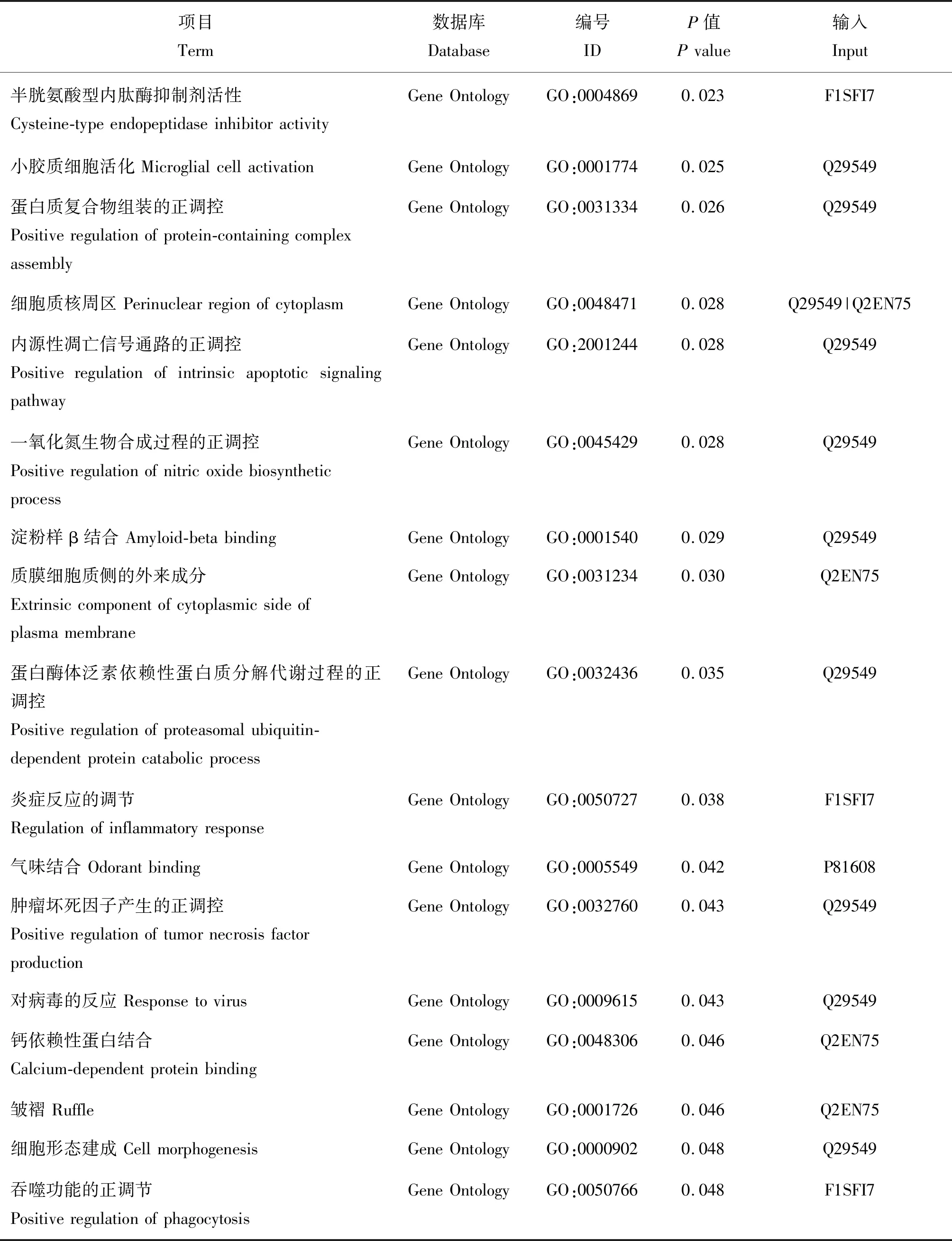
表2(续)
2.4 蛋白质互作(PPI)网络分析
为进一步揭示筛选到的差异蛋白功能,利用Cytoscape软件对富集的差异和特异蛋白进行蛋白互作分析,结果如图5所示,F1SFI7与P79263、Q29549、F1SS24、Q9GMA6,Q9GMA6与Q2EN74、Q29549、F1SS24,F1SS24与Q29549间均存在互作关系,其中F1SFI7和 Q9GMA6蛋白间互作最强。
3 讨 论
母猪发情周期除受到温度、光照和营养水平等外因的影响外,也与神经系统和内分泌系统等内因密切相关。众所周知,雌激素、孕激素、促黄体生成素、促卵泡素等均与发情有关。激素在体内通常以与受体蛋白结合的形式发挥作用。在发情周期的不同阶段,参与激素调控的蛋白不同,在生物体中,蛋白质并不是独立存在的,不同蛋白质通过彼此间相互作用共同行使功能,因此对激素相关蛋白质间互作及其调控网络的研究,对于揭示发情周期调节机理具有重要意义。本研究通过对大白母猪发情周期前后唾液蛋白组进行测序和分析,共筛选到45个显著差异蛋白和160个特异蛋白,通过功能注释与分析筛选出F1SFI7、P79263、Q29549、F1SS24、Q9GMA6、Q2EN74和P00336 7个潜在的与发情过程密切相关的唾液激素蛋白,其中Q9GMA6和F1SS24为PE期的特异蛋白质,Q2EN74为E期的特异蛋白质,F1SFI7、P00336和Q29549为E期显著上调的差异蛋白,P79263为PE期显著上调的差异蛋白。
α-2-HS-糖蛋白(F1SFI7),别名胎球蛋白由AHSG编码,它的主要功能是参与骨稳态的调节。在Qiu等[27]的研究中指出雌激素通过与c-Jun/c-Fos异二聚体间接结合ERα与-1488/-1482 AP-1结合元件激活AHSG的转录;Eichner等[28]研究了不同等位基因AHSG对定量雌激素、雌酮和雌二醇的影响,结果表明AHSG的2个主要等位基因导致3种表型,不同表型导致不同的雌二醇和雌酮含量,这些研究表明AHSG与雌激素浓度显著相关。簇蛋白(Q29549)由CLU编码,它的主要功能是作为细胞外伴侣,防止非天然蛋白质聚集。Cappelletti等[29]和Toffanin等[30]研究证明CLU的沉默或下调可以使乳腺癌细胞恢复对托瑞米芬(抗雌激素)的敏感性,雌激素受体做为一种蛋白质分子,比较多的存在于靶器官的细胞内,如卵巢和子宫,雌激素与雌激素受体发生特异性结合,进而使雌激素发挥其生物学效应,蛋白互作分析显示AHSG和CLU间存在互作关系,蛋白定量结果表明其表达模式也相同,均在E期显著性上调(P<0.05),推测AHSG和CLU相互作用影响雌激素浓度或雌激素受体的敏感性。钙调蛋白(F2Z5G3)由STPG4编码,其与钙介导的信号转导有关,在Lu等[31]研究中指出,F2Z5G3是cAMP信号通路和钙离子信号通路的信号分子,其下调会抑制P4(孕酮)的分泌,同时上调雌二醇的合成,雌二醇与孕酮是由卵巢、胎盘与肾上腺分泌的激素,在特定生理阶段具有拮抗作用,因此推测F2Z5G3可能通过cAMP信号通路调控雌二醇和孕酮的表达从而影响发情表现。
抗胰凝乳蛋白酶(Q9GMA6)由SERINA3-2编码,SERPINs(丝氨酸蛋白酶抑制剂家族)参与调节蛋白酶的活性,贾银海等[32]和Fu等[33]研究表明SERPINs家族中的SERPINA14和SERPINA3-1等参与调节卵泡细胞外基质的重塑和卵泡的发育,因此,推测SERPINA3-2可能与卵泡的发育有关。α-胰蛋白酶抑制剂重链H4(P79263)由ITIH4编码,它的主要功能是参与创伤后炎症反应,Patil等[34]研究团队在对多囊卵巢综合征(PCOS)的蛋白组学研究中发现,ITIH4在多囊卵巢综合征患者的卵泡液中呈显著下调趋势,其在血管生成和细胞外基质稳定中起作用,对卵泡成熟至关重要。本研究蛋白互作分析结果显示ITIH4和SERINA家族与AHSG之间存在互作关系,并且SERINA家族和AHSG之间相互作用关系最强,前者影响卵泡发育,后者与雌激素浓度显著相关,蛋白定量结果表明SERPINA3-2为PE期的特异蛋白质,ITIH4在PE期显著性上调并且AHSG在E期显著上调(P<0.05),因此,推测这些蛋白在卵泡发育过程中可能通过影响雌激素合成从而影响母猪的发情。乳酸脱氢酶(P00336)由LDHB编码,其主要功能是将丙酮酸发酵为乳酸,除了已被证实在调节糖酵解方面有作用以外,Marianna等[35]通过对子宫内膜异位症患者的卵泡液代谢组学分析发现LDHB的表达与卵母细胞质量有关,Poulsen等[36]对人体排卵过程中卵泡液成分蛋白组学定量分析发现LDHB在整个排卵期的表达具有显著变化,并在排卵12~17 h后达到高峰,蛋白定量结果表明LDHB在E期显著上调(P<0.05),这与Poulsen等的研究相符。卵泡液主要由卵泡细胞分泌,促卵泡激素可直接促进窦前卵泡和窦状卵泡颗粒细胞的增殖与分化,使卵泡液分泌增加进而维持卵泡的生长发育。在卵泡发育过程中,促卵泡素和促黄体生成素发挥重要作用,其中促黄体生成素可以促进雄激素分泌,雄激素可为雌激素的合成提供底物,促进卵母细胞的排出,因此推测LDHB与促黄体素和雌激素的生成有关,从而影响发情。
综上所述,通过对发情周期不同阶段唾液蛋白进行分析,其中AHSG、CLU和LDHB在E期显著性上调,SERPINA3-2为PE期的特异蛋白并且ITIH4在PE期显著上调,推测AHSG和CLU相互作用影响雌激素生成或雌激素受体的敏感性,LDHB与促黄体素和雌激素的生成有关,ITIH4和SERPINA3-2可通过影响卵泡的发育和成熟从而调控发情,还需要后续试验验证,下一步将针对筛选出的候选蛋白进行抗原抗体制备和配对检测,ELISA试剂盒检测方法构建,试纸条检测和分析等实验,对筛选到的蛋白进行验证,为开发发情鉴定试剂盒并在生产中推广和应用打下坚实的基础。
4 结 论
本研究采用Lable-free定量蛋白组学技术对经产大白母猪发情期及发情前后3个阶段的唾液蛋白组进行测序与分析,筛选到F1SFI7、Q29549、Q2EN74、Q9GMA6、P00336、P79263和F2Z5G3 7个蛋白作为指示发情的潜在候选蛋白,为下一步发情鉴定试剂盒/试纸条的开发提供借鉴。
